一种新型多吡啶钌配合物的合成及其太阳光谱响应特性*
2011-11-26王文秀郑明花金京一
胡 祥, 曲 坤, 王文秀, 郑明花, 金京一
(延边大学 长白山生物资源与功能分子教育部重点实验室,吉林 延吉 133002)
二茂铁(FcH)[1]作为典型的茂金属目前已经被广泛应用于不对称催化化学[2~4]、聚合物化学[5]以及光性能材料[6]和磁性材料[7]的众多领域。虽然已有文献[8,9]报道将FcH引入金属络合物中,但其引入过程一般较为复杂、反应条件较为苛刻。
本文报道一种简捷的合成多吡啶钌配合物的新方法。以FcH和4-甲基吡啶为起始原料,通过金属催化偶联、氧化、溴乙酰化及环合反应制得一种新型的二茂铁噻唑衍生物4-二茂铁-2-(2-吡啶)基噻唑(2-FPT);以2-FPT为第一配体,2,2′-联吡啶-4,4′-二甲酸(dcbpy)为第二配体,与二异苯丙基氯化钌进行配位,成功将二茂铁基团引入到多吡啶钌配合物体系当中,合成了一种新型的光敏化染料Ru(dcbpy)2(2-FPT)(1, Scheme 1),其结构经元素分析和时间飞行质谱表征。用UV-Vis对2-FPT和1的太阳光谱响应特性进行了研究。


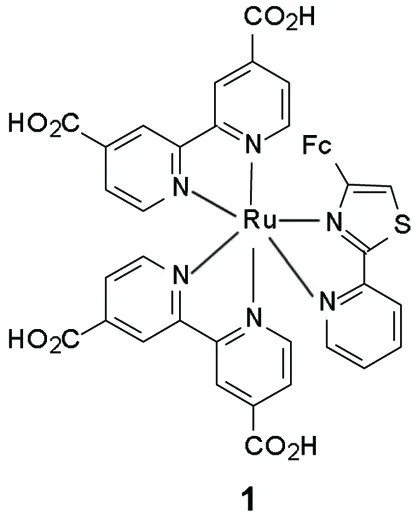
Scheme1
1 实验部分
1.1 仪器与试剂
X-5型显微熔点仪;HP UV-8453型紫外光谱仪;Bruck AV-300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Elementary Vario MICRO CUBE型元素分析仪;Kratos PC Axima CFR plus V2.4.0 System型时间飞行质谱仪。
溴乙酰氯(总收率88.2%)[12]和dcbpy(总收率54.5%)[10,11]按文献方法合成;2-吡啶甲酰胺、溴乙酸、4-甲基吡啶及四丁基氢氧化铵(TBAOH),Acros;二异苯丙基氯化钌,Sigma-Aldrich;其余所用试剂均为市售分析纯。
1.2 合成
(1) 单溴乙酰二茂铁(2)的合成
将AlCl3360 mg(2.7 mmol)和溴乙酰氯850 mg(5.4 mmol)溶于干燥的CH2Cl2得溶液A。
在反应瓶中加入FcH 1.0 g(5.4 mmol)和CH2Cl220 mL,搅拌使其溶解;冰水浴冷却,缓慢滴加溶液A,滴毕,于室温反应4 h~5 h。倾入150 mL冰水中,有机相用CH2Cl2(3×50 mL)萃取,合并有机层,用饱和NaHCO3洗至pH 8,用无水硫酸钠干燥,旋蒸除溶,残余物经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得紫红色固体2 0.88 g,收率53.5%, m.p.63.5 ℃~65.2 ℃;1H NMR δ: 4.14(s, 2H), 4.18(s, 5H), 4.54(s, 2H), 4.78(s, 2H);13C NMR δ: 31.70, 70.05, 71.23, 73.21, 195.57; IRν: 3 103, 2 941, 1 676, 1 067, 824, 482 cm-1; Anal.calcd for C12H11BrFe: C 46.95, H 3.61; found C 46.24, H 3.85。
(2) 2-吡啶硫酰胺(3)的合成
在反应瓶中依次加入甲苯50 mL,吡啶1 mL, 2-吡啶甲酰胺3.0 g(8.18 mmol)及P4S100.72 g(1.62 mmol),搅拌均匀后缓慢升温,回流反应6 h。减压除溶,残余物用10 mol·L-1NaOH(50 mL)溶解,有机相用乙酸乙酯(3×30 mL)萃取,合并有机层,用无水硫酸钠干燥,经硅胶柱层析(洗脱剂:A=4∶1)纯化得淡黄色粉末3 1.50 g,收率44.2%; IRν: 1 147(C=S) cm-1。
(3) 2-FPT的合成
在圆底烧瓶中依次加入1,4-二氧六环50 mL, 2 1.0 g(3.25 mmol)及3 0.90 g(6.50 mmol),搅拌下回流反应12 h。减压蒸除1,4-二氧六环,残余物用乙酸乙酯溶解。有机相用饱和Na2CO3溶液洗至弱碱性后用无水硫酸钠干燥,旋转除溶,残余物经硅胶柱层析(洗脱剂:A=7∶1)纯化得紫红色固体2-FPT 0.58 g,收率51.7%;1H NMRδ: 4.08(s, 5H), 4.34(s, 2H), 4.82(s, 2H), 7.25(s, 1H), 7.88(d,J=3.8 Hz, 2H), 8.74~8.83(m, 2H);13C NMR δ: 67.3, 69.1, 69.6, 79.5, 111.8, 120.4, 140.5, 150.6, 157.2, 164.1; IRν: 3 097, 2 922, 1 595, 1 463, 1 024, 821, 451 cm-1; MSm/z: 347(M+); Anal.calcd for C18H14N2SFe: C 62.44, H 4.08, N 8.09; found C 62.42, H 4.22, N 7.92。
(4) 1的合成
在反应瓶中依次加入二异苯丙基氯化钌109 mg(0.18 mmol), 2-FPT 124 mg(0.36 mmol)及干燥DMF 20 mL,搅拌使其溶解;氩气保护下避光加热至60 ℃反应4 h。迅速加入dcbpy 88 mg(0.36 mmol),升温至140 ℃反应4 h得紫黑色溶液。减压蒸出DMF,残余物倾入200 mL冰水中,析出紫黑色沉淀,抽滤,滤饼依次用冰水和乙醚洗涤,干燥后用四丁基氢氧化铵甲醇溶液溶解,凝胶色谱(洗脱剂:甲醇)分离,收集主要成分,浓缩后用盐酸/甲醇(1/1)溶液酸化,析出沉淀,过滤,干燥得紫黑色固体1 116 mg,收率68.9%; MSm/z: 467.00{[M2+]}, 709.29{[M+TBA]+}, 1 176.29{[M+2TBA]2+}; Anal.calcd for C42H30N6O8SFeRu·3DMF·9H2O: C 46.46, H 5.28, N 9.57; found C 46.56, H 5.14, N 9.45。

m/z 1 176.29{[M+2TBA]2+} m/z 709.29{[M+TBA]+} m/z 467.00{[M2+]}
2 结果与讨论
2.1 1的表征
(1) MS分析
Chart 1为1的飞行MS数据及其可能的相应结构。1在溶解过程中与Bu4NOH发生酸碱中和反应,形成了质荷比为1 176.29的二价离子结构;该离子碎片继续解离出一个TBA+离子后形成了质荷比为709.29的碎片结构,而1在失去两个电子后形成了质荷比为467.00的带有两个正电荷的分子离子。此外,在MS谱图中还存在质荷比为520.68和565.65的信号峰,其结构经推断为碎片离子C分别离解出H2O分子以及羰基自由基形成的自由基正离子。
(2) 同位素分析
为了进一步确认1的结构,对其分子离子峰和质荷比为1 176.29的结构碎片进行了同位素计算,并与MS数据进行比较。结果表明,分子离子峰(m/z467.00)和碎片(m/z1 176.29)的同位素分析结果均与计算值符合程度较好(图1)。
2.2 2-FPT和1的UV-Vis分析
用Bu4NOH的甲醇溶液将1和2-FPT分别溶解后再用甲醇稀释至1×10-4mol·L-1,分别测定其UV-Vis谱图(图2)。由图2可见,发生配位作用后的UV-Vis光谱发生明显变化。首先,2-FPT在316 nm处由于π-π*跃迁产生吸收峰在配位后略微发生蓝移,但其摩尔吸光系数却大大增加。其次,2-FPT在412 nm处由于n-π*跃迁产生的吸收带消失,与此同时在462 nm处产生了新的吸收带。这两处吸收带的变化说明2-FPT已经与中心金属钌发生了络合,吡啶基噻唑中N原子的孤对电子进入中心Ru的空轨道,从而大大削弱了其自身的n-π*跃迁作用。新产生的462 nm处吸收带则为1的MLCT吸收带。此外,从1的UV-Vis谱图可以看出尽管其MLCT带的吸收虽然并不很强,但配体2-FPT的引入使其对整个太阳光光谱都具有一定的响应,说明2-FPT是一种可用来制备高性能光敏化染料的优良配体。

碎片(m/z 1 176.29)

λ/nm
3 结论
成功设计并合成了一种含有茂铁基团的光敏染料配体2-FPT及其金属配合物1。该方法具有应合成路线简捷、条件温和,反应试剂价廉易得等优点。开创了在温和条件下引入茂铁官能团的先河。1的紫外可见光光谱显示其在整个太阳光光谱范围内具有良好的光谱响应,为今后高性能太阳能光敏化染料的设计与制备提供了一定的参考。该染料的光电性能目前正在研究当中。
[1] Togni A, Hayashi T. Ferrocenes:Homogeneous catalysis,organic synthesis,materials science[M].VCH-Wiley:Weinheim,New York,1995.
[2] Gómez Arrayás R. Recent applications of chiral ferrocene ligands in asymmetric catalysis[J].Angew.Chem,Int Ed,2006,45(46):7674-7715.
[3] Miyake Y, Nishibayshi Y, Uemura S. Optically active chiral ligands,ferrocenyloxazolinylphosphines optically active chiral ligands,ferrocenyloxazolinylphosphines reactions[J].Synlett,2008,12:1747-1758.
[5] Brintzinger H H, Fischer D, Mulhaupt R, Bieger B,etal. Stereospecific olefin polymerization with chiral metallocene catalysts[J].Angew Chem,Int Ed,1995,34(11):1143-1170.
[6] Beer P D, Hayes E J. Transition metal and organometallic anion complexation agents[J].Coord Chem Rev,2003,240(1-2):167-189.
[7] Sporer C, Ruiz-Molina D, Wurst K,etal. Ferrocene substituted nitronyl nitroxide and imino nitroxide radicals.Synthesis,X-ray structure and magnetic properties[J].J Organomet Chem,2001,637-639(3):507-513.
[8] Cowan D O, Vanda C L, Park J,etal. Organic solid state.Ⅷ.Mixed-valence ferrocene chemistry[J].Acc Chem Res,1973,6(1):1-7.
[9] Koiwa T, Masuda Y, Shono J,etal. Synthesis,characterization,and detailed electrochemistry of binuclear ruthenium(Ⅲ) complexes bridged by bisacetylacetonate.Crystal and molecular structures of {[Ru(acac)2]2(tae)}(acac=2,4-pentanedionate Ion,tae=1,1,2,2-tetraacetylethanate dianion)[J].Inorg Chem,2004,43(20):6215-6223.
[10] 吴晓宏,杨占成,秦伟,等. 钯碳催化法合成4,4′-二甲基-2,2′-联吡啶[J].有机化学,2006,26(2):260-262.
[11] Miyoshi D, Karimata H. Artificial G-wire switch with 2,2′-bipyridine units responsive to divalent metal ions[J].J Am Chem Soc,2007,129(18):5919-5925.
[12] Rutenberg M W, Horning E C. 1-Methyl-3-ethyloxindole,[J].Org Syn Coll,4:620.
