新型川芎嗪阿魏酸衍生物的合成及其抗血小板聚集活性*
2011-11-26盛日正李家明张飞龙钟国琛
盛日正, 李家明, 张飞龙, 钟国琛
(安徽中医学院 药学院 安徽省现代中药重点实验室,安徽 合肥 230031)
阿魏酸系当归、川芎等传统活血化瘀中草药的主要有效成分之一,具有抗血小板聚集、抑制5-羟色胺从血小板中释放、阻止静脉旁路血栓形成、抗动脉粥样硬化等作用。一些阿魏酸衍生物也具有抗肿瘤、抑制血小板聚集、降脂等活性,同时这类化合物的合成筛选是新药研究的热点之一[1~3]。
在阿魏酸衍生物作为抗血小板聚集的系统研究中,本课题组[4,5]曾经报道了以奥扎格雷和Dazoxiben为模型,川芎嗪(2)和阿魏酸为先导物,按生物电子等排原理和药物拼合原理,用川芎嗪基替代咪唑基,将川芎嗪与阿魏酸通过醚键进行拼合而合成的化合物(E)-3-{4-[(3,5,6-三甲基吡嗪-2-基)甲氧基]-3-甲氧基苯基}丙烯酸(Ⅰ, Chart 1); Ⅰ 的体外抗血小板聚集实验结果显示,对ADP诱导的血小板聚集具有较好的抑制活性,是奥扎格雷的5.7倍,是川芎嗪阿魏酸盐的192倍。
为进一步探讨该类化合物的构效关系,结合奥扎格雷和Dazoxiben的一端为碱性基团,另一端为酸性基团的结构特征,本文以阿魏酸及其类似物为原料,设计并合成了6个新型的川芎嗪阿魏酸衍生物(1a~1f, Scheme 1)。 2与阿魏酸及其类似物(6a~6f)形成酰胺衍生物(8a~8f); 8与氯乙酸乙酯反应制得醚化的芳酸酯类化合物(9a~9f); 9在碱性条件下水解合成了1a~1f,其结构经1H NMR,13C NMR, IR及MS表征。并对1的抗血小板聚集活性进行了研究。
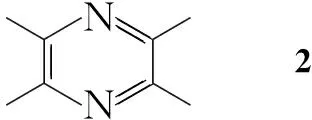
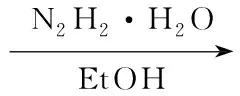
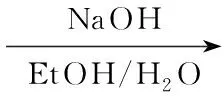
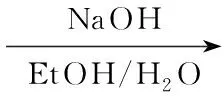

Scheme1
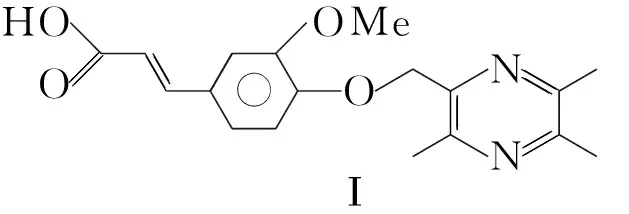
Chart1
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪,SGW X-4型显微熔点仪(温度未校正);Bruker 300 MHz型超导核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标);Nicolet Avatar 370DTGS型红外光谱仪(KBr压片);LCQ ADVANTAGE MAX型液质连用质谱仪;LG-PABER-1型血小板聚集仪。
N-(3,5,6-三甲基吡嗪-2-亚甲基)异吲哚-1,3-二酮(4,收率78.6%)[7],2-甲氨基-3,5,6-三甲基吡嗪(5,收率78.6%)[8],(E)-4-甲氧基-2-乙酰氧基苯甲酸[9]按文献方法合成;对羟基肉桂酸(甲)乙酯,自制;奥扎格雷钠(莱奥,40 mg/支,大连美罗大药厂);其余所用试剂均为化学纯或分析纯。
1.2 合成
(1) 2-溴甲基-3,5,6-三甲基吡嗪(3)的合成
在三颈瓶中依次加入2 20.0 g(150 mmol), NBS 26.8 g(150 mmol),催化剂过氧化苯甲酰[Ph(CO2)2O2]58 mg(0.23 mmol)及CCl475.0 mL,白炽灯照射,搅拌下回流反应10 h[TLC跟踪,展开剂:A=V(石油醚)∶V(乙酸乙酯)=2∶1]。冷却至室温,过滤,滤液减压回收CCl4得紫红色黏稠液体,减压蒸馏,收集(99~101) ℃/267 Pa馏分[6]得无色液体3(冷却后固化),收率60.1%, m.p. 41.2 ℃~44.0 ℃。
(2) (E)-4-甲氧基-2-乙酰氧基苯甲酰氯(6a)的合成
在单颈烧瓶中依次加入(E)-4-甲氧基-2-乙酰氧基苯甲酸3.5 g(17 mmol), SOCl215 mL和2滴DMF,搅拌下回流(85 ℃)反应3 h。减压回收溶剂得淡黄色固体,用CHCl320 mL溶解后直接投入下步反应。
(3) (E)-N-(3,5,6-三甲基吡嗪-2-亚甲基)-4-甲氧基-2-乙酰氧基苯甲酰胺(7a)的合成[10]
在干燥的三颈烧瓶依次加入6a2.5 g(11 mmol),三乙胺2 mL,搅拌下滴加5 1.6 g(11 mmol),冰浴冷却,搅拌反应1 h(TLC跟踪,展开剂:A=1∶1)。抽滤,滤液减压回收溶剂得黄褐色黏稠液体,过柱分离得淡黄色固体7a1.2 g,收率31.7%, m.p.140.4 ℃~140.8 ℃;1H NMRδ: 7.79(dd,J=8.4 Hz, 1.6 Hz, 1H, ArH), 7.77(s, 1H, NH), 7.62(d,J=1.6 Hz, 1H, ArH), 7.05(d,J=8.4 Hz, 1H, ArH), 4.66(d, 2H, CH2), 3.89(s, 3H, OCH3), 2.54(s, 3H, CH3), 2.52(s, 6H, CH3);13C NMRδ: 168.7, 165.9, 153.8, 149.7, 147.9, 147.8, 144.9, 139.6, 127.2, 126.0, 122.1, 111.8, 56.1, 41.5, 21.5, 21.4, 20.6, 20.0; IRν: 3 380, 2 926, 2 534, 1 768, 1 648, 1 614, 1 493, 1 440, 1 411, 1 376, 1 270, 1 197, 1 127, 1 023, 739, 647 cm-1; ESI-MSm/z: Calcd for C18H21N3O4(M++H)343.15, found 344.15。
用类似的方法合成7b~7f,其表征数据简略。
(4) (E)-N-(3,5,6-三甲基吡嗪-2-亚甲基)-4-甲氧基-2-羟基苯甲酰胺(8a)的合成[11]
在单颈烧瓶中依次加入7a3 g(8 mmol), NaOH 0.5 g(12.5 mmol),无水乙醇30 mL及水20 mL,搅拌下于室温反应18 h(TLC跟踪,展开剂:A=1∶1)。减压回收甲醇后用稀盐酸调至pH 5~6。抽滤,滤饼烘干得淡黄色固体8a,收率57.0%, m.p.244.2 ℃(dec)。
用类似的方法合成8b~8f。
(5) (E)-2-{6-甲氧基-3-[N-(3,5,6-三甲基吡嗪-2-亚甲基)甲酰胺]苯氧基}乙酸乙酯(9a)的合成[12]
在三颈烧瓶中依次加入8a1.5 g(5 mmol),氯乙酸乙酯3 mL(28 mmol), K2CO35 g(36 mmol), NaI 0.2 g(1.3 mol)及DMF 50 mL,搅拌下于90 ℃反应3.5 h(TLC跟踪,展开剂:氯仿)。冷却至室温,抽滤,滤饼用DMF(2×10 mL)洗涤,合并滤液与洗液,用乙酸乙酯萃取,合并有机相,回收溶剂得白色固体9a,收率63.0%, m.p.111.2 ℃~111.8 ℃;1H NMRδ: 7.81(s, 1H, NH), 7.53(d,J=8.8 Hz, 1H, ArH), 7.48(d, 1H, ArH), 6.98(d,J=8.8 Hz, 1H, ArH), 4.78(s, 2H, CH2), 4.67(d, 2H, CH2), 4.32(q, 2H, CH2), 3.96(s, 3H, OCH3), 2.56(s, 3H, CH3), 2.54(s, 6H, CH3), 1.33(t, 3H, CH3);13C NMRδ: 168.6, 166.5, 152.4, 149.7, 147.9, 147.8, 147.2, 144.9, 127.1, 121.2, 113.4, 111.2, 66.3, 61.4, 56.1, 41.4, 21.5, 21.4, 20.1, 14.2; IRν: 3 412, 3 272, 1 730, 1 606, 1 548, 1 446, 1 412, 1 354, 1 298, 1 277, 1 220, 1 136, 1 067, 1 029, 1000 cm-1; ESI-MSm/z: Calcd for C20H25N3O5(M++H)387.18, found 388.11。
用类似的方法合成9b~9f。
(6) (E)-2-{6-甲氧基-3-[N-(3,5,6-三甲基吡嗪-2-亚甲基)甲酰胺]苯氧基}乙酸(1a)的合成[11]
在单颈烧瓶中依次加入9a3.2 g(8.3 mmol),无水乙醇20 mL,水10 mL及NaOH 0.5 g(12.5 mmol),搅拌下于室温反应18 h(TLC跟踪,展开剂:乙酸乙酯)。减压回收乙醇后用稀盐酸调至pH 5~6,析出白色固体。冷却静置待晶体完全析出后抽滤,滤饼干燥得白色粉末。用少量活性炭脱色,干燥得1a。
用类似的方法合成1b~1f。
1a: 白色固体,收率81%, m.p.141.2 ℃~141.8 ℃;1H NMRδ: 12.94(brs, 1H, CO2H), 8.70(s, 1H, NH), 7.54(dd,J=8.7 Hz, 1.8 Hz, 1H, ArH), 7.38(d,J=1.8 Hz, 1H, ArH), 7.04(d,J=8.7 Hz, 1H, ArH), 4.68(s, 2H, CH2), 4.51(d, 2H, CH2), 3.81(s, 3H, OCH3), 2.45(s, 3H, CH3), 2.40(s, 6H, CH3);13C NMRδ: 170.0, 165.4, 151.3, 149.2, 147.9, 147.8, 147.5, 146.7, 126.2, 121.2, 111.9, 111.4, 64.9, 55.7, 42.2, 40.1, 21.0, 20.3; IRν: 3 390, 2 922, 2 549, 2 365, 1 758, 1 642, 1 580, 1 503, 1 417, 1 347, 1 270, 1 216, 1 139, 1 073, 1 017, 755, 627 cm-1; ESI-MSm/z: Calcd for C18H21N3O5(M++H)359.15, found 360.06。
(E)-2-{4-[N-(3,5,6-三甲基吡嗪-2-亚甲基)丙烯酰胺]苯氧基}乙酸(1b): 白色晶体,收率76.9%, m.p.197.7 ℃~199.2 ℃;1H NMRδ: 13.11(s, 1H, CO2H), 8.40(s, 1H, NH), 7.50(d,J=15.6 Hz, 1H, ArCH), 7.40(d,J=8.4 Hz, 1H, ArH), 6.94(d,J=15.6 Hz, 1H, =CH), 6.60(d,J=8.4 Hz, 1H, ArH), 4.72(s, 2H, CH2), 4.46(t, 2H, CH2), 2.46(s, 3H, CH3), 2.44(s, 3H, CH3), 2.43(s, 3H, CH3);13C NMRδ: 170.4, 165.6, 159.3, 149.7, 148.4, 148.3, 148.0, 147.6, 129.5, 126.2, 120.2, 115.2, 64.98, 42.2, 21.5, 20.6, 19.0; IRν: 3 368, 2 921, 2 513, 1 743, 1 656, 1 602, 1 515, 1 419, 1 448, 1 221, 987, 942, 831.2 cm-1; ESI-MSm/z: Calcd for C19H21N3O4(M++H)351.15, found 356.00。
(E)-2-{2-甲氧基-4-[N-(3,5,6-三甲基吡嗪-2-亚甲基)甲酰胺]苯氧基}乙酸(1c): 白色晶体,收率75.6%, m.p. 194.5 ℃~194.9 ℃;1H NMRδ: 8.86(s, 1H, NH), 7.51(d,J=1.6 Hz, 1H, ArH), 7.48 (dd,J=8.4 Hz, Hz, 1H, ArH), 6.91(d,J=1.6 Hz, 1H, ArH), 4.74(s, 2H, CH2), 4.56(d, 2H, CH2), 3.82(s, 3H, OCH3), 2.55(s, 3H, CH3), 2.48(s, 3H, CH3), 2.45(s, 3H, CH3);13C NMRδ: 170.3, 166.1, 150.1, 149.3, 148.9, 148.8, 148.7, 147.5, 127.4, 120.8, 112.6, 111.6, 65.3, 56.1, 42.4, 21.3, 20.7, 19.9; IRν: 3 376, 2 940, 2 435, 1 726, 1 634, 1 581, 1 555, 1 506, 1 443, 1 251, 1 220, 1 181, 1 033, 758, 681 cm-1; ESI-MSm/z: Calcd for C18H21N3O5(M++H)359.15, found 360.20。
2-{4-[N-(3,5,6-三甲基吡嗪-2-亚甲基)甲酰胺基]苯氧基}乙酸(1d): 淡黄色晶体,收率70.8%, m.p.152.9 ℃~153.5 ℃;1H NMRδ: 13.12(brs, 1H, CO2H), 8.42(s, 1H, NH), 7.38(d,J=16 Hz, 1H, ArCH=), 7.19(s, 1H, ArH), 7.08(d,J=8.4 Hz, 1H, ArH), 6.87(d,J=16 Hz, 1H, =CH), 6.65(d,J=8.4 Hz, 2H, ArH), 4.70(s, 2H, CH2), 4.49(s, 2H, CH2), 3.82(s, 3H, OCH3), 2.46(s, 9H, CH3);13C NMRδ: 170.4, 165.7, 149.6, 149.4, 148.9, 148.8, 148.6, 147.2, 139.4, 128.8, 121.5, 120.3, 113.4, 111.1, 65.4, 56.0, 41.9, 21.3, 20.5, 19.7; IRν: 3 333, 2 927, 2 584, 1 742, 1 658, 1 591, 1 513, 1 426, 1 222, 987, 943, 823, 728 cm-1; ESI-MSm/z: Calcd for C19H21N3O4(M++H)385.16, found 386.03。
(E)-2-{2,5-二甲氧基-4-[N-(3,5,6-三甲基吡嗪-2-亚甲基)甲酰胺]苯氧基}乙酸(1e): 白色晶体,收率65.6%, m.p.211.4 ℃~213.5 ℃;1H NMRδ: 12.74(brs, 1H, CO2H), 8.87(s, 1H, NH), 7.24(s, 2H, ArH), 4.54(d, 2H, CH2), 4.50(s, 2H, CH2), 3.81(s, 6H, OCH3), 2.48(s, 3H, CH3), 2.42(s, 6H, CH3);13C NMRδ: 170.5, 165.8, 152.3, 149.7, 148.4, 147.9, 138.6, 129.6, 121.6, 105.6, 69.0, 56.6, 42.8, 21.5, 20.8; IRν: 3 403, 2 934, 2 362, 1 744, 1 651, 1 586, 1 532, 1 491, 1 457, 1 417, 1 208, 1 124, 1 070, 676, 469 cm-1; ESI-MSm/z: Calcd for C19H23N3O6(M++H)389.40, found 390.10。
2-{4-[N-(3,5,6-三甲基吡嗪-2-亚甲基)甲酰胺基]苯氧基}乙酸(1f): 白色晶体,收率74.5%, m.p.214.9 ℃~216.8 ℃;1H NMRδ: 13.04(m, 1H, CO2H), 8.72(d, 1H, NH), 7.85(d,J=8.4 Hz, 2H, ArH), 6.97(d,J=8.4 Hz, 2H, ArH), 4.75(s, 2H, OCH2), 4.53(s, 2H, CH2), 3.36(s, 3H, CH3), 2.42(s, 6H, CH3);13C NMRδ: 170.3, 166.0, 160.5, 149.5, 148.3, 148.2, 147.9, 129.5, 127.4, 114.5, 64.9, 42.6, 21.5, 20.7; IRν: 3 396, 2 920, 1 739, 1 609, 1 562, 1 540, 1 499, 1 441, 1 413, 1 351, 1 210, 942, 847 cm-1; ESI-MSm/z: Calcd for C17H19N3O4(M++H)329.14, found 330.08。
1.3 1的抗血小板聚集实验[13]
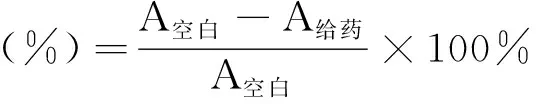
将雄性大耳白家兔随机分组,每组6只,分别给予1,奥扎格雷钠和生理盐水(给药量均为2 mL·kg-1)。耳缘静脉给药后麻醉,颈动脉插管放血,3.8%的枸橼酸钠1∶9抗凝,以800 r·min-1离心10 min。取富血小板血浆(PRP),剩余部分以3000 r·min-1离心10 min,取贫血小板血浆(PPP),聚集诱导剂用ADP(终浓度30 μmol·L-1),用量30 μL。每管270 μL PRP温育5 min,然后加入ADP诱导聚集并检测血小板最大聚集率(A)。
2 结果与讨论
2.1 合成
合成5时,油浴温度应该保持在85 ℃~95 ℃;低于此温度反应进行缓慢,高于此温度,出现杂质斑点,40 min以后反应快速进行,且反应溶液变成白色乳状液。在合成(E)-4-甲氧基-2-乙酰氧基苯甲酸时,应先使乙酸酐和浓硫酸反应5 min左右,形成酰正活性中间体。该此法产品收率高,纯度好。在合成9a时,采用加入催化量的NaI与氯乙酸乙酯先反应30 min,使I-充分与氯乙酸乙酯中的Cl-置换。此法可提高反应速率,避免副产物的产生,得到较理想的反应效果。
2.2 1的抗血小板聚集活性
1的抗血小板聚集活性结果见表1。由表1可见,1a~1f对ADP诱导的抗血小板聚集均具有抑制活性,其中1f的抑制活性与奥扎格雷钠接近,但活性普遍弱于奥扎格雷钠。这可能与分子中碱性基团和羧基之间的距离有关,6个新化合物从N原子到羧基羰碳原子间隔13~15个原子,分子长度少于奥扎格雷从咪唑末端N原子到羧基羰碳原子间隔原子数,该分子长度正好适合插入到TXA2合成酶的结合区域[11]。
3 结论
以阿魏酸及其类似物为原料,设计并合成了6个新型的川芎嗪阿魏酸衍生物(1a~1f)。初步药理活性测试结果显示,1f对血小板抑制率较高(22.0%)。

表1 1的血小板抑制率*
*测试方法见1.3
[1] 欧仕益,包惠燕,蓝志东. 阿魏酸及其衍生物的药理作用研究进展[J].中药材,2001,24(3):220-221.
[2] Yingyongnarongkul B, Apiratikul N, Aroonrerk N,etal. Solid-phase synthesis and antibacterial activity of hydroxycinnamic acid amides and analogues against methicillin-resistant Staphylococcus aureus and vancomycin-resistant S. aureus[J].Bioorg Med Chem Lett,2006,16(22):5870-5873.
[3] Xing X, Ho P, Bourquin G,etal. Synthesis,stereochemistry confirmation and biological activity evaluation of a constituent from Isodon excisus[J].Tetrahedron,2003,59(50):9961-9969.
[4] 李家明,赵永海,马逢时,等. 川芎嗪芳酸醚类衍生物的合成及抗血小板聚集活性[J].有机化学,2008,28(9):1578-1583.
[5] 李家明,何广卫,赵永海,等. 川芎嗪芳酸醚类衍生物制备方法和药物组合物与应用[P].中国专利, CN 1 616 404,2008.
[6] 杨楚耀,黄新明. 2-溴甲基-3,5,6-三甲基吡嗪及其衍生物的制备[J].复旦学报(自然科学版),1980,19(4):390-394.
[7] 李海波,赖朋,李娴洁,等. 顺式全氢异吲哚的合成[J].华西药学杂志,2008,23(1):20-22.
[8] 闻韧. 药物合成反应[M].第二版,北京:化学工业出版社,2002.
[9] 但飞君,覃超,董俊兴. 乙酰阿魏酰氯的合成[J].中国医药工业杂志,2005,36(6):329-330.
[10] Rolfe A, Probst DA, Volp KA,etal. High-load,oligomeric dichlorotriazine:A versatile ROMP-derived reagent and scavenger[J].J Org Chem,2008,73(22):8785-8790.
[11] Iizuka K, Akahane K, Momose D,etal. Highly selective inhibitors of thromboxane synthetase.1.Imidazole derivatives[J].J Med Chem,1981,24(10):1139-1148.
[12] Lee K, Lee J H, Boovanahalli K S,etal. (Aryloxyacetylamino)benzoic acid analogues:A new class of hypoxia-inducible factor-1 inhibitors[J].J Med Chem,2007,50(7):1675-1684.
[13] 袁丽萍,范丽,董六一,等. 山茶花总黄酮对血小板聚集和实验性血栓形成的影响[J].安徽医科大学学报,2004,39(2):142-144.
