鳜鱼与鲢鱼肌球蛋白轻链2启动子的克隆及其序列比较分析
2011-11-24赵发兰周瑞雪陈敦学农小献张建社褚武英
赵发兰,周瑞雪,成 嘉,陈敦学,农小献,蒙 涛,张建社,褚武英
(1.长沙大学生物工程与环境科学系,中国 长沙 410003;2.广西师范大学生命科学学院,中国 桂林 541004)
不同鱼类由于所处的地理环境和食性不同,使其在肌肉相关性状等方面存在较大的差异.近年来,为了探明不同鱼类的肉质差异及其形成的原因,国内外许多学者对其进行了研究和对比.随着研究的深入,人们已经逐渐认识到这些差异是相关基因差异表达的结果[1-5].对这些基因差异表达调控机制的研究还处于起步阶段.启动子是真核生物基因表达调控的顺式作用元件,含有基因表达调控网络的重要信息,很大程度上决定了基因表达的强度以及特异性[6-8].因此,分析和认识差异表达基因的启动子结构和转录调控网络,有助于从理论上揭示基因差异表达的关键调控点,理解基因表达调控机制及其调控网络,并将其应用于鱼类转基因和育种工程等领域,对于阐明重要肉质性状形成的分子机制等生命过程具有重要意义.
目前青、草、鲢、鳙、鲤和鲫鱼等常规鱼既是我国淡水养殖的主体产业,又是我国水产品市场供应的主导产品,其产量占淡水养殖总产量的 70% 以上.但是,与鳜鱼、黄鳝、黄颡等淡水优质鱼相比,这些常规品种在其肉品质上还不能完全满足消费者的需求.如何在保证常规淡水鱼产量同时不断提高其肉品质是目前最关注的问题之一,对我国的水产业持续稳定健康发展具有重要意义[9-11].因此克隆鳜鱼与鲢鱼肌肉组织差异表达重要功能基因MLC2的启动子,分析和比较两启动子的遗传学和表观遗传学转录调控网络,将有助于从理论上揭示基因表达的关键调控位点和品质性状形成的分子机理.
1 材料和方法
1.1 实验材料
鲜活鳜鱼和鲢鱼购于长沙毛家桥水产市场,解剖取肝脏新鲜组织用于基因组总DNA的提取.
1.2 基因组总DNA的提取
消化过夜后采用V(苯酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1的混合液抽提基因组总DNA.0.01 g/mL琼脂糖凝胶(全文浓度相同)电泳检测其质量,测定吸光度检测其纯度.
1.3 PCR扩增、序列测定及分析
根据已经发表文章中斑马鱼肌球蛋白启动子和金头鲷启动子序列,运用Primer Premier 5.0软件设计引物,由上海生工公司合成.其序列如下:
鳜鱼启动子 上游引物:5′-TGGAGTTCGGTGGGTGGGTT-3′
下游引物:5′-TGTCTCCTGCTGCCTGCCTC-3′
鲢鱼启动子上游引物:5′-CGACGGACGGAGGAGAACGTG-3′
下游引物:5′-CTGCCTGCCTCCTCTTGGCCTTCTT-3′
用普通高效Taq酶扩增,反应体系为:10×buffer,2.5 μL;dNTP(10 mmol/L),1 μL;Sense-Primer(10 μmol/L),1 μL;Anti-sense Primer(10 μmol/L),1 μL;模板(DNA),1 μL;Ex.Taq,0.2 μL;用双蒸水补齐 25 μL,反应参数为:94 ℃变性 5 min;94 ℃变性 30 sec,56 ℃ 退火 30 sec,72 ℃延伸 1 min,30 个循环,72 ℃,延伸 10 min,4 ℃保温.所扩增的DNA片段经琼脂糖凝胶电泳检测,分析其纯度.然后根据Promega纯化试剂盒割胶回收后,依据pGEM-T Easy 载体试剂盒(Tiangen)说明书连接过夜,再将连接产物转化到E.coliDH5α感受态细胞中,取10 μL转化产物涂板,37 ℃倒置过夜培养,挑取白色单菌斑培养,菌液经过 PCR 扩增,电泳分析,确定插入片段是否正确.将筛选出的阳性克隆提取质粒,进行序列测定.
1.4 5′上游调控区的分析
将鳜鱼与鲢鱼MLC2基因 5′端上游调控区序列序列经Matlnspector在线软件并利用Primer Premier 5.0软件进行结构分析.
2 结果与分析
2.1 DNA纯度检验与定量
取5.0 μL DNA用于琼脂糖凝胶电泳检查其质量,如图1所示.测定所得样品DNA吸光度,计算A260/A280值,取比值为1.8~2.0之间的DNA样品进行PCR扩增反应.
2.2 5′ 端上游调控区的PCR结果
取5.0 μL DNA用于琼脂糖凝胶电泳检查PCR扩增产物片段的质量和验证是否所需目的条带.以鳜鱼和鲢鱼DNA为模板扩增条带区分别显示约为900 bp,与预期PCR片段长度相似,其PCR结果的电泳图谱如图2所示.

1.鳜鱼DNA,2.鲢鱼DNA 1.M100 bp ladder,2.鳜鱼,3.鲢鱼图1 鲢鱼与鳜鱼DNA电泳结果 图2 鳜鱼鲢鱼启动子扩增结果
2.3 5′端上游调控区的测序
测序得到鳜鱼MLC2启动子序列长890 bp,鲢鱼MLC2启动子序列长869 bp.通过序列分析两种鱼类的特异性结合位点,发现鳜鱼分别在-38 bp、-378 bp、-517 bp处含有3个MEF2结构结合位点,相似性为90%,还有5个E-box结合位点,鲢鱼只在-53 bp含有一个MEF2结构结合位点,E-box结合位点同样含有5个,如图3a,b所示.

图3a鳜鱼MLC 2启动子核苷酸序列

图3b鲢鱼MLC2启动子核苷酸序列
注:序列下画“ ”表示-CANNTG-;灰色部分表示起始密码子;黑体表示TATA-box,“ ”表示(C/T)TA[T/A]4TA(G/A)
2.4 序列分析
利用Primer Premier 5.0软件对测出的5′ 端上游调控区序列进行Motif预测和经Matlnspector在线软件分析,得出鳜鱼鲢鱼MLC2启动子部分均含有1个TATA-box、CAAT-box,鳜鱼含有2个Glycol结构,而鲢鱼含此结构为4个(如表1).
获得的鳜鱼和鲢鱼MLC2基因启动子序列与已经报道的金头鲷、斑马鱼 MLC2启动子结构位点的比较如图4所示.鳜鱼、鲢鱼均含有5个E-box,金头鲷与斑马鱼分别含有6个和4个.斑马鱼与鳜鱼启动子序列含有3个MEF2结合位点,金头鲷启动子包含4个MEF2结合位点,而鲢鱼启动子仅含有1个MEF结合位点,4种鱼结构位点的位置均有所不同.
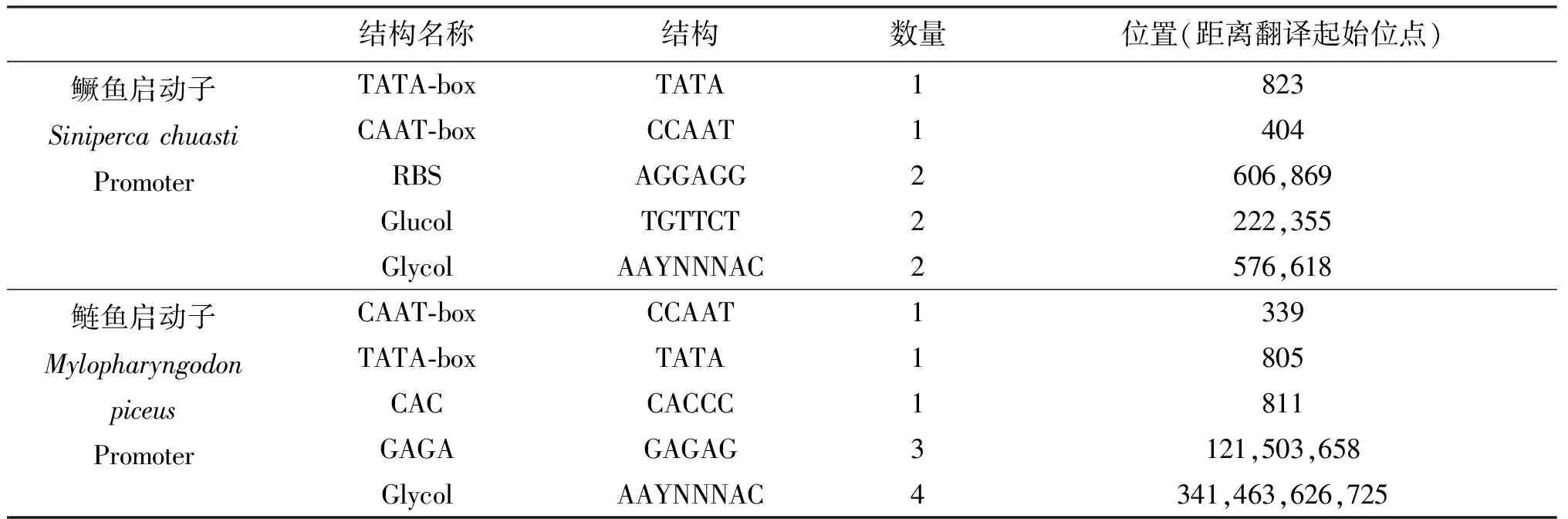
表1 Primer Premier 5.0对5′ 端上游调控区序列的预测结果
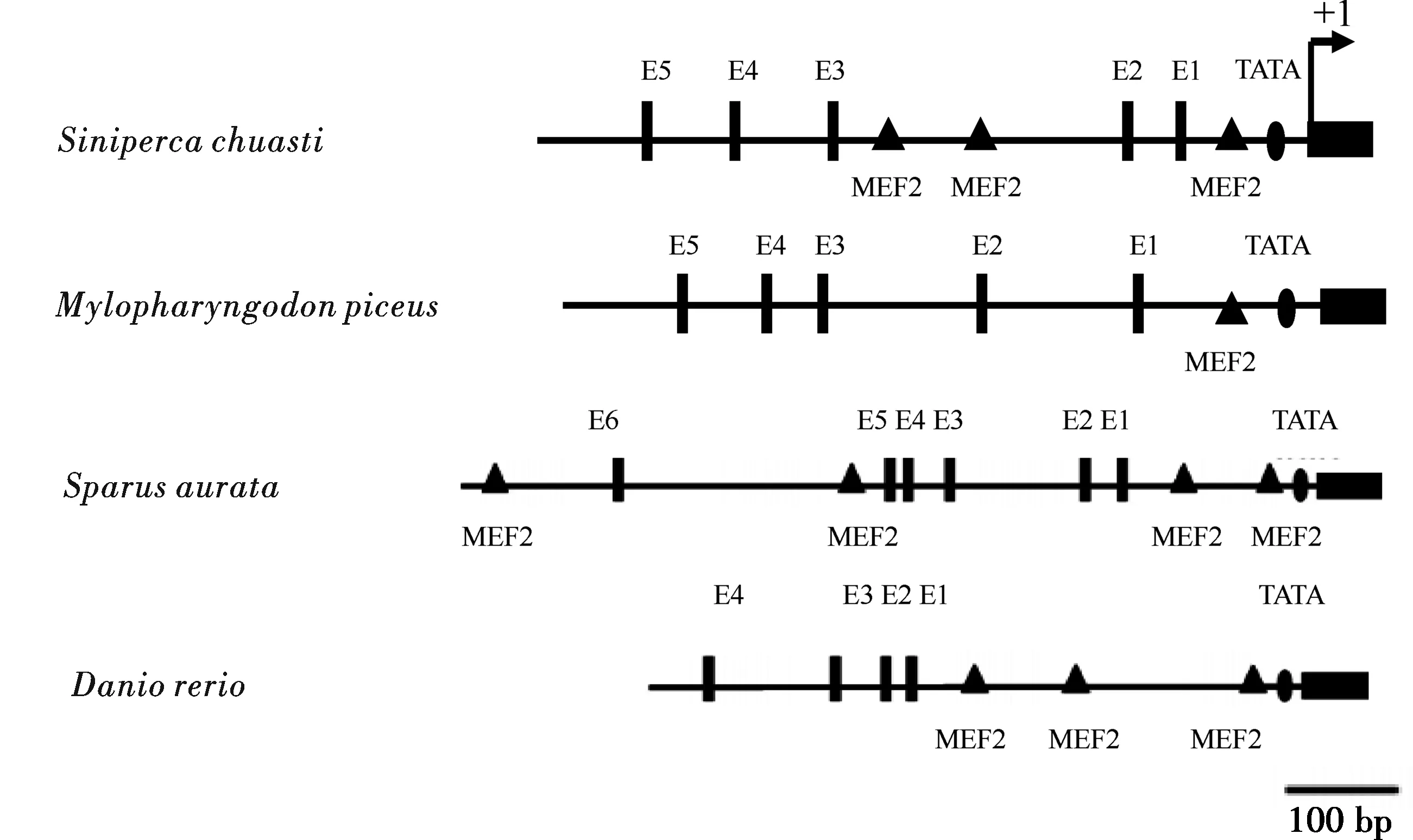
图4 鳜鱼、鲢鱼、金头鲷及斑马鱼MLC2基因启动子中E-box、 TATA和MEF2的示意图
3 讨论
对人类和鱼类等多个物种的MLC2基因及启动子研究的结果显示,MLC2基因5′侧翼区以及 5′非翻译区是保持高水平转录活性所必需的序列[12-13].脊椎动物中许多骨骼肌肉特异性基因的转录均需要MEF2和与bHLH (basic helix-loop-helix protein,bH LH protein)MyoD等因子基因相互结合作用从而导致肌细胞的转录激活与生成,其中bHLH常与E-box(CANNTG)这样的六核苷酸相结合.MLC2启动子包含典型的转录因子结合位点E-box(CANNTG)和 TATA-box序列以及进化保守的MEF2结合位点,即(C/T)TA[T /A]4TA(G/A)序列[14-15].比较金头鲷和斑马鱼MLC2f的启动子基因发现E-box和MEF2结合位点在基因序列上存在的位置不同.金头鲷和斑马鱼MLC2f启动子起始位点的近端MEF2结合位点与TATA-box之间的距离分别为15 bp和17 bp,作者所得到的鳜鱼和鲢鱼MEF2结合位点和TATA-box距离起始位点分别为28 bp和21 bp.有研究显示肌肉顺式作用元件具体转录位于近启动子区域内几百碱基,金头鲷MLC2f在5′端的650 bp存在这些转录因子结合点,作者所得鳜鱼和鲢鱼MLC2启动子序列在800 bp以内存在相应的转录因子的结合位点.
不同长度的MLC2启动调控序列具有不同的启动活性.Amold H.H.等研究分析斑马鱼MLC2f启动子,发现在近起始位点包含MEF2结合位点 79 bp能够激活氯霉素乙酰转移酶(CAT)报告基因的表达,其功能相当于长度3 kb 启动子[16-17],说明MEF2结合位点在斑马鱼肌肉细胞中起着十分重要的作用.Funkenstein B等人通过体外注射质粒DNA的方法研究金头鲷的启动子发现,大约244 bp 包含1个TATA box 和2个MEF2 结合位点亦能有效地引起荧光素报告基因的表达[18-19].分析作者得到的鳜鱼MLC2启动子序列在起始密码子上游309 bp包含TATA box和2个MEF2 结合位点,而在鲢鱼序列相应的部分只包含TATA box一个MEF2 结合位点,因此作者推测鳜鱼约309 bp MLC2启动子要比鲢鱼相同长度的MLC2启动子更为高效,需进一步实验证明.此外,软件分析鳜鱼鲢鱼在650~900 kb的启动序列表明在序列中还包含有更多的结合位点,关于这些结合位点的转录调控功能与机制尚待进一步的研究.
参考文献:
[1] DEVOTO S H,MDLANCON E,EISEN J S,etal.Identification of separate slow and fast muscle precursor cells in vivo prior to somite formation[J].Development,1996,122:3371-3380.
[2] CHAUVIGNE F,CAUTY C,RALLIERE C,etal.Muscle fiber differentiation in fish embryos as shown by in situ hybridization of a large repertoire of muscle-specific transcripts[J].Dev Dyn,2005,233: 659-666.
[3] WEEDS A G,LOWEY S.Substructure of the myosinmolecule(Ⅱ.The light chains of myosin)[J].J Molec Biol,1971,61:701-725.
[4] NABESHIMA Y,FUJII-KURIYAMA Y,MURAMATSU M,etal.Molecular cloning and nucleotide sequences of the complementary DNAs to chicken skeletal muscle myosin two alkali light chain mRNAs[J].Nucleic Acids Res,1982,10: 6099-6110.
[5] YAMANO K,TAKANO-OHMURO H,OBINATA T,etal.Effect of thyroid hormone on developmental transition of myosin light chains during flounder metamorphosis[J].Gen Comp Endocrinol,1994(93):321-326.
[6] 蒙 涛,褚武英,张建社,等.鳜肌肉组织cDNA文库构建及其ESTs分析[J].淡水渔业,2009(39):27-33.
[7] FUNKENSTEIN B,SKOPAL T,RAPOPORT B,etal.Characterization and function alanalysis of the 5′ flanking region of myosin light chain-2 gene expressed in white muscle of the gilthead sea bream(Sparusaurata)[J].Comp Biochem Physiol,2007(2):187-199.
[8] ZHANG J S,FU G H,CHU W Y,etal.cDNA Cloning and expression analysis of the myosin heavy chain (MYH) gene of the mandarin fish Siniperca kneri[J].Aquac Res,2009,40(4): 412-418.
[9] CHU W Y,FU G H,MENG T,ZHANG J S,etal.Gene expression profiling in muscle tissues of the commercially important teleost,SinipercachuatsiL[J].Aquac Int,2010,18: 667-678.
[10] AMOLD H H,WINTER B.Muscle differentiation:more complexity to the network of myogenci regulator[J].Curr Opin Genet Dev,1998,8:539-545.
[11] 李池陶,关海红,胡雪松,等.大头鲤、黑龙江鲤、德国镜鲤及其杂种F3肌肉品质的比较[J].水产学报,2008,32(1):45-50.
[12] 张建社,周瑞雪,褚武英,等.大眼鳜和斑鳜肌肉营养成分分析[J].安徽农业科学,2008,36(34):15022-15026.
[13] TANG Jian-zhou,ZHANG Dong-yi,CHENG Jia,etal.Comparative analysis of the proteomic profile of the muscle proteins from two teleosts,the Chinese madarine fish and silver carp[J].J Fisheries China,2007(3): 361-368.
[14] ZHOU R X,CHU W Y,ZHANG J S,etal.Selection of reference genes in transcription analysis of gene expression from the mandarin fishSinipercachuasti[J].Zoo Reas,2010,31(2):141-146.
[15] HUANG C J,TU C T,TSAI H J.Germ-line transmission of a myocardium-specific GFP transgene reveals critical regulatory elements in the cardiac myosin light chain 2 promoter of Zebrafish[J].Dev Dyn,2003,228:30-40.
[16] XU Y,HE J,TIAN H L,etal.Fast skeletal muscle-specific expression of a zebrafish myosin light chain 2 gene and characterization of its promoter by directin jection into skeletal muscle[J].DNA Cell Biol,1999,18:85-95.
[17] 周瑞雪,褚武英,张建社,等.鳜鱼肌球蛋白轻链2基因cDNA的克隆及其发育性表达[J].湖南师范大学自然科学学报,2009,32(3):78-83.
[18] 张建社,夏新界,褚武英,等.基于异源cDNA基因芯片杂交的鳜鱼肌肉组织基因表达谱初步分析[J].水生生物学报,2009,33(1):46-53.
[19] MOUTOU K A,CANARIO A V,MAMURIS Z,etal.Molecular cloning and sequence ofSparusaurataskeletal myosin light chains expressed in white muscle: developmental expression and thyroid regulation[J].J Exp Biol,2001,204(17): 3009-3018.
