土著微生物原位修复铬渣堆场污染土壤的条件优化
2011-11-24黄顺红
黄顺红
(1. 湖南有色金属研究院,长沙 410015;2. 中南大学 冶金科学与工程学院,长沙 410083)
土著微生物原位修复铬渣堆场污染土壤的条件优化
黄顺红1,2
(1. 湖南有色金属研究院,长沙 410015;2. 中南大学 冶金科学与工程学院,长沙 410083)
通过对培养基的优化,提出并研究直接添加培养基激活土著微生物的活性来进行铬渣堆场污染土壤的原位微生物修复新方法,并探讨土壤环境对土著微生物修复Cr(Ⅵ)效果的影响。研究表明:在每千克土壤中碳源葡萄糖投加量为5 g、氮源化合物A投加量为5 g、温度为30 ℃、土与液质量比为1:1的情况下,土著微生物可被迅速激活,在第4天时能基本去除土壤的中水溶性Cr(Ⅵ);培养基初始pH值和不添加无机盐氯化钠不影响其修复效果。
铬渣堆场;铬污染;土著微生物;原位修复
土壤中铬污染的修复面临着严峻的挑战。去除土壤中毒性 Cr(Ⅵ)的传统方法有化学固定法、化学还原法、土壤淋洗法和电动修复法等。然而,这些传统方法大多数需要高能耗或者需要大量的化学试剂,因而,这些方法成本高且易造成二次污染[1−3]。近年来,微生物修复法由于具有环境友好性及其成本较低等独特的优点而受到许多学者的关注。微生物修复土壤铬污染主要是利用土壤中的土著微生物或加入经驯化的高效微生物,通过微生物还原反应,将有毒的、可移动的Cr(Ⅵ)还原为低毒的、不易移动的 Cr(Ⅲ),达到治理土壤铬污染的目的[4−6]。而应用土著微生物进行有毒废物解毒与污染土壤修复在环境安全性、环境适应性与种群协调性以及应用成本方面具有其他异地菌种不可比拟的优越性[7]。
环境中存在着大量土著微生物,某些微生物对污染物具有一定净化作用,但其自然净化的速度一般较慢,其原因是由于其生存环境中营养物质的缺乏[8−10],而另一个限制因子是有效微生物常常生长较为缓慢。为了快速去除污染物,常常采取许多强化措施,例如提供电子受体,添加 N和 P等营养物质来刺激微生物的生长[11−14]。
本文作者利用铬渣堆场土壤中生活的有还原Cr(Ⅵ)功能的土著微生物,通过直接添加营养物质,激发铬还原菌的活性,进行铬渣堆场铬污染土壤修复。为了提高其修复效果,对不同碳源、pH、温度和土壤湿度等条件下Cr(Ⅵ)的还原特性进行了研究,并优化Cr(Ⅵ)的生物还原条件。
1 实验
1.1 实验原料
1.1.1 培养基
称取葡萄糖5.0 g,氮源化合物A 5.0 g,溶于1 000 mL蒸馏水中,用NaOH和HCl调节pH至9.8左右,于121 ℃灭菌30 min,冷却后备用。
1.1.2 土著微生物
土著微生物为本课题组从中国五矿( 湖南)铁合金集团铬渣堆场土壤中自行分离的Cr(Ⅵ)还原菌, 鉴定为 Pannonibacter phragmitetus,命名为 BB[15−17]。
1.1.3 土壤样品
土壤样品采自于某铬渣堆场表层土壤(0~20 cm)。用塑料铲子采集10 kg土壤,于室温下自然风干,剔除草根、石块及其他杂质,充分混匀,用研钵磨细,过孔径0.25 mm的筛。根据我国土壤分类标准,实验用土壤属于第四纪红土发育的红壤。
土壤基本理化性质按常规分析方法测定,其结果如表1所列。
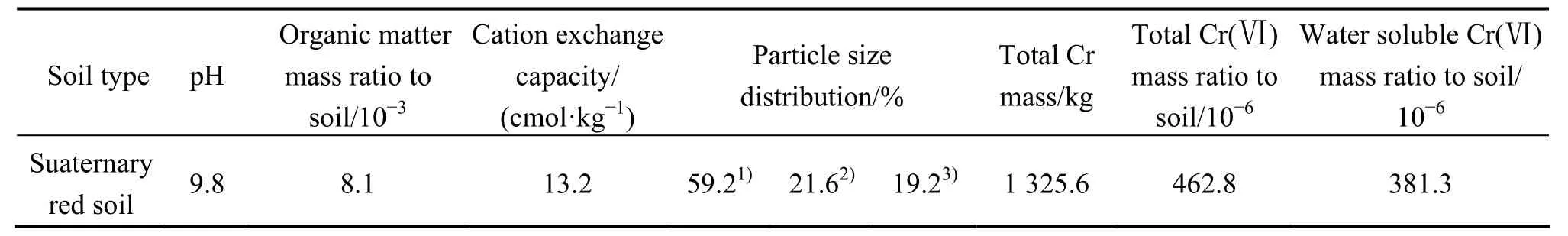
表1 铬渣堆场土壤的基本理化性质Table 1 Some physical and chemical properties of soil under chromium-containing slag heap
1.2 碳源对土著微生物修复铬污染土壤的影响
1.2.1 不同碳源的影响
分别称取葡萄糖和乳酸钠各5 g,溶于1 000 mL蒸馏水中,每瓶中加入氮源化合物A 5 g,氯化钠2 g,用NaOH和HCl调节pH至9.8,于121 ℃灭菌30 min,冷却,制成液体培养基。以不加碳源作为对照。
称取10 g铬渣堆场土壤于灭菌的锥形瓶中,加入10 mL上述液体培养基(土壤中碳源投加浓度为5×10−3),用透气封口膜封口,称取质量,置于30 ℃恒温培养箱中培养一段时间,每隔2 d用灭菌水补充蒸发损失的水分,于0、1、2、3、4和5 d取样分析土壤中水溶性Cr(Ⅵ)含量的变化情况。
1.2.2 碳源量的影响
筛选出较好碳源,按上述操作配制液体培养基,使碳源浓度分别为3、5、8、11和13 g/L。每千克土壤中碳源投加浓度分别为3、5、8、11和13 g(即浓度分别为 0、3×10−3、5×10−3、8×10−3、11×10−3和13×10−3),其余操作同上。
1.3 氮源化合物 A对土著微生物修复铬污染土壤的影响
在筛选出最优碳源和最佳碳源量的基础上,配制液体培养基,改变氮源化合物A的含量,使其浓度分别为0、3、5、7、9和11 g/L。考察不同数量的氮源化合物A对土著微生物P. phragmitetus BB修复铬渣堆场污染土壤的效果,每千克土壤中氮源投加量分别为 0、3、5、7、9 和 11 g(即浓度分别为 0、3×10−3、5×10−3、7×10−3、9×10−3和 11×10−3),其余操作同上。
1.4 无机盐的影响
以最佳碳源及氮源化合物A配制液体培养基,一份培养基不加无机盐,另一份培养基加入2 g/L氯化钠。分别加入两种不同处理的液体培养基10 mL于10 g污染土壤中,使每千克土壤中氯化钠含量分别为 0和2 g,考察不同盐含量对土著微生物P. phragmitetus BB修复铬渣堆场污染土壤的影响,其余操作同上。
1.5 培养基pH的影响
改变培养基pH值,使液体培养基分别为6、7、8、9、10和 11,考察培养基 pH值对土著微生物 P.phragmitetus BB修复铬渣堆场污染土壤的影响,其余操作同上。
1.6 温度的影响
改变土壤体系温度,考察 4个温度 10、20、30和40 ℃对土著微生物P. phragmitetus BB修复铬渣堆场污染土壤的影响,其后操作同上。
1.7 土壤湿度的影响
选择田间持水量为 60%和淹水状态下(土与液质量比 1:1)两种土壤,考察土壤湿度对土著微生物P. phragmitetus BB修复铬渣堆场污染土壤的影响,其余操作同上。
1.8 土壤中不同形态Cr的提取及测定
土壤中总Cr。称取土壤样品0.3 g置于聚四氟乙烯坩埚中,加入10 mL浓硝酸,5 mL 体积比为1:l的硫酸和5 mL氢氟酸,在沙浴上消化,控制温度不超过240 ℃。消解液中的铬含量用ICP-AES测定。
土壤中总Cr(Ⅵ)。称取2.5 g土样于250 mL三角瓶中,加入 50 mL 0.28 mol/L Na2CO3+0.50 mol/L NaOH,加入0.4 g MgCl2,加入0.5 mol/L 0.5 mL磷酸盐缓冲液(0.5 mol/L K2HPO4/KH2PO4),搅拌5 min。样品在90~95 ℃下持续加热60 min,并不断搅拌。慢慢冷却至室温,过滤,滤液采用二苯碳酰二肼分光光度法测定[18]。
土壤中水溶性Cr(Ⅵ)。将每次取的样品,加入 50 mL去离子水,于振荡器中振荡1 h,离心,上清液采用二苯碳酰二肼分光光度法测定[19]。
1.9 数据统计分析
所有的试验重复进行 3 次。数据采用 Microsoft Excel 2003和SPSS 14.0 统计软件处理,采用 LSD 法对数据进行差异显著性检验。
2 结果与分析
2.1 碳源的影响
碳源是影响微生物还原 Cr(Ⅵ)的一个极为重要的因素,它不仅可以为微生物提供必要的营养物质,还可为微生物还原Cr(Ⅵ)提供电子供体。
由图1可知,在第4天时,添加了葡萄糖和乳酸钠处理后,土壤中水溶性 Cr(Ⅵ)浓度从初始的381.3×10−6分别降至 5.5×10−6和 43.3×10−6,Cr(Ⅵ)的去除率分别达到了99%和89%。比不添加碳源处理的去除率分别高出64%和54%。这表明,在有氮源提供的前提下,土著微生物能充分利用土壤组分中现有的一些有机物作为自己的碳源,进行土壤 Cr(Ⅵ)的还原,当土壤中有限的能利用的有机物消耗殆尽时,还原反应也就停止。添加了碳源的两组处理,其还原效果明显提高,这说明两种碳源葡萄糖和乳酸钠都能促进菌体对 Cr(Ⅵ)的还原。其中,添加葡萄糖的处理效果有于乳酸钠的。
本研究还考察葡萄糖添加量对污染土壤中Cr(Ⅵ)还原效果的影响,其结果如图2所示。随着葡萄糖添加量的增加,还原反应的速率明显加快。但在第4天,土壤中葡萄糖的含量为 5×10−3、7×10−3、9×10−3和11×10−3时,土壤中水溶性 Cr(Ⅵ)去除率均达到 98%以上。因此,从经济上考虑,用土著微生物修复Cr(Ⅵ)污染土壤时,葡萄糖的浓度以5×10−3为宜。

图1 碳源对土壤Cr(Ⅵ)还原效果的影响Fig.1 Effect of carbon source on Cr(Ⅵ) reduction
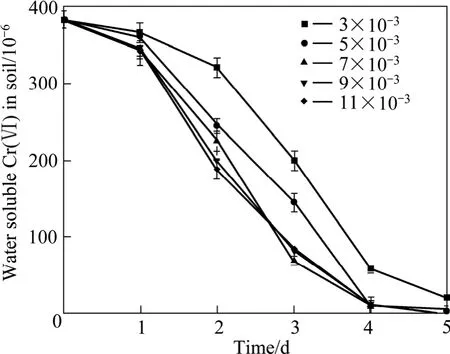
图2 葡萄糖浓度对Cr(Ⅵ)还原效果的影响Fig.2 Effect of glucose concentration on Cr(Ⅵ) reduction
2.2 氮源添加量的影响
土壤中氮源可能比较缺乏,所以,必须另外添加氮源或者辅助营养源,有助于土著微生物修复铬污染土壤。添加不同浓度氮源化合物A对土著微生物去除土壤中水溶性Cr(Ⅵ)的影响如图3所示。加入了一定数量的氮源化合物A后,土壤中水溶性Cr(Ⅵ)的浓度均随着培养时间的增加而减少,每千克土壤中氮源化合物A的添加量为5、7、9和11 g(即氮源化合物的浓度依次为 5×10−3、7×10−3、9×10−3和 11×10−3)时,土壤水溶性Cr(Ⅵ)在第4天基本上去除。未加氮源化合物A的处理,土壤水溶性Cr(Ⅵ)浓度也有一定程度降低,但降幅不大,5 d后,土壤中水溶性Cr(Ⅵ)仅去除20%。这说明,即使给土壤提供土著微生物足够的碳源,土壤中本身的氮源也不足以满足其执行完全修复 Cr(Ⅵ)污染的功能,就湖南某厂铬渣堆场污染土壤来说,外加5 g氮源(氮源化合物A)就能使土著微生物基本去除铬渣堆场污染土壤中水溶性Cr(Ⅵ)。

图3 不同浓度的氮源化合物A对Cr(Ⅵ)还原效果的影响Fig.3 Effect of nitrogenous compound A concentration on Cr(Ⅵ) reduction
2.3 无机盐的影响
一定浓度的无机盐是微生物体内生理活动正常进行所必需的条件,但是过高浓度的盐会增加溶液的渗透压,使细菌发生质壁分离现象,造成细胞脱水,因而会抑制微生物的生长。
本实验以氯化钠为无机盐,不同盐度条件下供试土壤水溶性Cr(Ⅵ)去除率的变化如图4所示。土壤水溶性Cr(Ⅵ)的去除率均随培养时间的增加而增加,在第4天时,Cr(Ⅵ)的去除率均达到98%以上,两处理对Cr(Ⅵ)去除没有明显差异,这说明,投加的无机盐对土壤水溶性Cr(Ⅵ)的去除率没有影响。这是由于供试样土壤取自铬渣堆场,是一种高盐度土壤,土壤自身环境中盐度能满足土著微生物生理功能的需要,同时,当投加2 g氯化钠时,土著微生物对土壤Cr(Ⅵ)还原也没有受到影响,这也说明土著微生物具有一定的抗盐性能。其抗盐机理,可能是由于其细胞膜上有反向的H+/Na+载体,可以将体内过高的Na+排出,同时将外界的H+吸收以达到降低细胞质pH的目的;或者可通过Na+/K+离子泵的主动运输,排出多余的Na+而吸收K+,同样可以降低细胞质中的盐浓度。

图4 不同盐度条件下土壤Cr(Ⅵ)的去除率Fig.4 Cr(Ⅵ) removal rate in soil at different salinities
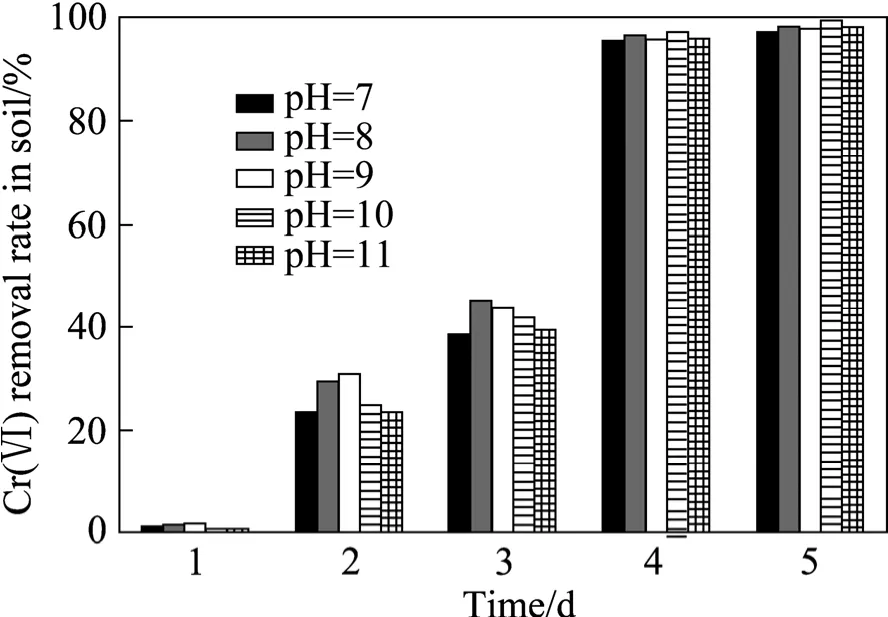
图5 初始培养基不同pH值条件下土壤Cr(Ⅵ)的去除率Fig.5 Cr(Ⅵ) removal rate of liquid initial medium at different pH values
2.4 培养基pH的影响
pH是反映微生物在一定环境条件下代谢活动的重要指标,pH对微生物还原Cr(Ⅵ)有重要影响。在用微生物还原法原位修复土壤时,调整土壤 pH比较困难的,因此,在比较不同酸碱度对微生物还原土壤Cr(Ⅵ)的影响时,只考察初始培养基的pH变化对土著微生物修复铬渣堆场铬污染土壤的影响(见图5)。 经过一段时间的培养,各初始液体培养基 pH处理,土著微生物对土壤Cr(Ⅵ)的还原效果没有明显的区别。第4天时,每个处理中土壤Cr(Ⅵ)的去除率都在98%左右,这与许多铬还原菌处理废水完全不同,这是由土壤自身的性质所决定的。
我国土壤的酸碱反应大多数在pH 4.5~8.5之间,在地理分布上具有“南酸北碱”的地带性分布特点,长江以南土壤多为强酸性,湖南土壤以红壤居多,红壤pH在5.5~6.5之间。而本研究供试土壤来自湖南某厂铬渣堆场,是高碱土壤,这是由于高碱性铬渣长期淋溶作用,其含有的钠离子逐渐聚积在其下的土层,使得本应呈酸性的红壤而演变为碱化土壤。
同时,土壤是一个包含固、液、气三相组成的多组分开放的生物地球化学系统,多组分土壤含有不同的缓冲体系,如碳酸盐体系、硅酸盐体系、交换性阳离子体系、铝体系和有机酸体系,这些不同体系共同作用,使得土壤具有较强抵御酸、碱物质,减缓 pH变化的能力,即具有对酸碱的缓冲性。因此,当有外加H+和OH−进入土壤体系时,土壤pH变化极为缓慢,土壤酸度变化可稳定保持在一定范围内,这为土壤微生物的活动创造了一个良好、稳定的土壤环境条件。当不同pH初始培养基加入到土壤中时,由于土壤巨大的缓冲性能,土壤 pH没有产生剧烈的变化,基本维持在 9.8左右,且在土壤Cr(Ⅵ)还原过程中,土壤pH也没有明显的变化(见图6)。

图6 不同pH值初始培养基土壤中水溶性Cr(Ⅵ)还原过程中pH值的变化Fig.6 Change of pH value during Cr(Ⅵ) reduction by indigenous microorganism in soil added initial medium with different pH values
因此,在实际应用中,可以不必调节培养基的pH来进行微生物原位修复铬污染土壤,因而大大节省人力和物力。
2.5 温度的影响
土壤中的生物修复受一年中季节、气温的影响,微生物菌落保持迅速生长和良好活性需要一个相对适宜的温度范围,在较冷的天气条件下生物修复不易进行。
不同温度条件下供试土壤水溶性Cr(Ⅵ)去除率的变化如图7所示。由图7可知,Cr(Ⅵ)的还原效率随着温度的升高而提高,当温度为30 ℃时,Cr(Ⅵ)的还原率最高,培养第4天时,土壤水溶性Cr(Ⅵ)去除率达到了97%;40 ℃条件下,土壤水溶性Cr(Ⅵ)还原率略次于30 ℃,第4天时,Cr(Ⅵ)的去除也达到了89%;10 ℃时,土壤Cr(Ⅵ)去除率最低,即使经过5 d的培养,Cr(Ⅵ)的去除率仅34.6%。且随着温度的升高,微生物活性逐渐增强,去除率也逐渐升高。在实际土壤生物修复工程中,可以采用塑料薄膜覆盖土壤堆,使土壤堆的温度升高,且可以保湿,这样进行原位处理的时间可以延长,延长了处理时间,为寒带地区的生物修复措施提供了可行的依据。

图7 不同温度条件下土壤Cr(Ⅵ)的去除率Fig.7 Cr(Ⅵ) removal rate in soil at different temperatures
2.6 土壤湿度的影响
湿度也是限制微生物迅速转化的因素,因为表层土壤常常被风干,不利于微生物生长,所以必须添加一定量的水分以保持适宜的湿度。
从图8可以看出,在30 ℃、每千克土壤中氮源化合物A和葡萄糖投加量均为5 g的条件下,淹水状态下(土与液质量比为1:1),土壤水溶性Cr(Ⅵ)含量逐渐减少,第4天时,水溶性Cr(Ⅵ)基本去除,而在土壤湿度为60%田间持水量的处理中,土壤水溶性Cr(Ⅵ)在整个培养期间一直都没有明显变化,土著微生物的生长与繁殖需要一定的水分,60%田间持水量的土壤湿度不利用其生长和繁殖,而且土壤水分太少,也不利于微生物的自由游动,这可能是导致60%田间持水量下供试土壤中水溶性 Cr(Ⅵ)在培养期间几乎没有被还原的重要原因之一。

图8 土壤湿度对微生物还原土壤Cr(Ⅵ)的影响Fig.8 Effects of humidity on reduction of water soluble Cr(Ⅵ)in soil by microorganism
3 结论
1) 在温度为30 ℃、每千克土壤中碳源葡萄糖投加量为5 g、氮源化合物A投加量5 g、水量充足(土与液的质量比1:1)的条件下,土著微生物在第4天时,基本可去除铬渣堆场土壤中水溶性Cr(Ⅵ)。
2) 培养基的不同初始pH不影响土著微生物还原功能的发挥,且在整个还原过程中,土壤 pH变化较小;外加无机盐2 g没有促进土著微生物还原Cr(Ⅵ),在原位修复铬渣污染土壤时,无需投加无机盐;土壤60%的田间持水量时,土壤中水溶性 Cr(Ⅵ)在培养期间没有被还原。
3) 湖南某厂铬渣堆场土壤中存在具有铬还原能力的土著微生物,直接向土壤中添加营养物质可刺激土著微生物活性,进行铬污染土壤的原位修复。
REFERENCES
[1] JEYASINGH J, PHILIP L. Bioremediation of chromium contaminated soil: Optimization of operating parameters under laboratory conditions[J]. Journal of Hazardous Materials, 2005,118(1/3): 113−120.
[2] CHEUNG K H, GU J D. Mechanism of hexavalent chromium detoxification by microorganisms and bioremediation application potential: A review[J]. International Biodeterioration& Biodegradation, 2007, 59(1): 8−15.
[3] MESSER J, REYNOLDS M, STODDARD L, ZHITKOVICH A.Causes of DNA single-strand breaks during reduction of chromate by glutathione in vitro and in cells[J]. Free Radical Biology and Medicine, 2006, 40(11): 1981−1992.
[4] AUGUSTYNOWICZ J, GROSICKI M, HANUS-FAJERSKA E,LEKKA M, WALOSZEK A, KOLOCZEK H. Chromium(VI)bioremediation by aquatic macrophyte callitriche cophocarpa sendtn[J]. Chemosphere, 2010, 79: 1077−1083.
[5] KRISHNA K R, PHILIP L. Bioremediation of Cr(Ⅵ) in contaminated soils[J]. Journal of Hazardous Materials, 2005,121(1/3): 109−117.
[6] KONOVALOVA V V, DMYTRENKO G M, NIGMATULLIN R R. Chromium(VI) reduction in a membrane bioreactor with immobilized pseudomonas cells[J]. Enzyme and Microbial Technology, 2003, 33(7): 899−907.
[7] 陈晓东, 常文越, 冯晓斌, 孙 俊, 邵春岩. 沈抚灌区土壤生态恢复途径初步研究[J]. 环境保护科学, 2002, 28(110): 33−35.CHEN Xiao-dong, CHANG Wen-yue, FENG Xiao-bin, SUN Jun, SHAO Chun-yan. Primary study on the approach of farmland ecological resume in Shen-Fu irrigation area[J].Environmental Protection Science, 2002, 28(110): 33−35.
[8] JEYASINGH J, SOMASUNDARAM V, PHILIP L, MURTY B S.Bioremediation of Cr (Ⅵ) contaminated soil/sludge: experimental studies and development of a management model[J]. Chemical Engineering Journal, 2010, 160: 556−564.
[9] TOKUNAGA T K, WAN J, HAZWNTC. Distribution of chromium contamination and microbial activity in soil aggregates[J]. Journal of Environmental Quality, 2003, 32(2):541−549.
[10] CIFUENTES F R, LINDEMANN W C, BARTON L. Chromium sorption and reduction in soil with implications to bioremediation[J]. Soil Science, 1996, 161(4): 233−234.
[11] SALUNKHE P B, DHAKEPHALKAR P K, PAKNIKAR K M.Bioremediation of hexavalent chromium in soil microcosms[J].Biotechnology Letters, 1998, 20(6): 749−751.
[12] REDDY K R, CUTRIGHT T J. Nutrient amendment for the bioremediation of a chromium-contaminated soil by electrokinetics[J]. Energy Sources: Recovery, Utilization, and Environmental Effects, 2003, 25(9): 931−943.
[13] LOSI M E, AMRHEIN C, FRANKENBERGER W T.Bioremediation of chromate-contaminated groundwater by reduction and precipitation in surface soils[J]. Journal of Environmental Quality, 1994, 23(6): 1141−1150.
[14] LOSI M E, AMRHEIN C, FRANKENBERGER W T. Factors affecting chemical and biological reduction of hexavalent chromium in soil[J]. Environmental Toxicology and Chemistry,1994, 13(11): 1727−1735.
[15] CHAI Li-yuan, HUANG Shun-hong, YANG Zhi-hui, PENG Bing, HUANG Yan, CHEN Yue-hui. Cr(Ⅵ) remediation by indigenous bacteria in soils contaminated by chromium-containing slag[J]. Journal of Hazardous Materials,2009, 167(1/3): 516−522.
[16] CHAI L Y, HUANG S H, YANG Z H, PENG B, HUANG Y,CHEN Y H. Hexavalent chromium reduction by pannonibacter phragmitetus BB isolated from soil under chromium-containing slag heap[J]. Journal of Environmental Science and Health, Part A, 2009, 44(6): 615−622.
[17] 柴立元, 许友泽, 王海鹰, 向仁军, 杨志辉, 苏长青, 王 兵.Pannonibacter phragmitetus对Cr(Ⅵ)污染土壤的修复效应[J].中国有色金属学报, 2009, 19(12): 2230−2236.CHAI Li-yuan, XU You-ze, WANG Hai-ying, XIANG Ren-jun,YANG Zhi-hui, SU Chang-qing, WANG Bing. Cr(Ⅵ)remediation by Pannonibacter phragmitetus in contaminated soil[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(12):2230−2236.
[18] 魏复盛. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 1989: 159.WEI Fu-sheng. Water and exhausted water monitoring analysis method[M]. Beijing: China Environment Science Press, 1989:159.
[19] 吴赛玉. 简明生物化学[M]. 合肥: 中国科学技术大学出版社,1999: 168−172.WU Sai-yu. Concise biochemistry[M]. Hefei: University of Science and Technology of China Press, 1999: 168−172.
Optimum condition of in-situ remediation of Cr(Ⅵ) polluted soil from chromium-containing slag heap by indigenous microorganism
HUANG Shun-hong1,2
(1. Hunan Research Institute of Nonferrous Metals, Changsha 410015, China;2. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Based on the optimization of culture medium composition, the growth conditions and ability of Cr(Ⅵ)reduction, the in-situ remediation of Cr-contaminated soil can be achieved by adding culture medium in soils to stimulate the activity of indigenous microorganism. The results show that the optimal conditions for the Cr(Ⅵ) reduction by indigenous microorganism are 5 g glucose and 5 g nitrogenous compounds A per kilogram soil at 30 ℃ and the mass ratio of soil to water is 1:1. Under the optimal condition, the water soluble Cr(Ⅵ) in the soil contaminated by chromium-containing slag heap is completely removed in the fourth day. The initial pH value of culture medium do not affect Cr(Ⅵ) reduction. The inorganic salt does not need to be added into the culture medium when the in-situ remediation of Cr(Ⅵ) is carried out by the indigenous microorganism.
chromium-containing slag heap; Cr-contamination; indigenous microorganism; in-situ remediation
S154.36
A
1004-0609(2011)07-1741-07
湖南科技计划重点资助项目(2008SK2007);长沙市科技计划资助项目(K0802144-31)
2010-09-28;
2010-12-12
黄顺红,工程师,博士;电话:0731-85239020;E-mail: hshunhong@163.com
(编辑 李艳红)
