真空下碳热还原氧化铝的热力学
2011-11-24冯月斌戴永年
冯月斌, 杨 斌 戴永年
(1. 昆明理工大学 冶金与能源工程学院 真空冶金国家工程实验室,昆明 650093;2. 昆明理工大学 理学院,昆明 650093)
真空下碳热还原氧化铝的热力学
冯月斌1,2, 杨 斌1, 戴永年1
(1. 昆明理工大学 冶金与能源工程学院 真空冶金国家工程实验室,昆明 650093;2. 昆明理工大学 理学院,昆明 650093)
对真空条件下碳热还原氧化铝进行热力学研究。结果表明:在1 643~1 843 K的温度范围内,真空碳热还原氧化铝生成气体产物,该气体在温度降低时发生二次反应形成冷凝物,反应过程中体系压力保持在5~150 Pa。热力学分析表明:当体系压力为1~100 Pa时,在1 200~1 900 K的温度范围内,碳热还原氧化铝生成Al2O、Al和CO;生成Al2O的初始反应温度低于生成Al的初始反应温度,但反应温度高于一定值时,更易生成Al气体,该温度取决于体系的压力;当CO的分压分别为1、10和100 Pa时,Al2O稳定存在的温度分别高于1 462、1 560和1 674 K,Al气体稳定存在的温度分别高于1 514、1 635和1 777 K。
氧化铝;碳;碳热还原;热力学
碳热还原氧化铝在铝冶金中的应用研究持续了100多年,目前,电解法炼铝工艺日臻完善,但碳热还原炼铝法仍然具有取代电解法的潜力[1]。碳热还原炼铝法分为氧化铝的直接碳热还原和碳热还原−卤化−歧化法[2−4]。另一方面,随着氧化铝及铝化合物在陶瓷材料中的应用越来越广泛,碳热还原氧化铝的反应也逐渐被材料工作者关注,如采用碳热还原氧化铝法制备AlN陶瓷材料[5]和Al4C3[6]。人们对碳热还原氧化铝体系中各化合物已进行了较为深入的研究,已经获得了相应的热力学数据[7−9],但反应机理仍然没有得到统一的认识。刘新宽等[10]和李亚伟等[11]评述了氮气气氛下碳热还原氧化铝反应机理的研究进展及固−固相反应机理和气相反应机理。袁海滨等[12−14]认同固−固相反应机理,认为氧化铝与碳发生固−固相反应首先生成Al4O4C,在更高的温度下生成Al4C3。YU等[15]则认为氧化铝与碳的固−固相反应有限,氧化铝碳热还原反应通过CO进行,生成Al、Al2O和AlO气体。
随着真空技术的发展,王平艳等[16]和李秋霞等[17]进行了真空碳热还原氧化铝的应用研究。本文作者从热力学角度研究真空下碳热还原氧化铝的反应,为其工业应用提供理论基础。
1 实验
将氧化铝(分析纯)和石墨(纯度为 99.8%)以摩尔比1:3进行配比,混匀后,在压力为2 MPa下压成直径为20 mm圆柱状料块,每块料的质量约为5 g。
将反应物料置于真空炉内的石墨坩埚中,升至一定温度后保持该温度30 min。反应过程中真空炉内的压力保持在5~150 Pa。检查反应后的物料,采用X射线衍射仪(D/max−3B)分析残留物和冷凝物的物相,采用扫描电镜(XL30ESEM−TMP)检测其微观结构。实验温度范围为1 643~1 843 K。
2 结果与讨论
2.1 反应后物料的外观
图1所示为在不同温度下反应30 min后的物料在坩埚中的照片。由图1可以看出,上层料块及坩埚壁上粘附着冷凝物。当反应温度较高时,如图1(d)和(e)所示,冷凝物将反应料块完全覆盖,很容易认为反应物部分熔融,本文作者在前期总是把冷凝物与残留物一起作为残留物进行分析。在不同温度下反复实验后才发现,反应后坩埚内的物料由冷凝物与残留物两部分组成。因为坩埚上段的温度低于中、下段的温度,所以,位于上层的料块反应程度低,且在上面形成冷凝物。
根据反应后的物料外观可以推测:石墨还原氧化铝生成气体产物,该气体产物发生二次反应形成冷凝物。
2.2 残留物和冷凝物分析
图2所示为氧化铝和石墨在1 743 K反应30 min得到的残留物和冷凝物的XRD谱。由图2可知,不同反应温度下的残留物都由α-Al2O3和 C组成,冷凝物都由Al4O4C、C、Al4C3和Al2O3组成。
图3所示为氧化铝和石墨在1 743 K反应30 min得到的残留物和冷凝物的SEM像。由图3可见,残留物和冷凝物的形貌完全不同。
物相分析和 SEM 像分析证实:石墨与氧化铝反应主要生成气体产物,该气体产物在温度降低时发生二次反应形成含Al4O4C、C、Al4C3和Al2O3的冷凝物。
2.3 真空下碳热还原氧化铝的热力学分析
据报道,Al2O3气化的主要气体成分为 Al、Al2O和AlO[18];碳在温度高于1 273 K的气化产物主要为CO。因此,碳热还原氧化铝的气体产物可能由 Al、Al2O、AlO和CO组成,可能的反应如下:

2.3.1 碳热还原氧化铝反应的吉布斯自由能与温度和压力的关系
利用HSC热力学软件中的数据,得到反应(1)~(3)的标准吉布斯自由能与温度的关系,如图4所示。由图4可见,在1 200~1 900 K的温度范围内,反应(1)~(3)的标准吉布斯自由能均为正值,因此,常压下反应不可能正向进行。
反应(1)~(3)为增容反应,减压有利于反应的进行。根据文献[19]的方法,推导出在1 200~1 900 K的温度范围内反应(1)~(3)的吉布斯自由能与温度和压力的关系式分别如下:
根据式(4)~(6)得到不同压力下吉布斯自由能与温度之间的关系如图 5所示。由图 5可以看出:反应(1)~(3)的吉布斯自由能在1 200~1 900 K的温度范围内随温度的升高和压力的降低而降低,说明升高温度和降低压力有利于反应的进行。从图5(a)和(b)可知,当系统压力为1、10和100 Pa时,反应(1)和(2)的初始反应温度均低于1 900 K;从图5(c)可知,当温度低于1 900 K时,反应(3)不可能发生。本实验研究的温度范围为1 643~1 843 K、压力范围为5~150 Pa,即在本实验条件下,可以不考虑AlO的形成。

图1 在不同温度下反应30 min后的物料在坩埚中的照片Fig.1 Photographs of samples in crucible after reacted at different temperatures for 30 min: (a) 1 643 K; (b) 1 693 K; (c) 1 743 K; (d) 1 793 K; (e) 1 843 K

图2 氧化铝和石墨在1 743 K反应30 min后残留料与冷凝物的XRD谱Fig.2 XRD patterns of residues (a) and condensates (b) produced by reaction of alumina with graphite at 1 743 K for 30 min

图3 氧化铝和石墨在1 743 K反应30 min后残留料与冷凝物的SEM像Fig.3 SEM images of residues (a) and condensates (b)produced by reaction of alumina with graphite at 1 743 K for 30 min
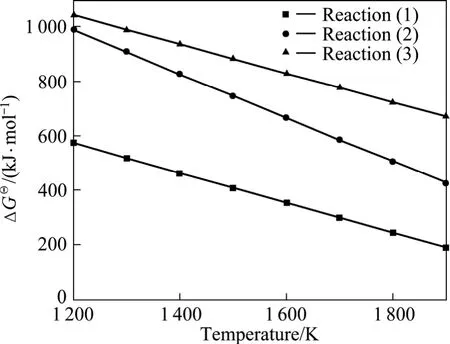
图4 反应(1)~(3)的标准吉布斯自由能与温度的关系Fig.4 Relationship between ΔGΘ and temperature for reactions (1)−(3)

图5 不同压力下反应(1)~(3)的吉布斯自由能与温度的关系Fig.5 Relationship between ΔG and temperature for reactions(1)−(3) at different pressures: (a) Reaction (1); (b) Reaction (2);(c) Reaction (3)
2.3.2 碳热还原氧化铝的初始反应温度
ΔG=0时的温度为反应的初始温度。根据式(4)和(5)可以分别得到反应(1)和(2)初始反应温度与系统压力的关系,如图6所示。由图6可知,在相同的体系压力下,反应(2)的初始反应温度高于反应(1)的,且体系压力越高,二者的初始反应温度相差越大。
2.3.3 碳热还原氧化铝反应的吉布斯自由能比较
图7所示为不同压力下碳热还原氧化铝反应(1)和(2)吉布斯自由能与温度的关系。由图7可知,反应(2)的初始反应温度高于反应(1)的,但反应(2)的吉布斯自由能随温度的升高而下降的趋势更大,使两个反应的吉布斯自由能与温度的关系曲线相交。交点温度时,两个反应的吉布斯自由能相等。高于交点温度时,反应(2)的吉布斯自由能小于反应(1)的,反应(2)应优先发生。1、10和100 Pa压力下的交点温度分别约为1 560、1 710和1 890 K,即高于此温度时,优先生成Al气体;低于此温度时,优先生成Al2O气体。

图6 反应(1)和(2)初始反应温度与系统压力的关系Fig.6 Relationship between initial temperatures of reactions(1) and (2) and pressure of system
当反应(1)和(2)的吉布斯自由能与温度的关系曲线相交时,其吉布斯自由能相等,即式(4)与式(5)相等。由此推导出体系压力与两条曲线交点温度的关系式如下:

根据式(7)绘制交点温度与体系压力的关系曲线,如图8所示。由图8可知,交点温度随系统压力的升高而升高,在曲线的左上方区域,反应(2)的吉布斯自由能高于反应(1)的,优先生成Al;曲线右下方区域的情况则相反,优先生成Al2O。
2.3.4 真空下碳热还原氧化铝反应的平衡图
当采用固体还原剂C还原金属氧化物、且温度高于1 273 K时,还原反应由如下两步完成[20]:1) CO还原氧化物,MeO+CO=Me+CO2;2) CO2与C反应生成CO,CO2+C=2CO。
当采用固体还原剂 C还原氧化铝、且温度为1 273~1 900 K时,体系内发生以下反应:

图7 不同压力下反应(1)和(2)吉布斯自由能与温度的关系Fig.7 Relationship between ΔG and temperature for reactions(1) and (2) at different pressures: (a) 1 Pa; (b) 10 Pa; (c) 100 Pa
反应(1)和(2)分别由反应(8)和(9)与反应(10)组成。根据ΔG=ΔGΘ+RT lnKp,反应平衡时,ΔG=0。利用 HSC中的热力学数据推导出平衡气相分压与温度的关系式。假设反应体系为封闭体系,固定一种气相成分的分压,即可导出CO2和CO分压比与温度的关系。
对于反应(8),令p(CO)=1 Pa,p(Al2O)=0.5 Pa,有

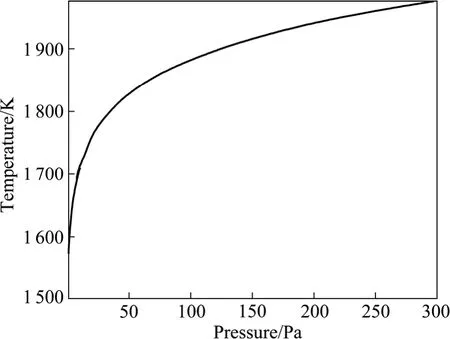
图8 反应(1)与(2)的吉布斯自由能相等时温度与体系压力的关系Fig.8 Relationship between temperature at which ΔG of reaction (1) equals that of reaction (2) and pressure of system


图9 氧化铝还原的平衡曲线Fig.9 Equilibrium curves for reductions of alumina: (a)p(CO)=1 Pa; (b) p(CO)=10 Pa; (c) p(CO)=100 Pa
根据式(11)~(19)可作出体系压力不同下反应的平衡曲线,如图9所示。由图9可知,当采用CO还原氧化铝时,反应(8)平衡曲线的右上方区域为Al2O3的稳定区,反应(9)平衡曲线的左下方为Al的稳定区域,反应(8)和(9)的平衡曲线之间的区域为Al2O的稳定区域。当有固体碳存在时,气化反应(10)与氧化铝的还原反应(8)和(9)分别相交于a和b点,高于a点温度时,Al2O稳定存在,高于b点温度时,Al稳定存在。当CO的分压分别为 1、10和 100 Pa时,a点温度分别为1 462、1 560和1 674 K,b点温度分别为1 514、1 635和1 777 K。
在实际反应条件下,体系内可能存在残留的外界气体,所以,实际的反应情况可能与理论计算之间存在一定差异。
3 结论
1) 真空下碳热还原氧化铝时,压力越低、温度越高,反应越容易进行。当温度为1 643~1 843 K、系统压力为5~150 Pa时,碳热还原氧化铝生成Al2O、Al和CO气体。该气体产物在温度降低时发生二次反应,形成含Al4O4C、C、Al4C3和Al2O3的冷凝物。
2) 在1 200~1 900 K的温度范围内,碳热还原氧化铝生成Al2O的初始温度低于生成Al气体的,但生成 Al气体反应的吉布斯自由能随温度升高而降低的趋势更大,使得两个反应吉布斯自由能与温度的关系曲线相交,高于交点温度时,优先生成Al气体,低于交点温度时,优先生成Al2O。交点温度随系统压力的升高而升高。
3) 当CO分压分别为1、10和100 Pa时,Al2O稳定存在的温度分别高于1 462,1560和1 674 K,Al气体稳定存在的温度分别高于1 514,1 635和1 777 K。
REFERENCES
[1] HALMANN M, FREI A, ATEINFELD A. Carbothermal reduction of alumina: Thermochemical equilibrium calculation and experimental investigation[J]. Energy, 2007, 32(12):2420−2427.
[2] BRUNO M J. Aluminum carbothermic techonology[R].DOE/ID/13900. Pennsylvania: 2004.
[3] STROUP P T. Carbothermic smelting of aluminum[J].Transaction of Metallurgical Society of Aime, 1964, 230(3):355−372.
[4] 冯月斌, 戴永年, 王平艳. 歧化法生产和精炼铝的研究概况[J]. 轻金属, 2009(3): 12−15.FENG Yue-bin, DAI Yong-nian, WANG Ping-yan. Research of the production and refining of aluminum by disproportionation[J]. Light Metals, 2009(3): 12−15.
[5] XI Sheng-qi, LIU Xin-kuan, LI Peng-liang, ZHOU Jing-gen.AlN ceramics synthesized by carbothermal reduction of mechanical activated Al2O3[J]. Journal of Alloys and Compounds, 2008, 457(1/2): 452−456.
[6] JOO H U, JUNG W S. Coversion of basic dicarboxylate Al(Ⅲ)complexes to aluminum carbide under a flow of argon[J].Journal of Alloys and Compounds, 2008, 465(1/2): 265−268.
[7] LIHRMANN J M. Thermodynamics of the Al2O3-Al4C3system.Ⅰ: Thermochemical functions of Al oxide, carbide and oxycarbides between 298 and 2 100 K[J]. Journal of the European Ceramic Society, 2008, 28(3): 633−642.
[8] LIHRMANN J M. Thermodynamics of the Al2O3-Al4C3system.Ⅱ: Free energies of mixing, solid solubilities and activities[J].Journal of the European Ceramic Society, 2008, 28(3): 643−647.
[9] LIHRMANN J M. Thermodynamics of the Al2O3-Al4C3system.Ⅲ: Equilibrium vapour pressures and activation energies for volatilization[J]. Journal of the European Ceramic Society, 2008,28(3): 649−656.
[10] 刘新宽, 马明亮, 周敬恩. 碳热还原法制备氮化铝反应机制的研究进展[J]. 硅酸盐通报, 1999(1): 35−39.LIU Xin-kuan, MA Ming-liang, ZHOU Jing-en. Review of mechanisms of carbothermal reduction nitridation reactions[J].Bulletin of the Chinese Ceramic Society, 1999(1): 35−39.
[11] 李亚伟, 李 楠, 袁润章. Al2O3-C-N2系统反应热力学初步探讨[J]. 硅酸盐通报, 2001(4): 3−8.LI Ya-wei, LI Nan, YUAN Run-zhang. Thermodynamical discussion of the reaction evolution in Al2O3-C-N2system[J].Bulletin of the Chinese Ceramic Society, 2001(4): 3−8.
[12] YUAN Hai-bin, YANG Bin, YU Qing-chun, XU Bao-qiang,ZHU Yu-yan, FENG Yue-bin, DAI Yong-nian. Reaction mechanism of AlCl generated by carbothermic chloride to produce aluminum in vacuum[C]//Proceedings of the 9th Vacuum Metallurgy and Surface Engineering Conference. 2009:39−45.
[13] 袁海滨, 冯月斌, 杨 斌, 郁青春, 徐宝强, 王鹏程, 戴永年.氧化铝在低价氯化铝法炼铝过程中的行为[J]. 中国有色金属学报, 2010, 20(4): 777−783.YUAN Hai-bin, FENG Yue-bin, YANG Bin, YU Qing-chun, XU Bao-qiang, WANG Peng-cheng, DAI Yong-nian. Thermal behavior of alumina in process of carbothermic reduction and chloride to produce aluminum[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(4): 777−783.
[14] 袁海滨, 冯月斌, 徐宝强, 杨 斌, 郁青春, 戴永年. 低价氯化铝法从氧化铝直接碳热还原炼铝的机理分析[J]. 真空科学与技术学报, 2010, 30(3): 259−264.YUAN Hai-bin, FENG Yue-bin, XU Bao-qiang, YANG Bin, YU Qing-chun, DAI Yong-nian. Direct extraction of aluminum from alumina by carbothermic reaction-chlorination and possible mechanisms[J]. Chinese Journal of Vacuum Science and Technology, 2010, 30(3): 259−264.
[15] YU J K, UENO S, LI H X, HIRAGUSHI K. Improvement of graphitization of isotropic carbon by Al2O3formed from aluminum chelate compound[J]. Journal of the European Ceramic Society, 1999, 19(16): 2843−2848.
[16] 王平艳, 刘谋胜, 戴永年. 真空碳热还原氯化法从铝土矿炼铝[J]. 真空科学与技术学报, 2006, 26(5): 377−380.WANG Ping-yan, LIU Mou-sheng, DAI Yong-nian. Vacuum metallurgy of Al from bauxite by carbothermic reaction-chlorination[J]. Chinese Journal of Vacuum Science and Technology, 2006, 26(5): 377−380.
[17] 李秋霞, 陈为亮, 戴永年. 真空低价氟化铝歧化分解制备铝[J]. 中国有色金属学报, 2008, 18(8): 1550−1554.LI Qiu-xia, CHEN Wei-liang, DAI Yong-nian. Preparation of aluminum by disproportionation of sub-fluoride in vacuum[J].The Chinese Journal of Nonferrous Metals, 2008, 18(8):1550−1554.
[18] KATSOV D A, SHTEPAN A M, GRINSHTEIN I L,PUPYSHEV A A. Atomization of aluminium oxide in electrothermal atomic absorption analysis[J]. Spectrochimica Acta B, 1992, 47(8): 1023−1041.
[19] 戴永年, 杨 斌. 有色金属材料的真空冶金[M]. 北京: 冶金工业出版社, 2000: 278−345.DAI Yong-nian, YANG Bin. Vacuum metallurgy for nonferrous metal material[M]. Beijing: Metallurgical Industry Press, 2000:278−345.
[20] 傅崇说. 有色冶金原理[M]. 北京: 冶金工业出版社, 2005:51−74.FU Chong-yue. Principle of non-ferrous metallurgy[M]. Beijing:Metallurgical Industry Press, 2005: 51−74.
Thermodynamics of carbothermal reduction of alumina in vacuum
FENG Yue-bin1,2, YANG Bin1, DAI Yong-nian1
(1. National Engineering Laboratory of Vacuum Metallurgy, Faculty of Metallurgy and Energy Engineering,Kunming University of Science and Technology, Kunming 650093, China;2. Faculty of Science, Kunming University of Science and Technology, Kunming 650093, China)
The thermodynamics of the carbothermal reduction of alumina in the vacuum was investigated. The experimental results show that the reduction of alumina with carbon generates gaseous products at a temperature ranging from 1 643 to 1 843 K, and then the gaseous products react to form condensates at lower temperatures, in which the pressure is ranged from 5 to 150 Pa. Thermodynamic analysis indicates that the carbothermal reduction of alumina leads to the generation of Al2O, Al and CO gas at a temperature ranging from 1 200 to 1 900 K and a pressure ranging from 5 to 100 Pa. The initial temperature of the formation of Al2O is lower than that of the formation of Al. However, the formation of Al is easier than that of Al2O when the reaction temperature is higher than a certain value that is determined by the pressure of the system. When the pressure of CO is 1, 10 and 100 Pa, Al2O is stable above 1 462, 1 560 and 1 674 K, and Al is stable above 1 514, 1 635 and 1 777 K, respectively.
alumina; carbon; carbothermal reduction; thermodynamics
TF 131; TF 8
A
1004-0609(2011)07-1748-08
国家自然科学基金会−云南省联合基金重点资助项目(u0837604)
2010-07-16;
2010-11-28
杨 斌,教授,博士;电话:0871-5161583;E-mail: kgyb2005@126.com
(编辑 陈卫萍)
