海绵共附生疣孢菌FIM06031细胞毒活性代谢产物的研究
2011-11-23聂毅磊王传喜郑永标许丽艳方东升连云阳
聂毅磊,王传喜,郑永标,林 如,许丽艳,彭 飞,方东升,连云阳,江 红*
1福建省微生物研究所,福建省新药(微生物)筛选重点实验室,福州350007; 2福建师范大学生命科学院,福州350108;3汕头大学医学院,汕头515041
海绵共附生疣孢菌FIM06031细胞毒活性代谢产物的研究
聂毅磊1,王传喜1,郑永标2,林 如1,许丽艳3,彭 飞1,方东升1,连云阳1,江 红1*
1福建省微生物研究所,福建省新药(微生物)筛选重点实验室,福州350007;2福建师范大学生命科学院,福州350108;3汕头大学医学院,汕头515041
利用正相硅胶、葡聚糖凝胶Sephadex LH-20和反相C18柱层析等方法,从海绵共附生疣孢菌FIM06031的发酵菌丝体提取液中分离到三个化合物(1~3)。通过波谱方法鉴定其中一个化合物harrucomicin C(1)为新倍半萜,另外两个已知化合物为cyperusol C(2)和Nb-乙酰色胺(3)。活性研究表明harrucomicin C对肿瘤细胞株HepG2、EC109和HeLa具显著增殖抑制活性,其IC50值分别为16.99、25.33 μM和34.64 μM;cyperusol C对肿瘤细胞HeLa和HepG2增殖抑制作用的IC50值分别为149.99 μM和167.78 μM。
疣孢菌;细胞毒活性;Harrucomicin C;倍半萜;Cyperusol C
长期以来链霉菌是筛选抗肿瘤药物的主要来源菌[1-3],但随着大多数链霉菌菌株被反复研究,从中发现新药物的机率在逐渐降低,因而,人们把开发新菌源作为寻找新抗肿瘤药物的重要突破口。海洋环境特殊,海洋放线菌产生的抗生素具有结构多样及活性独特的特点[4-6]。
疣孢菌(Verrucosispora)属于放线菌目小单孢菌科(Micromonosporaceae)。目前分离到的该属菌种较少,对疣孢菌次生代谢产物的研究报道更少,已报道的该属三个菌株分别产生结构新颖的抗菌化合物abyssomicin C[7]、抗肿瘤化合物proximicins A-C[8]和雄激素拮抗剂gifhornenolones A-B[9]。
我们采取选择性分离方法从福建莆田平海海域的海绵中,分离到几十株放线菌,基于16S rRNA基因序列的分子分类鉴别这些菌株属于疣孢菌属,选取其中一株初筛具显著抑制肿瘤细胞作用的疣孢菌FIM06031为研究对象,研究其肿瘤细胞毒活性代谢产物。从FIM06031的发酵菌丝体提取液中分离得到三个化合物(1~3),包括一个新倍半萜harrucomicin C(1),其对肿瘤细胞株HepG2,EC109和HeLa具显著增殖抑制活性。
1 材料与方法
1.1 材料
1.1.1 仪器材料
Beckman J-20xp离心机;硅胶GF254薄层层析板(青岛海洋化工厂);柱层析用硅胶(100~200目);凝胶Sephadex LH-20(Phammacia);反相硅胶RP-18 (Merck);API QSTAR Pulsar i System质谱仪;Bruker AV-400超导核磁共振波谱仪(TMS作为内标,δ为ppm,J为Hz);所用试剂均为分析纯。
1.1.2 实验菌株和细胞株
疣孢菌FIM06031,福建省微生物研究所菌种资源库保存,作为专利菌种保藏于中国微生物菌种保藏中心,编号:CGMCC NO.3924。
实验细胞株HepG2(肝癌细胞)、EC109(食管癌细胞)和HeLa(宫颈癌细胞)由汕头大学医学院提供,均为国际通用的肿瘤细胞株。
1.1.3 种子培养基
种子培养基(%):可溶性淀粉1.5,葡萄糖0.5,蛋白胨0.5,酵母粉0.5,MgSO4·7H2O 0.05,NaCl 0.05,(NH4)2SO40.05,CaCO30.1,自来水配制,pH 7.8(灭菌前)。
1.1.4 发酵培养基
发酵培养基(%):可溶性淀粉4.0,葡萄糖0.5,黄豆饼粉 2.5,酵母粉 0.5,MgSO4·7H2O 0.05,K2HPO40.05,CaCO30.1,50%陈海水配制,pH 7.8(灭菌前)。
1.2 方法
1.2.1 菌株FIM06031的发酵
取一铂环菌株FIM06031淀粉天冬素琼脂斜面培养物接入种子培养基,35℃,240 rpm/min培养45 h;10%移种量转入30 L发酵培养基,28℃,240 rpm/min振荡培养96~120 h。
1.2.2 成分的提取
FIM06031菌株发酵液(30 L)4500 rpm/min离心15 min后获得的菌丝体用95%乙醇(10 L)浸泡1 d,浸泡液减压浓缩去除乙醇。浓缩液用乙酸乙酯(6 L)萃取,减压浓缩得膏状提取物(13.5 g)。
1.2.3 化合物的分离和纯化
膏状提取物(13.5 g)行正相硅胶柱层析,洗脱剂采用环己烷∶丙酮=2∶1,分段收集洗脱液。硅胶薄层层析(TLC)(二氯甲烷∶甲醇=5∶1)检测,硫酸-乙醇(5∶95)显色,105℃烘烤,合并相同组份,得到组份A(2.9 g)和组份B(2.5 g);组份A行反相C18色谱柱层析(甲醇∶水=50∶100),分段收集洗脱液,合并相同组份,得到组份A1(0.7 g);A1经Sephadex LH-20凝胶柱层析,甲醇洗脱,合并得到组份A11(0.4 g);A11经正相硅胶柱层析,洗脱剂采用石油醚∶丙酮=1∶1,分段收集洗脱液,TLC检测,在Rf值约0.6左右处有粉红色转黑色斑点,合并获得化合物1(3 mg),在Rf值约0.4左右处有粉红色转黑色斑点,合并获得化合物2(4 mg);组份B(2.5 g)经反相C18色谱柱层析(甲醇∶水=75∶100),分段收集洗脱液,合并得到组份B1(0.6 g);B1行正相硅胶柱层析,洗脱剂采用石油醚∶丙酮=3∶1,分段收集洗脱液,TLC检测,在Rf值约0.7左右处有黄色斑点,合并获得化合物3(8 mg)。
1.2.4 MTT法[10]测定化合物细胞毒活性
分别取对数生长期的HepG2(肝癌细胞)、EC109(食管癌细胞)和HeLa(宫颈癌细胞),调整细胞浓度至1×105~4×105个/mL,取100 μL接种于96孔板,于37℃、5%CO2培养箱培养24 h后,将培养孔内的培养基吸净,每孔加入100 μL相应浓度的含药物的培养液,每一样品设三平行组,同时设空白,阳性对照为氟尿嘧啶(5-氟-2,4(1H,3H)-嘧啶二酮),于培养箱继续培养72 h后,加入MTT液(5 mg/mL)10 μL,继续孵育3~4 h,吸净培养液,每孔加入150 μL的DMSO,振荡使结晶充分溶解,在酶联免疫检测仪(λ=570 nm)上测定各孔的光吸收值。
2 结果与讨论
2.1 化合物结构鉴定
通过正相硅胶、葡聚糖凝胶Sephadex LH-20和反相C18柱层析,共分离到3个化合物,根据NMR以及MS数据分别鉴定为harrucomicin C(1)、cyperusol C(2)和Nb-乙酰色胺(3)。化学结构式见图1:

图1 化合物1~3的结构Fig.1 Structures of compounds 1-3
化合物1 白色无定形粉末。溶于甲醇,丙酮,乙酸乙酯等有机溶剂。[α]23D+14.2(c 0.2,MeOH);HR-ESI-MS m/z:379.2249[M+Na]+(calcd for 379.2351),确定分子式为C23H32O3,计算其不饱和度为8。1H NMR(CD3OD,400 MHz),在低场区显示有5个芳环质子信号δ:7.27(5H,m),同时碳谱中6个信号δ:135.9(s),130.4(d,×2),129.5(d,×2),128.1(d),进一步证实了单取代苯环的存在。比较化合物1和已知化合物cyperusol C (2)的1H及13C NMR数据发现,1除多出一个单取代的苯环信号外,在氢谱上多了一个亚甲基氢信号δ 3.61(2H,s),在碳谱上多了两个碳信号δ 173.3和δ 42.6。分析HSQC图谱,发现δ 3.61(2H,s)与δ 42.6相关,HMBC图谱中δ 3.61(2H,s,H-2')质子信号与δ 173.3(C-1')、δ 135.9(C-3')和δ 130.4 (C-4')碳信号相关,结合分子式推测1可能比2多了一个苯乙酰基。比较两个化合物的氢谱,发现1中H-1位质子信号(δ 4.51)与化合物2(δ 3.23,H-1)的化学位移相差较大,推测苯乙酰基可能连在C-1位羟基上。HMBC图谱中δ 4.51(H-1)与δ 173.3 (C-1')的相关,进一步证实了这一推断,化合物1的平面结构由此确定。
1的相对构型通过ROESY图谱确定,在ROESY图谱中可以看到信号H-1与Hα-3、H-5相关,H-5与H-7相关,H-14与H-15相关。与文献[11]报道的核磁数据对比进一步验证了化合物1的相对构型(见图1)。经SciFinder和INSPEC等数据库检索,未发现相关报道,表明这是一个新的化合物,命名为harrucomicin C。主要二维相关见图2。并对其核磁数据进行了归属。1H NMR(CD3OD,400 MHz)δ: 4.51(1H,dd,J=10.4,4.8 Hz,H-1),1.68(1H,m,Hα-2),1.62(1H,m,Hβ-2),1.75(1H,ddd,J= 12.0,3.5,3.0,Hz,Hβ-3),1.57(1H,ddd,J=13.5,12.0,3.5 Hz,Hα-3),1.36(1H,m,H-5),1.86(1H,m,Hα-6),1.22(1H,m,Hβ-6),1.88(1H,m,H-7),1.45(1H,m,Hα-8),1.30(1H,dddd,J=17.0,13.5,13.0,3.5 Hz,Hβ-8),1.43(1H,ddd,J=13.5,3.5,3.5 Hz,Hβ-9),1.04(1H,ddd,J=13.5,13.0,4.0 Hz,Hα-9),4.69(2H,d,J=6.5 Hz,H-12),1.71 (3H,s,H-13),0.90(3H,s,H-14),1.08(3H,s,H-15),3.61(2H,s,H-2'),7.27(5H,m,H-3'-8');13C NMR(CD3OD,100 MHz)δ:82.9(d,C-1),26.1(t,C-2),41.3(t,C-3),72.0(s,C-4),54.2(d,C-5), 26.8(t,C-6),47.2(d,C-7),27.5(t,C-8),41.6 (t,C-9),39.5(s,C-10),151.6(s,C-11),108.9 (t,C-12),21.1(q,C-13),14.5(q,C-14),22.5 (q,C-15),173.3(s,C-1'),42.6(t,C-2'),135.9 (s,C-3'),130.4(d,C-4'),129.5(d,C-5'),128.1 (d,C-6'),129.5(d,C-7'),130.4(d,C-8')。
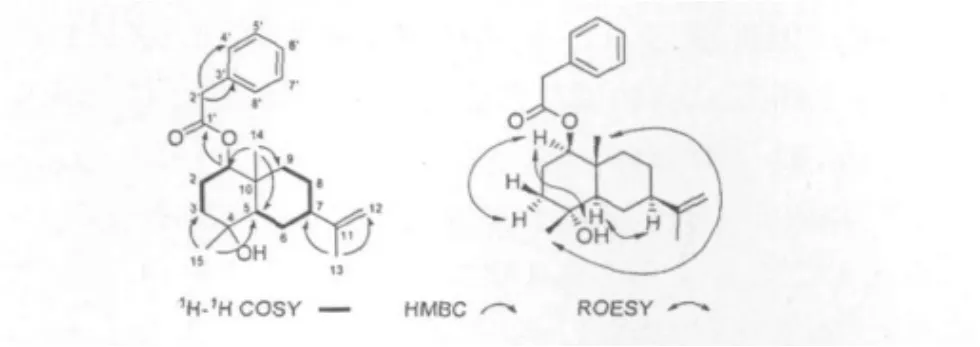
图2 Harrucomicin C的主要1H-1H COSY,HMBC和ROESY相关Fig.2 Key1H-1H COSY,HMBC and ROESY correlations for Harrucomicin C
化合物2 无色油状物。溶于甲醇,丙酮,乙酸乙酯等有机溶剂。[α–31.5(c 1.0,MeOH) APCI-MS(大气压化学电离质谱)m/z:238.5[M]+。HR-EI-MS m/z:238.1934[M]+(calcd for 238.1933)确定分子式为 C15H26O2。1H NMR (CD3OD,400 MHz)δ:3.23(1H,dd,J=11.2,4.4 Hz,H-1),1.64(2H,m,H-2),1.72(1H,ddd,J= 12.0,3.5,3.0 Hz,Hβ-3),1.52(1H,ddd,J=13.5,12.0,3.5 Hz,Hα-3),1.28(1H,m,H-5),1.86(1H,m,Hα-6),1.24(1H,m,Hβ-6),1.90(1H,m,H-7),1.56(1H,m,Hα-8),1.38(1H,dddd,J=17.0,13.5,13.0,3.5 Hz,Hβ-8),1.94(1H,ddd,J=13.5,3.5,3.5 Hz,Hβ-9),1.13(1H,ddd,J=13.5,13.0,4.0 Hz,Hα-9),4.69(2H,m,H-12),1.74(3H,s,H-13),0.88(3H,s,H-14),1.08(3H,s,H-15);13C NMR(CD3OD,100 MHz)δ:80.3(d,C-1),29.4(t,C-2),41.9(t,C-3),72.4(s,C-4),54.1(d,C-5),27.1(t,C-6),47.5(d,C-7),27.8(t,C-8),42.0 (t,C-9),40.3(s,C-10),151.8(s,C-11),108.9 (t,C-12),21.2(q,C-13),13.8(q,C-14),22.6 (q,C-15)。化合物2的相对构型通过ROESY图谱确定,在ROESY图谱中可以看到信号H-1与H-3、H-5相关,H-5与H-7相关,H-14与H-15相关。通过与文献[11]报道的核磁数据对比进一步验证了化合物2为cyperusol C。
化合物3 淡黄色油状物。UV λmax(MeOH) nm:218,280。ESI-MS m/z:203[M+H]+,225[M +Na]+结合氢谱和碳谱确定分子式为 C12H14N2O。1H NMR(CD3OD,400 MHz)δ:8.14(1H,brs,NH-1),7.04(1H,d,J=2.2 Hz,H-2),7.60(1H,d,J=8.0 Hz,H-4),7.13(1H,dd,J=8.0,8.0 Hz,H-5),7.21(1H,dd,J=8.0,8.0 Hz,H-6),7.38(1H,d,J=8.0 Hz,H-7),2.98(2H,t,J=6.5 Hz,H-10),3.60(2H,dt,J=6.5,6.0 Hz,H-11),5.53(1H,brs,NH-12),1.92(3H,s,H-14);13CNMR (CD3OD,100 MHz)δ:122.3(d,C-2),113.3(s,C-3),119.2(d,C-4),119.6(d,C-5),123.3(d,C-6),112.2(d,C-7),138.2(s,C-8),128.8(s,C-9),26.2(t,C-10),41.5(t,C-11),173.2(s,C-13),22.6(q,C-14)。与文献[12]报道的核磁数据对比进一步确定了化合物3为Nb-乙酰色胺。
2.2 细胞毒活性
Harrucomicin C(1)对肿瘤细胞HepG2,EC109和HeLa具有显著增殖抑制活性,其IC50值分别为16.99 μM、25.33 μM和34.64 μM;cyperusol C(2)对肿瘤细胞HeLa和HepG2也具增殖抑制活性,其IC50值分别为149.99 μM和167.78 μM。
2.3 讨论
从海绵共附生疣孢菌FIM06031的发酵菌丝体提取液中分离到三个代谢产物harrucomicin C,cyperusol C和Nb-乙酰色胺。其中harrucomicin C为新的具有显著肿瘤细胞增值抑制活性的倍半萜,对其作用机理值得进一步的研究,同时预示疣孢菌是产生新生物活性次生代谢产物的重要菌株来源,值得进一步的研究。由于疣孢菌FIM06031的发酵菌丝体中harrucomicin C含量微量,样品制备困难,发酵条件值得进一步优化。Cyperusol C是2004年Xu FM等[11]首次从中药Cyperus longus中分离到,2010年Shirai M等[9]从一株疣孢菌中也分离到该化合物;Nb-乙酰色胺是2003年Li Y等[12]从海绵共附生的真菌中分离到。
1 Zang X(臧旭),Huang M(黄敏).Advances in studies of antitumor metabolites from marine microorganisms.Chin J Microecol(中国微生态学杂志),2010,22:949-953.
2 Peng JL(彭建柳),Chen Y(陈育),Yuan XZ(袁学丈).The study progress of anti-tumor activity substance for marine organisms.Int Med Health Guidance News(国际医药卫生导报),2009,15:120-123.
3 Liu YL(刘燕兰),Xiao LH(肖丽华),Wu M(吴敏),et al.Advances in studies of antitumor metabolites from marine microorganisms.Guiding J Tradit Chin Med Pharm(中医药导报),2007,13:114-116.
4 Fu JZ(傅俊曾),Ji LX(冀兰鑫),Xie CF(谢春锋).Biologically active natural products from Streptomyces microorganisms.Drug Eval Res(药物评价研究),2010,33:153-158.
5 Liu L(刘丽),Hu JC(胡江春),Wang SJ(王书锦).Progress in studies on bioactive metabolites of sponge associated microbes.Nat Prod Res Dev(天然产物研究与开发),2004,16:477-481.
6 Prudhomme J,McDaniel E,Ponts N,et al.Marine actinomycetes:a new surce of compounds against the human malaria parasite.PLoS ONE,2008,3:2335-2338.
7 Fiedler HP,Bruntner C,Riedlinger J,et al.Proximicin A,B and C,novel aminofuran antibiotic and anticancer compounds isolated from marine strains of the actinomycete Verrucosispora.J Antibiot(Tokyo),2008,61:158-163.
8 Riedlinger J,Reicke A,Zahner H,et al.Abyssomicins,inhibitors of the para-aminobenzoic acid pathway producedby the marine Verrucosispora strain AB-18-032.J Antibiot(Tokyo),2004,57:271-279.
9 Shirai M,Okuda M,Motohashi K,et al.Terpenoids produced by actinomycetes:isolation,structural elucidation and biosynthesis of new diterpenes,gifhornenolones A and B from Verrucosispora gifhornensis YM28-088.J Antibiot(Tokyo),2010,63:245-250.
10 Furukawa S.In vitro chemosensitivity of hepatocellular carcinoma for hepatic arterial infusion chemotherapy using the MTT assay with the combinations of antitumor drugs.Kurume Med J,2004,51:25-33.
11 Xu FM,Morikawa T,Matsuda H,et al.Structures of new sesquiterpenes and hepatoprotective constituents from the egyptian herbal medicine cyperus longus.J Nat prod,2004,67: 569-576.
12 Li Y,Li XF,Kim DS,et al.Indolyl alkaloid derivatives,Nbacetyltryptamine and oxaline from a marine-derived fungus.Arch Pharm Res,2003,26:21-23.
Novel Secondary Metabolites with Cytotoxic Activities Produced by Verrucosispora sp.FIM06031 from Marine Sponge
NIE Yi-lei1,WANG Chuan-xi1,ZHENG Yong-biao2,LIN Ru1,XU Li-yan3,PENG Fei1,FANG Dong-sheng1,LIAN Yun-yang1,JIANG Hong1*1Fujian Provincial Key Laboratory of Screening for Novel Microbial Products,Fujian institute of microbiology,Fuzhou 350007,china;2Life sciences College of Fujian Normal Univesity,Fuzhou 350108,china;3Shantou University Medical College,Shantou 515041,china
Three compounds(1-3)were isolated from culture broth of Verrucosispora sp.FIM06031 from marine sponge by silica gel,sephadex LH-20 and C18reversed phase column chromatography.On the basis of spectral data,they were identified as a novel sesquiterpenoid harrucomicin C(1),cyperusol C(2),and Nb-acetyltryptamine(3).Compound 1 showed prominent growth inhibitory activity against the tumor cell lines HepG2,EC109 and HeLa with IC50values of 16.99,25.33 μM and 34.64 μM,respectivity in vitro by MTT assay,while 2 showed growth inhibitory activity against HeLa and HepG2 cells with IC50values of 149.99 μM and 167.78 μM,respectively.
Verrucosispora;cytotoxic activity;harrucomicin C;sesquiterpenoid;cyperusol C
1001-6880(2011)05-0797-04
2011-04-20 接受日期:2011-07-29
国家“十一五”重大专项(2010ZX09401-403);福建省自然科学基金项目(2011J01092);福建省重点项目(2009R10003-1)
*通讯作者 Tel:86-591-83475544;E-mail:jianghong709@yahoo.com.cn
R284.2
A
