非洲山毛豆幼茎愈伤组织培养及其鱼藤酮含量检测
2011-11-23吴玉东冯敏英徐汉虹
吴玉东,冯敏英,陆 慧,徐汉虹
华南农业大学天然农药与化学生物学教育部重点实验室,广州510642
非洲山毛豆幼茎愈伤组织培养及其鱼藤酮含量检测
吴玉东,冯敏英,陆 慧,徐汉虹*
华南农业大学天然农药与化学生物学教育部重点实验室,广州510642
以MS为基本培养基,以非洲山毛豆幼茎为外植体进行培养,探索2,4-D质量浓度与不同浓度的激素组合对愈伤组织诱导的影响,对最佳组合培养基不同培养时间的愈伤组织中鱼藤酮含量进行HPLC测定。实验结果表明以1.00 mg/L 2,4-D和0.70 mg/L 6-BA组合的MS培养基诱导效果最佳,其诱导的愈伤组织分别培养30、60 d和90 d后鱼藤酮的含量分别为干愈伤组织的0.0013%、0.016%和0.06%,非洲山毛豆幼茎愈伤组织中的鱼藤酮含量随培养时间的延长而提高,统计分析显示差异显著。
非洲山毛豆;愈伤组织;激素;鱼藤酮;HPLC;生物农药
非洲山毛豆(Tephrosia vogelii)属于豆科,蝶形花亚科,灰叶属,多年生灌木或小乔木,原产于热带非洲的一种杀虫植物,主要分布于北纬15°至南纬20°之间的广大地区,整株均含有鱼藤酮,尤以叶片中的含量最高[1]。鱼藤酮(rotenone)具有触杀、胃毒、拒食和熏蒸作用,杀虫谱广,对15个目137科的800多种害虫具有一定的防治效果,对蚜螨类害虫效果尤其突出,是无公害农产品和绿色食品的理想生物农药[2]。
20世纪40年代后期,Bonner首次报道银胶菊植物组织培养物可以产生橡胶;50年代末期,West和Mike发现阿托品颠茄碱在根部合成聚集可由根部愈伤组织衍生诱导;其后,在用组织培养技术产生有用的次生代谢物方面取得了很大成就[3]。目前药用植物细胞培养技术发展迅速,已从被研究的400多种植物细胞中分离出600多种次生代谢产物,其中有60多种在含量上超过或等于原植物[4],因此,利用细胞工程技术生产有用的次生代谢物质具有广阔的应用前景。利用组织培养技术,诱导愈伤组织,提取药用活性成分的方法在许多药用植物研究方面被采用。由于鱼藤酮分子结构复杂,难以人工合成,目前主要从植物中提取获得,但鱼藤酮类化合物的生产受到植物资源、生长季节、提取工艺等方面的限制。用植物细胞培养技术生产包括鱼藤酮类化合物在内的次生物质是当前生物工程中最活跃的研究领域之一。研究非洲山毛豆植株内鱼藤酮类化合物的相关报道较多,但未见有关利用非洲山毛豆愈伤组织提取鱼藤酮的研究报道。国内外对非洲山毛豆愈伤组织的诱导研究没有相关报道,但对鱼藤酮含量的定量测定的报道很多[5]。
本研究以非洲山毛豆的嫩茎为原始诱导材料,以MS附加不同水平组合的2,4-D、NAA、6-BA为愈伤组织诱导培养基[6],结合广泛采用的HPLC法检测愈伤组织内的鱼藤酮,以探索植物生长调节物质对植物次生代谢的调控作用,为组织或细胞大量培养工业化生产鱼藤酮提供基础。
1 材料与方法
1.1 非洲山毛豆愈伤组织诱导、培养
1.1.1 外植体
外植体:非洲山毛豆幼茎组织采自本实验室植物标本园内。
1.1.2 外植体消毒
将幼茎先用自来水冲洗5 min,再将材料用洗洁精洗净,无菌操作台上吸水纸吸干后分别使用0.1%HgCl消毒8 min、75%酒精浸泡30 s、无菌水清洗5次进行表面消毒处理,备用。
1.1.3 愈伤组织的诱导
以MS培养基为基本培养基,添加2,4-D、6-BA、NAA浓度(表1),121℃灭菌30 min,倒入15 cm培养皿,每皿30 mL,冷却待用。
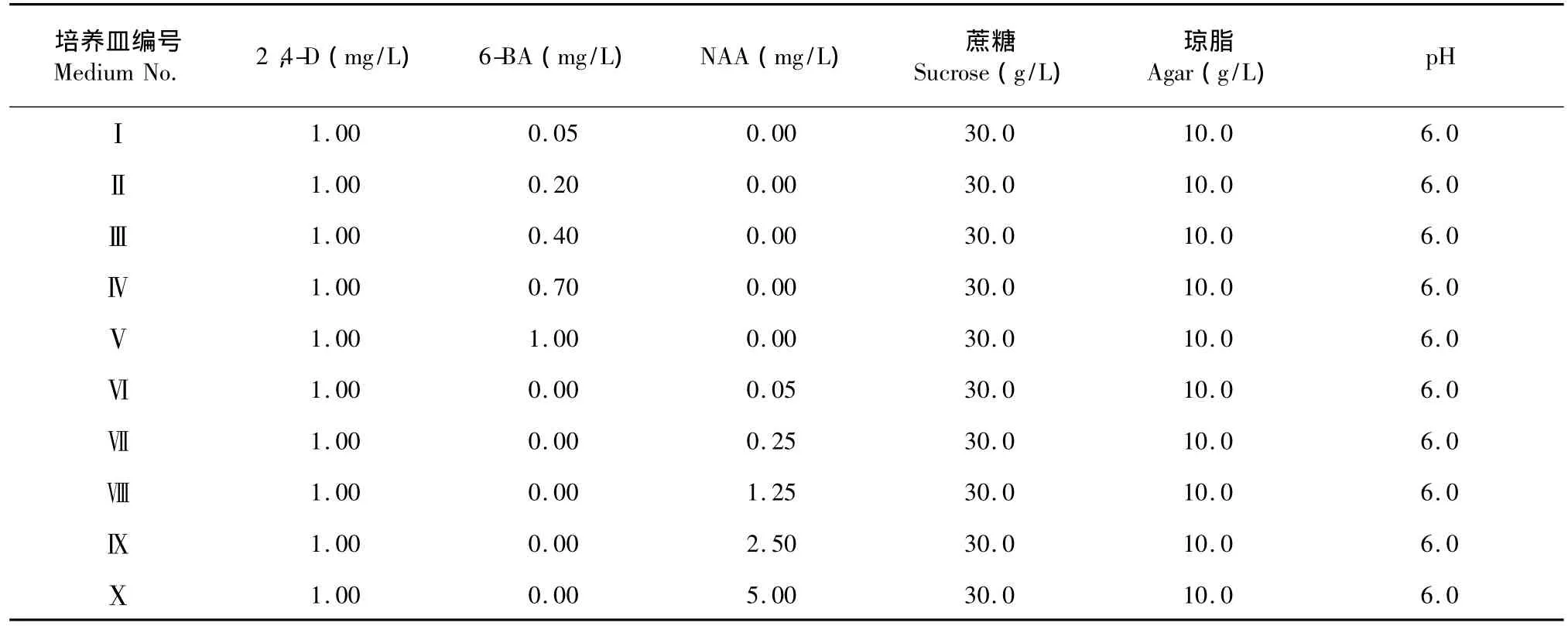
表1 诱导培养基的成分Table 1 Callus induction cultivation
1.1.4 无菌接种
茎段:将已经消好毒的幼茎用手术刀切去其上叶片并刮伤茎部,再切成0.5 cm长的小段接入诱导培养基中。
接种量:每一个处理接3个培养皿(3个重复),每皿接8块外植体,共计有40组实验、200个重复、约1000块外植体。
1.1.5 培养
暗诱导培养:温度25±1℃、湿度85% ±5%条件下各暗培养20 d。
1.1.6 观测记录与数据处理
诱导时间:外植体接入诱导培养基后每天观察一次,每个处理三个重复中第一块外植体长出愈伤组织所需时间即为该处理的愈伤组织诱导时间。
计算愈伤组织诱导率的公式:
愈伤组织诱导率(%)=产生愈伤组织外植体个数/接入外植体个数×100%
在继代培养前观察记录愈伤组织的颜色、形状和生长状态。
1.2 非洲山毛豆愈伤组织增殖继代培养及鱼藤酮检测
选取8种诱导培养基(表1)中诱导培养的黄绿色、生长旺盛、结构疏松、大小一致愈伤组织,在无菌条件下转接到8种继代培养基上(表1)进行增殖继代培养,每组处理接5个重复,每瓶接3块愈伤组织。其后每天观察记录愈伤组织的颜色、形状和生长状态。
1.2.1 培养物中鱼藤酮的提取及检测
愈伤组织内鱼藤酮的提取:取出继代培养的愈伤组织,在干燥箱中50±5℃下烘干,称取干愈伤组织1.00 g,研磨成粉。加入丙酮20.0 mL超声波提取30 min,黑暗静置48 h,4000 r/min离心取上清液,0.45 μm有机滤膜过滤后放入4℃冰箱中待测。
1.2.2 鱼藤酮含量的HPLC测定
1.2.2.1 仪器
美国惠普高效液相色谱仪配置四元梯度泵、紫外可见光波长检测器、自动进样器、惠普化学工作站。色谱柱:Hypersil ODS柱(250 mm×4.6 mm,5 μm);检测器:紫外检测器;
1.2.2.2 条件
柱温:25℃;检测波长:299 nm;流速:1.00 mL/ min;进样量:5 μL;定量方法:外标法。
鱼藤酮标样由Sigma公司提供(含量>95%,批号:14511DH)。提取所用有机溶剂均为分析纯,HPLC分析所用有机溶剂均为色谱纯,水均为Milli-Q纯水。所用混合溶剂各组分的比例或浓度均为体积比或体积分数。
标准溶液的制备:精密称取鱼藤酮对照品适量,用丙酮配成800 mg/L溶液,做为标准溶液。
1.2.3 标准曲线的绘制
采用丙酮溶解鱼藤酮标准品,配成25、50、100、200、400 mg/L和800 mg/L的溶液,按照1.2.1的分析方法测定鱼藤酮的含量。以峰面积为纵坐标,浓度为横坐标绘制鱼藤酮标准曲线。
2 结果与分析
2.1 植物生长调节剂对非洲山毛豆愈伤组织诱导培养的影响
非洲山毛豆幼茎在MS培养基上分别接种,培养基中附加2,4-D、6-BA或NAA。在暗培养条件下诱导愈伤组织。接种7 d后,组织块开始有不同程度的膨大。14 d以后膨大组织周围生长出大量愈伤组织(表2)。诱导效果最佳的培养基编号是Ⅳ,产生的愈伤组织生长旺盛,松软,瘿瘤愈伤多(图1)。

表2 植物生长调节物质对诱导率的影响Table 2 Influence of plant growth regulators on percentage of callus induced

图1 非洲山毛豆愈伤组织Fig.1 The callus of Tephrosia vogelii
采用培养基0.70 mg/L 6-BA+1.00 mg/L 2,4-D诱导的非洲山毛豆幼茎愈伤组织,其生长迅速,质地松软,色泽均匀,是各组合激素中生长最好的愈伤组织(图1)。幼茎培养4 d后开始膨大,6 d后部分外植体开始从刮伤处或端口长出愈伤组织。培养20 d后,10种不同激素浓度处理的外植体出愈率、愈伤组织的生长情况和颜色差异显著。以6-BA 0.70 mg/L与1.00 mg/L 2,4-D激素组合处理的诱导率最高,达100%,所诱导的愈伤组织为乳白色,有光泽,质地松软,生长速度快。6-BA 0.02 mg/L与1.00 mg/L 2,4-D组合时,愈伤组织的诱导率仅为65%,诱导出来的愈伤组织淡黄色,无光泽,愈伤组织质地致密,生长旺盛,而6-BA 1.00 mg/L与1.00 mg/L 2,4-D组合时诱导出来的愈伤组织白色,无光泽,水渍状,生长旺盛。可见过高或过低的浓度激素均不利于愈伤组织的诱导和生长。以不同浓度的NAA与1.00 mg/L 2,4-D组合诱导的幼茎效果不及6-BA,其中浓度为1.25 mg/L的诱导率最高仅25%且愈伤组织干滑,生长缓慢,有褐化倾向。使用6-BA诱导幼茎,诱导率比较高,所诱导的愈伤组织生长也比较好。结果显示,不同的激素组合对非洲山毛豆愈伤组织诱导及生长有不同的影响,其中以2,4-D1.00 mg/L+6-BA 0.70 mg/L的长势最好,与其他组合对非洲山毛豆幼茎的影响差异显著,2,4-D与6-BA适当的组合较有利于愈伤组织的快速诱导可能与2,4-D/6-BA的比值有关,组合为1.00 mg/L 2,4-D+0.05 mg/L NAA(比值为20)时明显不如组合为0.20、0.40、0.70与1.00 mg/L 2,4-D (比值为1∶1~1∶5),较低的该比值(1∶1~1∶1.5)较为有利与产生愈伤组织。NAA对幼茎愈伤组织的快速诱导不太适合。较低水平的2,4-D或NAA对幼茎启动更有利,这可能与其本身的内源生长素水平有关。总之,2,4-D/NAA高于1∶2.5时(Ⅸ),不利于非洲山毛豆愈伤组织的诱导。
2.2 线性关系试验
量取1000 μg/mL的标准溶液使用丙酮稀释到100、50、25、12.5 μg/mL和6.25 μg/mL,进样量为5 μL,以标准溶液峰面积Y为纵坐标,以进样浓度(μg/mL)X为横坐标进行线性回归,得回归方程为: Y=12.832X-110.97(r=0.9998)。表明鱼藤酮在6.25~100 μg/mL浓度范围内线性关系良好。
2.3 精密度试验
精密吸取同一标准溶液(25 μg/mL)5 μL,重复进样5次,测定鱼藤酮的峰面积值,RSD=0.71%,表明仪器精密度良好。
2.4 稳定性试验
标准溶液(25 μg/mL),在相同的色谱条件下,每隔2 h进样1次,共5次(n=5),测定鱼藤酮的峰面积值,RSD=0.91%,表明该样品溶液在10 h内基本稳定。
2.4.1 重复性试验
取同一供试样品5份(n=5),每份精确称取1.00 g,按“1.3.1”项中的方法处理,残渣用丙酮洗涤,测定鱼藤酮的峰面积值,结果鱼藤酮峰面积值的RSD=1.37%,表明重现性良好。
2.4.2 加样回收率试验
采用加样回收法:精确称取已知含量(4.165 μg/mL)的样品,分别加入一定量的鱼藤酮(5.000 μg/mL)对照品,按“1.3.1”项的色谱条件依法测定峰面积,计算回收率。结果平均回收率为101.19%,RSD=1.20%。
2.4.3 含量测定
精确称取干愈伤组织粉碎品,按“1.3.1”所述方法制备样品溶液,吸取5 μL样品溶液,测定含量。结果表明:同一培养基培养的愈伤组织内鱼藤酮的含量随时间的延长而增加。培养30 d的愈伤组织内鱼藤酮含量为0.0013%,60 d的含量提高了12倍,90 d后鱼藤酮含量是30 d时的46倍(表3)。愈伤组织内鱼藤酮含量方差分析表明,分别培养30、60、90 d的愈伤组织内鱼藤酮含量在1%水平上差异极显著(表4)。
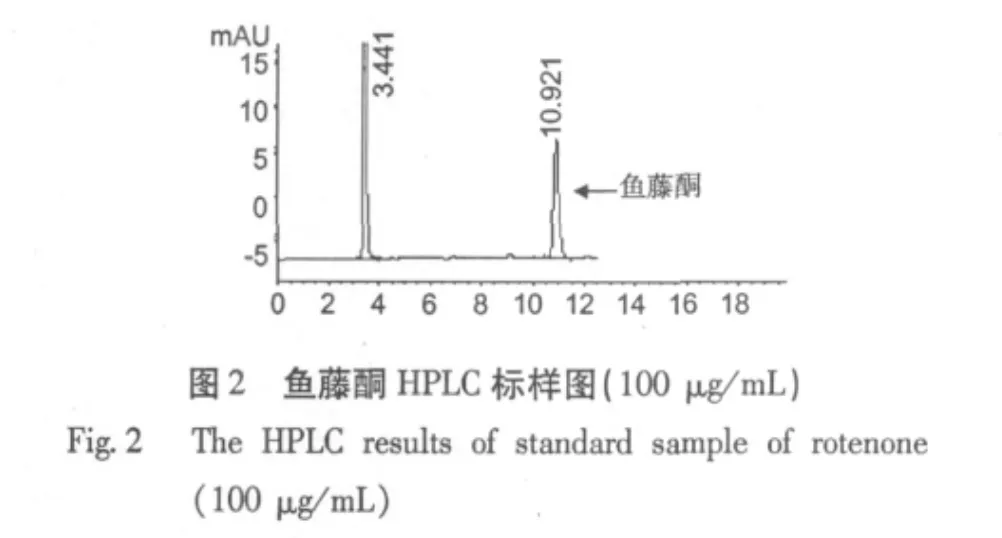

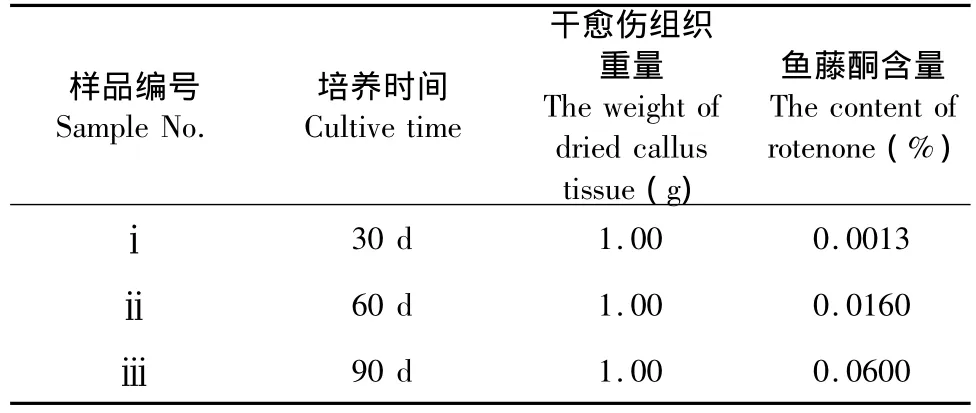
表3 样品中鱼藤酮含量测定结果Table 3 The determination results of rotenone content in the sample
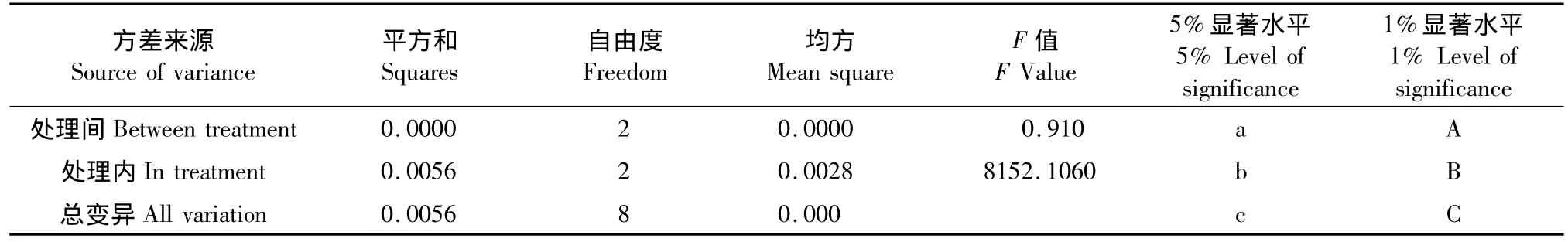
表4 愈伤组织内鱼藤酮含量方差分析表Table 4 Variance analys of the rotenone content in the callus
3 讨论
对于药用植物,利用愈伤组织培养提取药用活性成分是获得有效成分的一种行之有效的方法。郭志刚[7]等对盐生肉苁蓉愈伤组织培养方法与苯乙醇苷化合物合成进行了研究,认为愈伤组织中的主要成分与天然肉苁蓉基本相同。于荣敏等[8]对银杏愈伤组织培养和其代谢产物银杏内酯进行了研究,筛选出了银杏内酯高产细胞系,银杏内酯量达万分之一,与天然植物的量相当。植物细胞培养的研究表明,次生代谢物的积累与培养细胞的分化程度之间存在正相关,愈伤组织的培养具有初步分化或部分分化的结构,可以积累较多的产物,但只有在细胞生长的相对静止期才能积累较多产物,如甜菜产生的新疆圆柏毒素(Podophyllotoxin),在培养的滞后期物质发生积累。这说明,慢速生长、分化或部分分化的组织或组织团块,才能积累较多的次生产物。在苦茄(Solanum dulcamara)细胞悬浮培养中,直径为5 mm或更大的青色细胞团,其类固甾碱含量为小细胞团的4倍;而三尖杉目(Cepalotaxus)的次生代谢物只在固体培养的愈伤组织中存在,一旦转入液体进行单细胞悬浮培养,目的次生代谢产物就消失或含量极低。利用组织和细胞培养技术生物合成途径生产鱼藤酮具有独特的优势和意义,Kodama对毛鱼藤的研究结果表明[9],离体培养鱼藤酮的含量为2.9 μg/g。曾鑫年对西非灰毛豆愈伤组织内鱼藤酮含量进行了测定,其含量为1.8 μg/g。前人对植物愈伤组织培养及细胞悬浮培养提取植物次生代谢物质的成功经验,为非洲山毛豆细胞培养产生鱼藤酮提供了参考。非洲山毛豆整株含有鱼藤酮,其茎的生活力及硬度是诱导愈伤组织最合适的外植体,在适宜的培养条件下诱导产生的大量愈伤组织可用于提取鱼藤酮类化合物,同时也为非洲山毛豆的植株再生奠定了良好的基础。
笔者利用高效液相色谱技术对非洲山毛豆幼茎诱导出的愈伤组织中的鱼藤酮进行了定性定量检测。鱼藤酮在愈伤组织中的含量与培养时间成相关性,但是含量不高,而植物细胞培养产生次生代谢物质与植物外植体、培养条件、培养技术、前体物、诱导剂抑制剂等因素有相关性[10]。说明利用非洲山毛豆愈伤组织培养技术来提取生物农药鱼藤酮有待于进一步的研究。
1 Zhang YG(张业光),Xu HH(徐汉虹),Huang JG(黄继光).The antifeeding activity of Tephrosia vogelii(Hook)A-gainst Species of Lepidoptera.J South China Agric Univ(华南农业大学学报),2000,21(4):26.
2 Xu HH(徐汉虹),Huang JG(黄继光).Advances in research of rotenone.J Southwest Agric Univ(西南农业大学学报),2001,23:140.
3 Yeoman MM.Manipulating secondary metabolism in cultured plant cell.New Phytol,1996,134:553-563.
4 Zhang YL(张永乐),Fu GQ(付桂芹).Secondary metabolic engineering of medicinal plants and herbal medicine production.Forest By-Product and Speciality in China(中国林副特产),2005,6(12):69-70.
5 Zeng XN(曾鑫年),Coll J,Zhang SX(张善学),et al.Plants rotenoids improvement of HPLC.Chin J Anal Chem(分析化学),2002,30:1019.
6 Wu YK(武永昆),Lin J(林军),Ye M(叶敏).Determination of rotenone by high performance liquid chromatography.Yunnan Chem Technol(云南化工),2006,33(2):59-60.
7 Guo ZG(郭志刚),Yu JM(于金梅),Liu RZ(刘瑞芝),et al.Studies on culture of cistanche salsa callus and synthesis of phenylethanoid glycosides.Chin Tradit Herb Drugs(中草药),2004,35:204-207.
8 Yu RM(于荣敏),Zhao HL(赵鸿莲),Zheng YG(郑玉果),et al.Studies on the callus culture of ginkgo biloba and its metabolites ginkgolides.Chin J Biotechnol(生物工程学报),1999,15(2):52-58.
9 Kodama T,et al.Rotenoid biosynthesis by tissue culture of Derris elliptica.Agric Bio Chem,1980,44:2387-2390.
10 Ren ZH(任志华),Li L(李玲).A review of strategy to enhance the production of secondary metabolites by plant cell culture.Subtrop Plant Sci(亚热带植物科学),2003,32 (3):64-67.
Callus Culture of Tephrosia vogelii and Content Detection of Rotenone
WU Yu-dong,FENG Min-ying,LU Hui,XU Han-hong*
Key Laboratory of Natural Pesticide and Chemical Biology,Ministry of Education,South China Agricultural University,Guangzhou 510642,China
The effects of different concentrations of 2,4-D and different hormones in combination on the callus induction explored by cultivating explants of the young stem Tephrosia vogelii using MS medium.The contents of rotenone in different culture time of the callus cultivating by optimum combined medium were determined by HPLC.The callus induction obtained optimum effects by 1.00 mg/L 2,4-D and 0.70 mg/L 6-BA combinations of MS medium,and the rotenone contents of the callus after induced cultivation for 30 d,60 d,and 90 d were 0.0013%,0.016%,and 0.06%,respectively.The experimental results showed that the contents of rotenone in the callus of the young stem of Tephrosia vogelii increased gradually as the increase of culture time and showed significant differences.
Tephrosia vogelii;callus;hormone;rotenone;HPLC;biopesticide
1001-6880(2011)05-0889-05
2010-01-18 接受日期:2010-05-20
教育部产学研结合项目(2006D90204003);广东省产学研结合项目(cgzh2d0504)
*通讯作者 Tel:86-20-85285127;E-mail:hhxu@scau.edu.cn
R284.2
A
