166例早期胃癌的诊治分析
2011-11-23李小毅王常珺钟定荣高维生刘洪沨
李小毅,王常珺,钟定荣,高维生,刘洪沨
中国医学科学院 北京协和医学院 北京协和医院 1基本外科 2病理科,北京 100730
·论著·
166例早期胃癌的诊治分析
李小毅1,王常珺1,钟定荣2,高维生1,刘洪沨1
中国医学科学院 北京协和医学院 北京协和医院1基本外科2病理科,北京 100730
早期胃癌;诊断;治疗
胃癌是我国的常见、多发肿瘤,治疗效果一直欠佳。近年来,为提高治疗效果,国内一方面积极推广规范化的胃癌诊治措施,另一方面努力开展早期胃癌的筛查、诊治工作,提高早期胃癌在胃癌患者中的诊治比例,最终改善胃癌患者的治疗结果。据调查,2007年上海13家医院早期胃癌占全部胃癌手术患者的平均比率为13. 2%[1],个别医院可达22.7%~27.2%,但这与日本平均50%以上的水平差之甚远。本研究回顾性分析了166例早期胃癌患者的临床、手术及病理资料,以期为今后的临床诊治提供帮助。
资料和方法
资料来源1999年1月至2009年1月在北京协和医院收治的病历资料完整的早期胃癌患者166例,其中,男114例,女52例,平均年龄(59.7±12.8)岁(23~87岁),中位年龄63岁;平均病程(30.82±66.20)个月,77.90%的患者病程≤24个月。
方法总结166例早期胃癌患者的临床、手术及病理资料,随访患者的治疗结果,对相关数据进行统计学分析。
统计学处理采用SPSS 13.0统计软件,计数资料的比较采用卡方检验或Fisher精确检验(直接概率法),多因素分析采用Lgoistci回归分析,生存分析采用Kaplan-Meier分析,P<0.05为差异有统计学意义。
结 果
一般情况1999年1月至2009年1月在北京协和医院因胃癌而行手术治疗的早期胃癌患者共176例,占同期所有胃癌手术患者的9.04%(176/1946),其中病历资料完整的有166例。166例患者中,就诊原因分别为上腹部饱胀隐痛不适134例(其中18例伴反酸症状),黑便或呕血15例,恶心、进食或吞咽不适5例,消瘦纳差3例,查体发现异常9例;29例(17.47%)有明确胃溃疡或慢性胃炎病史;30例(18.07%)有癌症家族史,其中20例(12.05%)为胃食管癌症家族史;49例(29.52%)查体检查有体征,其中46例有中上腹压痛,2例似可触及肿物,1例有振水音。
辅助检查6.63%(11/166)的患者术前血红蛋白≤110 g/L,13.22%(16/121)大便隐血(+),12.72%(14/110)患者癌胚抗原(carcinoma embryonic antigen,CEA)、糖抗原199(carbohydrate atigen,CA199)、CA242或CA50任一阳性。64例患者行上消化道双对比造影检查,其中57例(89.06%)有阳性发现:明确龛影、占位31例,黏膜紊乱18例,胃壁僵硬7例,低张力胃1例。全部病例均行胃镜检查(其中1例行2次胃镜检查,2例3次,2例4次,1例7次),结果显示:远端胃部病变115例(69.28%),胃体部病变26例(15.66%),胃底部病变25例(15.06%)。胃镜病理活检明确诊断癌者124例(74.70%),中至重度不典型增生21例(12.65%),中至重度不典型增生癌变21例(12.65%)。39例行CT检查,15例未见异常,24例(61.53%)表现为胃壁增厚和/或黏膜异常强化。9例行超声内镜(endoscopic ultrasound,EUS)检查,表现为:黏膜不完整、黏膜或黏膜下层低回声、黏膜或黏膜下层结构不清晰。
手术治疗166例患者中,行胃部分切除 2例(D0)、D1124例、D1+27例、D210例、D33例。术中未触及明确病变者40例(24.10%),触及可疑病变或局部胃壁增厚28例,判断浆膜可疑受累或受累18例;2例胃镜定位病灶,30例切开胃壁定位病灶,7例送术中冰冻病理检查。
病理检查病变平均直径为(2.52±1.62)cm(0~10.00 cm),73.71%的病变直径≤3 cm。隆起型病变21例(21/162,12.96%),平坦型病变61例(61/162,37.65%),凹陷型病变80例(80/162,49.38%);组织类型为分化良好者75例,分化差者91例;肿瘤局限在黏膜内者75例(45.18%,75/166),侵及黏膜下者91例(54.82%,91/166);淋巴结平均清扫(14.30±10.84)个(0~54个),清扫≤10个者74例(44.58%,74/166),≤14个者22例(13.25%,22/166),≥15个者70例(42.17%,70/166);淋巴结转移20例(12.05%,其中N1 18例,N2 2例),均为病变侵及黏膜下层者(20/91,21.98%);脉管瘤栓8例,有浆膜外癌结节1例。
随访结果截止2009年6月,随访丢失6例(3.6%),其余160例随访时间为2~129个月,平均(53.19±33.55)个月;共24例死亡,总体5年生存率为87.9%,无淋巴结转移者和有淋巴结转移者的5年生存率分别为89.7%和70.0%,两者相比差异有统计学意义(P=0.002)。
淋巴结转移的相关因素分析单因素分析结果显示,浸润深度(P=0.000)和脉管瘤栓(P=0.001)与早期胃癌淋巴结转移相关(表1);多因素分析结果显示,脉管瘤栓与淋巴结转移显著相关(OR=15.67,95%CI:3.40~72.14)。
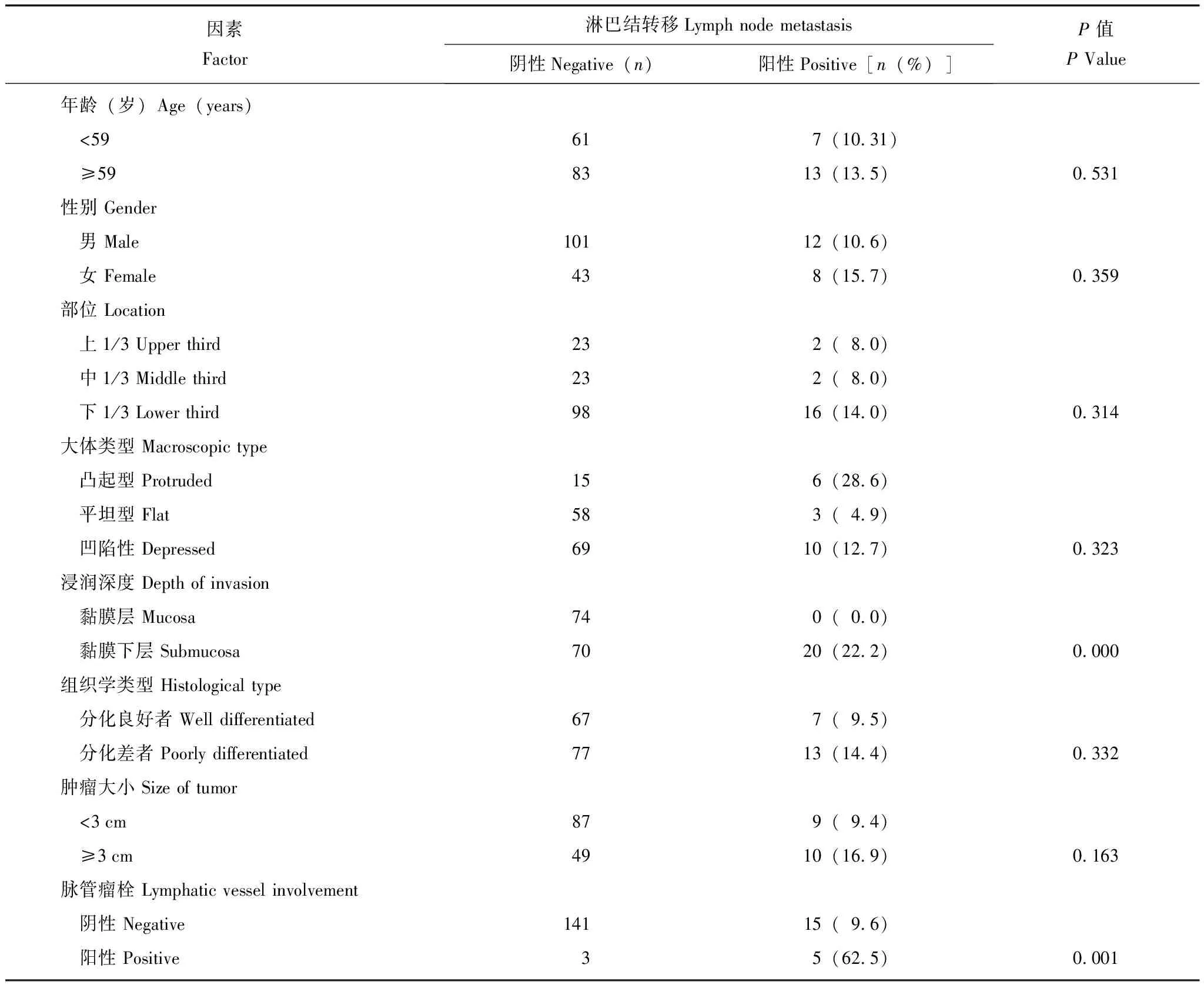
表 1 早期胃癌患者淋巴结转移危险因素的单因素分析
讨 论
目前我国胃癌治疗效果不好的一个重要原因是胃癌患者就诊往往较晚,大多数手术患者均是进展期、较晚的肿瘤。虽然在经济发达地区通过较广泛的胃癌筛查,使一些医院早期胃癌手术比例已能达到接近30%,但仍不令人满意[1]。本组早期胃癌占同期全部胃癌手术病例的比例仅为9.04%。通过广泛普查提高早期胃癌的诊治比例,在目前条件下尚难完成。放宽消化道造影和/或胃镜的检查指征,提高门诊机会性筛查的覆盖率,加强对高危人群的筛查等方法,可能是目前较实际、有效的途径[2-4]。日本早期胃癌患者中有47.6%无症状,31.2%有不确定的消化道症状,仅17.9%有消化性溃疡样症状,但国内91.3%的早期胃癌患者是因为不确定消化道症状而就诊,仅2.72%为无症状患者[2]。本组患者的情况与后者非常类似,85.54%(142/166)的患者有不典型消化道症状,仅5.42%(9/166)无症状而经查体发现;此外,本组中有46例(27.71%)属胃癌发病的高危人群,有胃溃疡或慢性胃炎史和/或胃食管癌症家族史。以上数据提示,对于高危人群、有不典型消化道症状的患者,应该进行更积极的胃癌筛查。
虽然大便潜血检查、CEA等肿瘤标志物的检查方便,可以作为筛查的手段,但其阳性率低,本组仅为12%~13%,因此早期胃癌的筛查仍应以影像检查为主。本组仅64例行上消化道双对比造影检查,但89.06%的阳性发现率表明,该方法对于筛查早期胃癌是有效、实用的。有研究显示,在筛查早期胃癌时气钡双重造影和常规纤维胃镜同样有效[5]。胃镜检查是筛查早期胃癌的主要手段,同时是确诊胃癌的根本方法,但会给患者带来一定痛苦,而且仍有一定的漏诊率,其胃癌漏诊率约为20%~30%[4]。本组有多个患者行多次胃镜检查后确诊,总确诊率为90.71%(166/183)。因此,在早期胃癌的筛查、诊断中,应充分运用上消化道双对比造影和胃镜检查两种手段。
本组病例5年生存率为87.9%,有无淋巴结转移者的生存率差别显著,分别为89.7%和70.0%,低于文献报道的90%以上的生存率[6-7]。分析其原因,考虑可能与本组黏膜下癌病例多、手术范围不足有关。研究显示,早期胃癌总体5年生存率约为90%~95%[6-8];总体转移率约为5.7%~10.38%[8-10];转移者5年生存率约为85%~90%,比无转移的病例差[6,9]。但是术前,甚至术中直接判断淋巴结有无转移很困难。虽然报道显示肿瘤大小、浸润深度、脉管受累等指标均与淋巴结转移相关,但有实用价值、与淋巴结转移相关的指标是肿瘤浸润深度和大小[8-9,11-12],这两个因素均可在术前进行较好地评测。当肿瘤浸润至黏膜下层时,淋巴结转移率为11.1%~24%,明显高于黏膜内癌的1.2%~5%[9-10,13]。此类患者5年生存率低于早期胃癌的总体水平,仅为87.6%[6]。因此,肿瘤的浸润深度常常是决定治疗的重要依据。本组资料也显示,肿瘤浸润至黏膜下层与淋巴结转移相关,此时淋巴结转移率达21.98%。本组黏膜下层肿瘤有91例,占54.82%,高于国内外多个研究的水平[6-7,9-10,13]。对于黏膜下层肿瘤多采用D1+或D2手术[14-15],但本组124例(74.70%)患者采用了D1手术,仅不到25%的患者做了D1+以上的手术,这也应该是影响最终疗效的原因之一。此外,在行手术治疗的病例中,术中病变定位亦是一个值得重视的问题。本组中有68例(40.96%)术中未发现或触及可疑病变,因此有30例切开胃壁定位、2例胃镜定位病灶,这样避免了病变漏切或切缘不足。可见,对于早期胃癌术前胃镜仔细检查、描述病变位置等情况非常重要,必要时需通过术中胃镜等手段定位病变,以保证手术疗效。
虽然早期胃癌的总体疗效较好,但应根据早期胃癌的具体分期采取适当的治疗方式。因此早期胃癌的术前分期判断愈显重要,尤其是对肿瘤浸润深度的判断。目前术前分期主要通过CT和EUS进行,其对肿瘤浸润深度判断的准确性分别为86.4%和90.1%[16]。本组患者术前分期检查不充分,仅不到25%(39例)的病例行CT检查,约5%(9例)病例行EUS检查。这是早期胃癌总体诊治水平的差距之一,急需提高改善。近年来,早期胃癌的内镜下治疗已日益成熟,得到越来越多的接受和认可,并有了较清晰的治疗指南[14-15],黏膜内癌是其主要的治疗对象。当术前分期检查提示肿瘤局限在黏膜内癌时,内镜下治疗是一个较好的治疗选择。
综上,重视、提高早期胃癌的诊断、治疗水平将会有助于最终改善胃癌的疗效。对高危人群、有不典型消化道症状的患者进行积极地消化道造影、胃镜检查是临床中可行的、有效提高早期胃癌诊治比例的方法;积极完善包括CT、EUS在内的术前胃癌分期评价检查,可以为治疗方法的选择提供可靠依据;针对不同分期的早期胃癌采取规范的手术或内镜下治疗是保证疗效的重要因素。
[1] 吴云林, 吴巍, 朱延波, 等. 2007年上海市13家医院早期胃癌手术率报告[J]. 胃肠病学和肝病学杂志, 2009, 1(2):106-109.
[2] 吴云林. 早期胃癌临床筛选的现状和进展[J]. 上海交通大学学报:医学版, 2007, 27(5):485-487.
[3] 王江红, 项颖. 早期胃癌的筛查现状及诊断进展[J]. 重庆医学, 2009, 38(20):2634-2636.
[4] 吴云林. 提高早期胃癌诊断水平的几项关键点[J]. 胃肠病学和肝病学杂志, 2008, 17(3):571-572.
[5] Shaw PC, van Romunde LK, Griffioen G, et al. Peptic ulcer and gastric carcinoma: diagnosis with biphasic radiography compared with fiberoptic endoscopy[J]. Radiology, 1987, 163(1):39-42.
[6] Japanese Gastric Cancer Association Registration Committee, Maruyama K, Kaminishi M, et al. Gastric cancer treated in 1991 in Japan: data analysis of nationwide registry[J]. Gastric Cancer, 2006(9):51-66.
[7] 冯润华, 朱正纲, 燕敏, 等.早期胃癌临床病理特征与预后因素的分析[J]. 外科理论与实践, 2007, 12(1):54-57.
[8] Kunisaki C, Akiyama H, Nomura M, et al. Significance of long-term follow-up of early gastric cancer[J]. Ann Surg Oncol, 2006, 13(3):363-369.
[9] Nakamura K, Morisaki T, Sugitani A, et al. An early gastric carcinoma treatment strategy based on analysis of lymph node metastasis[J]. Cancer, 1999, 85(7):1500-1505.
[10] Shimoyama S, Seto Y, Yasuda H, et al. Concepts, rationale, and current outcomes of less invasive surgical strategies for early gastric cancer: data from a quarter-century of experience in a single institution[J]. World J Surg, 2005, 29(1):58-65.
[11] Yasuda K, Shiraishi N, Suematsu T, et al. Rate of detection of lymph node metastasis is correlated with the depth of submucosal invasion in early stage gastric carcinoma[J]. Cancer, 1999, 85(10):2119-2123.
[12] Shimoyama S, Yasuda H, Mafune K, et al. Indications of a minimized scope of lymphadenectomy for submucosal gastric cancer[J]. Ann Surg Oncol, 2002, 9(7):625-631.
[13] Nasu J, Nishina T, Hirasaki S, et al. Predictive factors of lymph node metastasis in patients with undifferentiated early gastric cancers[J]. J Clin Gastroenterol, 2006, 40(5):412-415.
[14] Gotoda T, Yamamoto H, Soetikno RM. Endoscopic submucosal dissection of early gastric cancer[J]. J Gastroenterol, 2006, 41(10):929-942.
[15] Nomura S, Kaminishi M. Surgical treatment of early gastric cancer[J]. Dig Surg, 2007, 24(2):96-100.
[16] Ahn HS, Lee HJ, Yoo MW, et al. Diagnostic accuracy of T and N stages with endoscopy, stomach protocol CT, and endoscopic ultrasonography in early gastric cancer[J]. J Surg Oncol, 2009, 99(1):20-27.
DiagnosisandTreatmentof166PatientswithEarlyGastricCancer
LI Xiao-yi1,WANG Chang-jun1,ZHONG Ding-rong2,GAO Wei-sheng1,LIU Hong-feng1
1Department of General Surgery,2Department of Pathology, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
LIU Hong-feng Tel: 010-65296024, E-mail: liuhongf@sina.com
ObjectiveTo summarize our experiences in the diagnosis and treatment of early gastric cancer (EGC).MethodsThe clinicopathological data of the 166 EGC inpatients who were treated in our hospital from January 1999 to January 2009 were retrospectively analyzed and their treatment outcomes were followed up.ResultsSurgical treatment for ECG accounted for 9.04% (176/1946) among all the surgeries performed for gastric cancers. Among the analyzed 166 cases, 9 asymptomatic patients were diagnosed by routine examination, 29 (17.47%) had a history of gastric ulcer or chronic gastritis, and 20 (12.05%) had a family history of esophageal or gastric cancer. Of 64 patients who

early gastric cancer; diagnosis; treatment
ActaAcadMedSin, 2011,33(3):325-329
刘洪沨 电话:010-65296024,电子邮件: liuhongf@sina.com
R656.6;R735.2
A
1000-503X(2011)03-0325-05
10.3881/j.issn.1000-503X.2011.03.022
2010-05-07)
