腹腔镜下Roux-en-Y胃旁路术在非病态肥胖患者2型糖尿病治疗中的应用价值
2011-11-23黄致锟
黄致锟
台湾义大医院国际减重及糖尿病手术中心 国际微创手术训练中心 台湾减重支持教育协会,台湾高雄 824
·减重、糖尿病手术及综合治疗论坛论著·
腹腔镜下Roux-en-Y胃旁路术在非病态肥胖患者2型糖尿病治疗中的应用价值
黄致锟
台湾义大医院国际减重及糖尿病手术中心 国际微创手术训练中心 台湾减重支持教育协会,台湾高雄 824
目的探讨腹腔镜下Roux-en-Y胃旁路术(LRYGB)在非病态肥胖患者2型糖尿病治疗中的应用价值。方法以22例体重指数(BMI)介于25~35 kg/m2间的非病态肥胖2型糖尿病患者为研究对象,行LRYGB,观察手术前后BMI、空腹血糖和糖化血红蛋白的变化情况,分析与手术预后相关的因素。结果22例患者均成功接受LRYGB,并完成术后12个月的随访。2例(9.1%)患者术后出现并发症,其中1例早期出现胃空肠吻合口出血,1例因发生腹泻需要重建肠绕道长度。术后第12个月,14例(63.6%)患者达到糖尿病治愈,6例(27.3%)血糖得到控制,2例(9.1%)血糖得到改善。与血糖控制或改善组患者相比,糖尿病治愈组患者手术前的BMI较高(P=0.001)、年龄较轻(P=0.002)、糖尿病病程较短(P=0.001)。结论LRYGB可安全有效地治疗非病态肥胖2型糖尿病患者,此类患者早期行LRYGB干预可能效果更佳。
腹腔镜下Roux-en-Y胃旁路术;2型糖尿病;非病态肥胖
糖尿病是慢性进展性疾病,也是一种常见的内分泌疾病,根据世界卫生组织的统计,到2025年,全世界糖尿病患病人数将达到3.34亿[1]。2型糖尿病的内科治疗方法主要包括:饮食、运动和抗糖尿病药物治疗。然而不断有证据显示,外科手术可完全治愈2型糖尿病,特别是病态肥胖的2型糖尿病患者[2]。目前,包括腹腔镜下Roux-en-Y胃旁路术(laparoscopic Roux-en-Y gastric bypass, LRYGB)在内的减重手术在缓解2型糖尿病方面的疗效已经得到证实[3-5]。但很少有证据证明LRYGB治疗较低体重指数(body mass index,BMI)的2型糖尿病患者的效果[6]。本研究评估了LRYGB在非病态肥胖患者2型糖尿病治疗中的应用价值,以期为今后的临床应用提供帮助。
对象和方法
对象2008年12月至2010年1月在台湾义大医院接受LRYGB的非病态肥胖2型糖尿病患者22例,其中,男2例,女20例,平均年龄(47.4±11.2)岁(28~63岁);平均BMI(30.8±3.2)kg/m2(25.0~34.8 kg/m2),其中10例(45.5%)25.0 kg/m2≤BMI﹤30.0 kg/m2,12例(54.5%)30.0 kg/m2≤BMI﹤35.0 kg/m2;平均患病时间为(6.57±6.34)年(1~20年)。2型糖尿病诊断参照美国糖尿病协会(American Diabetes Association,ADA)制订的标准或被内分泌专家或糖尿病专家认定有效[7]。入选标准:(1)年龄18~65岁;(2)25.0 kg/m2≤BMI﹤35.0 kg/m2;(3)糖化血红蛋白(glycosylated hemoglobin,HbAlc)≥7%。排除标准:(1)年龄﹤18岁或﹥65岁;(2)计划在2年内怀孕;(3)消化道炎性疾病患者;(4)恶性肿瘤患者;(5)未解决的精神疾病或者滥用药物者。22例患者中,16例(72.7%)有2型糖尿病家族史;15例(68.2%)术前服用口服降糖药,1例(4.5%)需要胰岛素治疗,3例(13.6%)同时使用胰岛素和口服降糖药,3例(13.6%)无原因中止服用药物;15例(68.2%)有多种合并症;14例(63.6%)有高脂血症,13例(59.1%)有高血压,10例(45.5%)有脂肪肝,2例(9.1%)有痛风性关节炎。本研究经台湾义大医院伦理委员会批准(EMRP-097-106),所有患者在了解2型糖尿病现有治疗规程和术中、术后的风险、益处后签署了知情同意书。
术前准备所有患者术前必须接受专业的多学科医疗团队评估,包括:外科医师、内分泌医师、麻醉医师、营养师及其他与糖尿病并发症相关的内科疾病专家。除进行具体的糖尿病指标检查外,还要进行常规的术前检查和心理测量与辅导。
手术方法参照文献[8]的方法(图1),其中小胃囊的容量只保留30 ml, 胆胰肢(bilio-pancreatic limb)与消化肢(alimentary limb)各绕道100 cm长度。
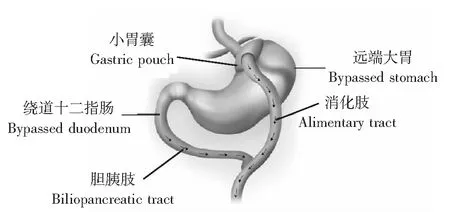
图 1 腹腔镜下Roux-en-Y胃旁路术手术图解Fig 1 Surgical method of laparoscopic Roux-en-Y gastric bypass
数据收集
术前:(1)BMI;(2)合并症;(3)罹患糖尿病的具体细节,包括:疾病持续时间、家族史和药物使用情况;(4)空腹血糖(fasting blood glucose,FBG);(5)HbAlc。
手术细节:手术时间、住院时间及至下次随访前的并发症。
术后:于术后1周,1、3、6、9、12个月进行随访,记录患者的FBG、HbAlc、BMI和药物使用情况。
疗效判定参照ADA制定的标准:(1)治愈:患者没有服用抗糖尿病药物,FBG <5.55 mmol/L(100 mg/dl),HbAlc<6%;(2)血糖得到控制:没有服用抗糖尿病药物且HbAlc≤7%;(3)改善:FBG降低幅度大于1.39 mmol/L(25 mg/dl),HbAlc降低幅度大于1%;(4)失败:血糖指数没有明显改善或者加重,患者使用的抗糖尿病药物剂量增加[9]。
统计学处理采用SPSS 15.0统计软件,计量资料以均数±标准差表示,计数资料以百分率表示;计量资料组内不同时间的比较采用配对t检验,组间比较采用独立样本t检验;计数资料组间比较采用Fisher’s 确切检验;P<0.05为差异有统计学意义。
结 果
手术情况所有患者均成功接受LRYGB,平均手术时间(72.8±18.2)min(45~134min),平均住院时间(2.41±0.73)d(2~4d)。22例患者中,无1例死亡。2例(9.1%)出现并发症,其中1例早期发生胃肠吻合口出血,以胃镜成功治愈;1例出现频繁稀便,行二次腹腔镜手术重建肠绕道长度予以纠正。
BMI、FBG和HbAlc的变化情况所有患者均完成术后12个月的随访,术后6、9、12个月的BMI(P均<0.001)、FBG(P均=0.001)和HbAlc水平(P均<0.001)均较术前明显降低(表1)。
预后及相关因素分析22例患者中,有7例(31.8%)在术后1个月内FBG恢复正常,14例(63.6%)术后6个月内HbAlc恢复正常。术后第12个月,14例(63.6%)患者的2型糖尿病治愈,6例(27.3%)患者的血糖得到控制,2例(9.1%)患者的血糖得到改善。20例(90.9%)患者不再需要服用药物;2例(9.1%)仍需口服降糖药物, 这两例患者术前均需口服降糖药和胰岛素并用。与血糖控制或改善组患者相比,糖尿病治愈组患者手术前的BMI较高(P=0.001)、年龄较轻(P=0.002)、糖尿病病程较短(P=0.001)(表2)。
讨 论
糖尿病是由于胰岛素分泌或(和)作用缺陷导致的以高血糖为特征的一组慢性进展性代谢性疾病[10]。在糖尿病的临床类型中,2型糖尿病是最普遍的一种。2型糖尿病内科治疗的主要目的是控制血糖以降低并发症,而外科手术则有望使血糖达到永久正常[11]。 Buchwald等[5]总结了3188例病态肥胖患者的手术效果,结果显示:95.1%的患者在行胆胰旷置术后,80.3%的患者在行LRYGB后,56.7%的患者在行腹腔镜下可调节胃束带术后糖尿病得到缓解。目前的研究则开始集中对在1991年美国国立卫生研究院指南(BMI<35 kg/m2) 范围之外患者进行手术的作用[12]。
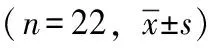
表 1 BMI、FBG和HbAlc的变化情况
BMI:体重指数;FBG:空腹血糖;HbAlc:糖化血红蛋白;与术前比较,aP<0.001,bP=0.001
BMI: body mass index;FBG:fasting blood glucose;HbAlc:glycosylated hemoglobin;aP<0.001,bP=0.001 compared with pre-operative levels
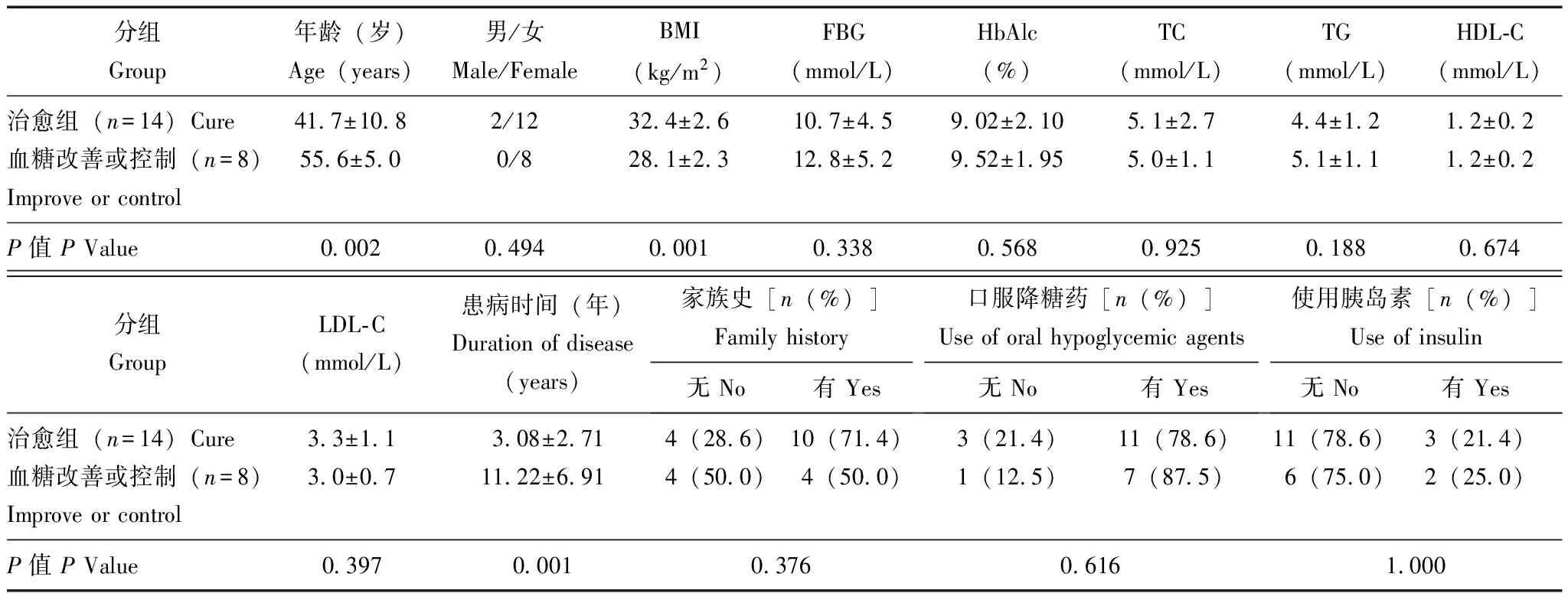
表 2 预后相关因素分析
TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇
TC:total cholesterol;TG:triglyceride;HDL-C:high density lipoprotein cholesterol;LDL-C:low density lipoprotein cholesterol
自从1955年Friedman等[13]首次报道胃次全切除可改善糖尿病后,已有大量研究证实手术对糖尿病的治疗效果[13-18]。尽管术后糖尿病得到治愈的确切机制尚不十分清楚,但是以已了解机制为基础的各项创新性手术,如:十二指肠空肠旁路术、袖状胃切除合并回肠间置术已试用于临床[19-22]。已提出的机制包括:手术后造成饮食摄取减少、体重下降、脂肪组织减少;十二指肠隔绝与绕道,肠胃改道引起的肠胃激素水平变化;吸收不良。因此,本研究选择术式的标准是可以影响并改善上述机制,如胃或胆胰旁路手术。目前LRYGB治疗病态肥胖患者2型糖尿病的效果已经得到肯定[23],笔者所在的团队也已采用LRYGB治疗了500多例患者,无1例死亡发生,且近来研究也证实该术式极具可行性[16,24-25],故本研究选择采用LRYGB治疗非病态肥胖2型糖尿病患者,结果显示:所有患者均成功接受了手术,无1例患者死亡,仅2例(9.1%)患者出现并发症,与Lee等[26](6.2%的患者出现较小的并发症,2.2%的患者出现较大的并发症)和 Fried 等[27](并发症发生率为10.3%)的研究结果类似。虽然这些并发症都容易处理并有因可循,但笔者建议在患者选择过程中应谨慎考虑与评估2型糖尿病本身的并发症。
有研究认为,在病态肥胖患者减重手术后由于胰岛素耐性改变,FBG在数天内会恢复正常[28]。本研究显示,患者术后FBG虽然有所改善,但并未马上恢复到正常,FBG和HbAlc水平随着时间推移逐渐减低,2例患者在术后1周、7例在术后1个月、14例在术后6个月恢复正常。此外本研究还发现,那些在术后6个月仍未能治愈的患者在术后12个月同样没有治愈,且此类患者在术后6个月体重就接近稳定,提示胰岛素抵抗消失后,胰岛功能在某些患者并未完全改善,推测这些患者除了胰岛素抵抗之外,可能还存在胰岛素缺乏。
Lee等[26]研究显示,76.5% BMI<35 kg/m2的患者在术后1年可达到2型糖尿病治疗的ADA目标。Hall等[29]报道68.4%的患者在LRYGB术后停止使用所有治疗糖尿病的药物。本研究22例患者中,术后只有2例还在使用低剂量口服降糖药,没有患者使用胰岛素,治愈率和血糖控制率达到90.9%。
对预后及相关因素的分析发现,手术前BMI较低、年龄较大、糖尿病持续时间较长的患者在术后12个月治愈的可能性较小,与Hall等[29]研究结果类似,提示对较肥胖的糖尿病患者,应尽早进行手术干预,但对体重较轻的患者,尚需更多资料来证明手术是否有效。
综上,本研究结果显示,对BMI介于25~35 kg/m2之间的患者实施LRYGB是安全可行的,且早期并发症发生率较低。年龄、BMI和2型糖尿病的持续时间与预后有关,BMI较高的患者早期行LRYGB干预可能效果更佳。
[1] Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27(5):1047-1053.
[2] Buchwald H, Avidor Y, Braunwald E, et al. Bariatric surgery: a systematic review and meta-analysis[J]. JAMA, 2004, 292(14):1724-1737.
[3] Buchwald H, Oien DM. Metabolic/bariatric surgery Worldwide 2008[J]. Obes Surg, 2009, 19(12):1605-1611.
[4] Brancatisano A, Wahlroos S, Brancatisano R. Improvement in comorbid illness after placement of the Swedish adjustable gastric band[J]. Surg Obes Relat Dis, 2008, 4(3 Suppl):S39-S46.
[5] Buchwald H, Estok R, Fahrbach K, et al. Weight and type 2 diabetes after bariatric surgery: systematic review and meta-analysis[J]. Am J Med, 2009, 122(3):248-256.e5.
[6] Hussain A, Mahmood H, El-Hasani S. Can Roux-en-Y gastric bypass provide a lifelong solution for diabetes mellitus[J]. Can J Surg, 2009, 52(6):E269-E275.
[7] Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the expert committee on the diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2003, 26 Suppl 1: S5-S20.
[8] Huang CK, Lee YC, Hung CM, et al. Laparoscopic Roux-en-Y gastric bypass for morbidly obese Chinese patients: learning curve, advocacy and complications[J]. Obes Surg, 2008, 18(7):776-781.
[9] American Diabetes Association. Standards of medical care in diabetes-2006[J]. Diabetes Care, 2006, 29 Suppl 1:S4-S42.
[10] Lee WJ, Wang W. Bariatric surgery: Asia-Pacific perspective[J]. Obes Surg, 2005, 15(6):751-757.
[11] American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2010, 33 Suppl 1:S62-S69.
[12] Rubino F, Schauer PR, Kaplan LM, et al. Metabolic surgery to treat type 2 diabetes: clinical outcomes and mechanism of action[J]. Annu Rev Med, 2010, 61:393-411.
[13] Friedman MN, Sancetta AJ, Magovern GJ. The amelioration of diabetes mellitus following subtotal gastrectomy[J]. Surg Gynecol Obstet, 1955, 100(2):201-204.
[14] Gastrointestinal Surgery for Severe Obesity[J]. Consens Statement, 1991, 9(1):1-20.
[15] Pories WJ, Swanson MS, MacDonald KG, et al. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus[J]. Ann Surg, 1995, 222(3):339-352.
[16] Rubino F, Kaplan LM, Schauer PR, et al. The Diabetes Surgery Summit consensus conference:recommendations for the evaluation and use of gastrointestinal surgery to treat type 2 diabetes mellitus[J]. Ann Surg, 2010, 251(3):399-405.
[17] Shah SS, Todkar JS, Shah PS, et al. Diabetes remission and reduced cardiovascular risk after gastric bypass in Asian Indians with body mass index < 35kg/m2[J]. Surg Obes Relat Dis, 2010, 6(4):332-338.
[18] Parikh M, Duncombe J, Fielding GA. Laparoscopic adjustable gastric banding for patients with body mass index of [19] Scopinaro N, Papadia F, Marinari G, et al. Long-term control of type 2 diabetes mellitus and the other major components of the metabolic syndrome after biliopancreatic diversion in patients with BMI<35 kg/m2[J]. Obes Surg, 2007, 17(2):185-192. [20] Rubino F, Forgione A, Cummings DE, et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals role of the proximal small intestine in the pathophysiology of type 2 diabetes[J]. Ann Surg, 2006, 244(5):741-749. [21] Cohen RV, Schiavon CA, Pinheiro JS, et al. Duodenal-jejunal bypass for the treatment of type 2 diabetes in patients with body mass index of 22-34 kg/m2: a report of 2 cases[J]. Surg Obes Relat Dis, 2007, 3(2):195-197. [22] DePaula AL, Macedo AL, Mota BR, et al. Laparoscopic ileal interposition associated to a diverted sleeve gastrectomy is an effective operation for the treatment of type 2 diabetes mellitus patients with BMI 21-29[J]. Surg Endosc, 2009, 23(6):1313-1320. [23] DePaula AL, Macedo AL, Schraibman V, et al. Hormonal evaluation following laparoscopic treatment of type 2 diabetes mellitus patients with BMI 20-34[J]. Surg Endosc, 2009, 23(8):1724-1732. [24] Schauer PR, Burguera B, Ikramuddin S, et al. Effect of laparoscopic Roux-en-Y gastric bypass on type 2 diabetes mellitus[J]. Ann Surg, 2003, 238(4):467-485. [25] Cohen R, Pinheiro JS, Correa JL, et al. Laparoscopic Roux-en-Y gastric bypass for BMI < 35 kg/m2: a tailored approach[J]. Surg Obes Relat Dis, 2006, 2(3):401-404. [26] Lee WJ, Wang W, Lee YC, et al. Effect of laparoscopic minigastric bypass for type 2 diabetes mellitus: comparison of BMI > 35 and <35 kg/m2[J]. J Gastrointest Surg, 2008, 12(5):945-952. [27] Fried M, Ribaric G, Buchwald JN, et al. Metabolic surgery for the treatment of type 2 diabetes in patients with BMI < 35kg/m2: an integrative review of early studies[J]. Obes Surg, 2010, 20(6):776-790. [28] Pournaras DJ, Osborne A, Hawkins SC, et al. Remission of type 2 diabetes after gastric bypass and banding: mechanisms and 2 year outcomes[J]. Ann Surg, 2010, 252(6):966-971. [29] Hall TC, Pellen MG, Sedman PC, et al. Preoperative factors predicting remission of type 2 diabetes mellitus after Roux-en-Y gastric bypass surgery for obesity[J]. Obes Surg, 2010, 20(9):1245-1250. EffectivenessandSafetyofLaparoscopicRoux-en-YGastricBypassinTreatingType2DiabetesMellitusinNon-morbidlyObesePatients HUANG Chih-kun Bariatric & Metabolic International Surgery Center, International Minimally Invasive Surgery Training Center, ObjectiveTo evaluate the effectiveness of laparoscopic Roux-en-Y gastric bypass (LRYGB) for achieving type 2 diabetes mellitus (T2DM) remission in patients with body mass index (BMI) in the range of 25-35 kg/m2.MethodsTwenty-two non-morbidly obese (BMI: 25-35 kg/m2) patients with T2DM underwent LRYGB. The changes of BMI, fasting plasma glucose (FPG), and glycosylated hemoglobin (HbA1c) levels were recorded, and the prognostic factors were analyzed.ResultsAll these 22 patients successfully underwent LRYGB and were followed up for twelve months. Two patients (9.1%) developed complications: one patient had an early hemorrhage at the gastrojejunostomy site, and the other had frequent loose stools that required revision surgery. At 12 months, 14 patients (63.6%) showed T2DM remission, 6 (27.3%) showed glycemic control, and 2(9.1%) showed improvement. Compared with the latter two groups, patients in the T2DM remission group had significantly higher BMI (P=0.001), younger age (P=0.002), and shorter duration of diabetes (P=0.001) before operation.ConclusionsLYRGB can efficiently and safely treat T2DM in non-morbidly obese patients. Early intervention in these patients may yield better outcomes. laparoscopic Roux-en-Y gastric bypass; type 2 diabetes mellitus; non-morbid obesity ActaAcadMedSin, 2011,33(3):272-276 电子邮件:dr.ckhuang@hotmail.com R578.1;R656.6+1 A 1000-503X(2011)03-0272-05 10.3881/j.issn.1000-503X.2011.03.013 E-mail: dr.ckhuang@hotmail.com 2011-04-19)
E-Da Hospital, Taiwan Obesity Support Association, Kaohsiung County, Taiwan 824, China
