胰岛素样生长因子结合蛋白-3与甲状腺激素受体α1的相互作用及其对甲状腺激素应答性基因转录的调节
2011-11-23马晓骊黄秉仁
裘 佳,马晓骊,王 欣,陈 虹,黄秉仁
中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室, 北京 100005
·论著·
胰岛素样生长因子结合蛋白-3与甲状腺激素受体α1的相互作用及其对甲状腺激素应答性基因转录的调节
裘 佳,马晓骊,王 欣,陈 虹,黄秉仁
中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室, 北京 100005
目的探讨胰岛素样生长因子结合蛋白-3(IGFBP-3)与甲状腺激素受体α1(TRα1)之间的相互作用,及其对甲状腺激素应答性基因转录作用的调节。方法采用谷胱甘肽-S-转移酶拉下实验、免疫共沉淀以及荧光共振能量转移实验检测IGFBP-3与TRα1之间的相互作用;激光共聚焦显微镜观察两种蛋白在细胞中的分布;采用双萤光素酶实验检测过表达IGFBP-3对甲状腺素T3激活的生长激素启动子的影响。结果谷胱甘肽-S-转移酶拉下实验、免疫共沉淀以及荧光共振能量转移实验结果证明IGFBP-3与TRα1在体内和体外都可以相互作用,激光共聚焦显微镜观察IGFBP-3 和 TRα1可以共定位于HEK-293细胞的细胞核。通过双萤光素酶实验检测到过表达IGFBP-3可以抑制甲状腺激素对生长激素启动子的激活作用(P<0.01)。结论IGFBP-3通过与TRα1相互作用抑制甲状腺激素应答性基因的转录,为IGFBP-3在核内发挥胰岛素样生长因子非依赖的作用提供了新的实验依据。
胰岛素样生长因子结合蛋白-3;甲状腺激素受体α1;三碘甲状腺原氨酸;生长激素启动子
胰岛素样生长因子结合蛋白(insulin-like growth factor binding proteins, IGFBPs)家族在循环系统中结合胰岛素样生长因子(insulin-like growth factor,IGF),并被输送到靶细胞处发挥生物活性[1]。IGFPB-3是该家族成员,具有抗增殖、促进细胞迁移、促进细胞凋亡等作用[2-3]。但是这些作用产生的机制尚未完全清楚。有研究显示IGFBP-3不仅可以通过IGFBP-3受体激活半胱氨酸蛋白酶8(caspase-8) 促进细胞凋亡[4],IGFBP-3还具有核定位序列,可以直接介导IGFBP-3入核,并在细胞核内发挥非IGF-I依赖的作用[5]。有研究显示IGFBP-3和类维甲酸受体α (retinoid X receptor α,RXRα)共定位于前列腺癌细胞株LAPC-4的细胞核。IGFBP-3可以直接和RXRα相互作用, RXRα参与IGFBP-3引起细胞凋亡[6-7]。另有研究显示IGFBP-3引起PC-3细胞凋亡的作用不需要结合RXRα[8]。IGFBP-3结合RXRα抑制全反式维甲酸引起的维甲酸应答元件的转录激活,并且调节人乳腺癌细胞对全反式维甲酸的反应[9]。IGFBP-3还可以与 过氧化物酶体增殖物激活受体γ相互作用,阻止配体引起的过氧化物酶体增殖物激活受体反应元件在3T3-L1脂肪细胞中的激活,并且IGFBP-3抑制该脂肪细胞分化[10]。
鉴于既往对具有入核性质的IGFBP-3与上述核受体信号传导相关性的研究,笔者推测IGFBP-3可能还与其他类固醇激素信号传导有关,如甲状腺激素受体(thyroid hormone receptor,TR)这个基因转录调控中的重要调节蛋白。而受体相关的共调节蛋白,如共激活子和共抑制子的参与能分别增强或抑制转录。在甲状腺激素存在情况下,TR构象改变,共抑制子被共激活子取代,从而启动了TR调节的基因转录激活[11]。本研究拟通过蛋白质相互作用实验和双萤光素酶实验确认IGFBP-3在三碘甲状腺原氨酸(3, 3’,5-triiodo-L-thyronine,T3)-TR信号传导中的作用,为深入研究IGFBP-3在核内发挥的非IGF依赖的作用提供实验依据。
材料和方法
材料pCMV-Myc-TRα1、pEYFP-N1-TRα1和pECFP-N1-IGFBP-3质粒已构建。pGL3-GH 启动子质粒由美国梅奥医学中心医学系/内分泌科 Norman Eberhardt 教授惠赠。E.coliDH5α和E.coliBL21菌株均为本室保存。人肾上皮细胞系HEK-293由本室保存。T3购自Sigma公司。细胞培养基DMEM购自Gibco公司。引物由上海生工生物技术有限公司合成。抗体购自Santa Cruz公司、Sigma公司及北京中杉金桥生物技术公司。Glutathione SepharoseTM4B和 protein G SepharoseTM4 Fast Flow均购自GE公司。Western blot化学发光试剂购自PIERCE公司。Dual-luciferase®Reporter Assay System购自Promega公司。
细胞培养HEK-293细胞接种于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM(高糖)完全培养基中,在5% CO2,37℃细胞培养箱内培养。
重组载体的构建以人肝cDNA文库为模板,构建pGEX-6p-1-TRα1质粒,以上游引物5’CGCGGAT- CCATGGAACAGAAGCCAAGCAA3’(下划线为限制性内切酶BamHⅠ的识别位点)及下游引物5’CCCAA- GCTTTTTGGCAAAGTCCACCACA3’(下划线为限制性内切酶HindⅢ的识别位点)扩增出TRα1上半段基因片段,以上游引物5’CCCAAGCTTCCCATGTTCTCC- GAGCTGC3’(下划线为限制性内切酶HindⅡ的识别位点)及下游引物5’ACGCGTCGACTTAGACTTCCT- GATCCTCAAAGAC3’(下划线为限制性内切酶SalⅠ的识别位点)扩增出TRα1下半段基因片段,先分别克隆入pGEM-T 载体,再各自双酶切(BamHⅠ、HindⅢ或HindⅢ、SalⅠ)有关重组质粒,将TRα1上、下片段和pGEX-6P-1载体进行3片段连接、构建出pGEX-6p-1-TRα1。构建pCMV-HA-IGFBP-3质粒时,上游引物5’GAAGATCTTGATGCAGCGGGCG3’(下划线为限制性内切酶BglⅡ的识别位点)及下游引物5’ATAGTTTAGCGGCCGCCTACTTGCTCTGCATG- CTGT3’(下划线为限制性内切酶NotⅠ的识别位点)扩增出IGFBP-3全长基因片段,经BglⅡ、NotⅠ双酶切后和pCMV-Myc载体连接。
谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)拉下实验将GST及其GST融合蛋白表达菌在异丙基硫代半乳糖苷1 mmol/L及室温下诱导,菌体加入细菌裂解液,超声破菌。取20 μl 75% Glutathione SepharoseTM4B,加入1 ml上述原核表达蛋白上清,4℃温育4 h。2000 r/min离心5 min,弃上清。PBS洗3遍。在表达另一外源基因如IGFBP-6的真核细胞裂解液中加入平衡过的Glutathione SepharoseTM4B介质,4℃转动温育2 h预清除。4℃,2000 r/min 离心5 min后将上清与已经纯化的GST融合蛋白、GST等分别 4℃温育过夜。离心沉淀物用细胞裂解缓冲液洗3遍,沉淀做电泳及Western印迹鉴定。
免疫共沉淀与Western印迹将转染pCMV-HA-IGFBP-3或/和pCMV-Myc-TRα1载体后24 h,再加入T3(10-7mol/L) 作用4 h的HEK-293细胞用放射免疫实验裂解液裂解,离心后蛋白定量,取100 μg蛋白进行预清除(加入30 μl 蛋白G琼脂糖凝胶温育1 h,2 000 r/min离心5 min,取上清),加入小鼠抗Myc抗体2 μg,4℃温育过夜,然后加入30 μl蛋白G琼脂糖凝胶,4℃温育4 h,2000 r/min离心5 min,用细胞裂解缓冲液洗沉淀3次,沉淀经SDS-PAGE及转膜后作常规Western印迹鉴定。
荧光共振能量转移(fluorescenceresonanceenergytransfer,FRET) 将HEK-293细胞种到含有盖玻片的6孔板中。约24 h后,实验组共转染pEYFP-N1-TRα1和pECFP-N1-IGFBP-3质粒各2.5 μg,对照组为共转染 pEYFP-N1和pECFP-N1空载体各2.5 μg,转染24 h后,加入T3 10-7mol/L 作用4 h, 弃去培养基,用PBS轻洗两遍细胞。加入4%多聚甲醛室温固定10 min,PBS洗细胞3遍,盖玻片盖在滴有防淬灭甘油(10 μl)的载玻片上,指甲油封边,室温晾干。激光显微镜下观察细胞,找到共表达的细胞后,采集图片。敏化发射光谱法FRET实验的仪器操作由北京大学医学部医药分析中心使用Leica confocal laser scanning microscope[12](Leica TCS SP5)完成。
双萤光素酶报告基因活性检测HEK-293细胞接种于24孔培养板中,每孔转染pGL3-GH-promoter质粒0.2 μg及pRL-TK对照质粒0.002 μg ,pCMV-Myc-TRα1质粒0.5 μg,pCMV-HA-IGFBP-3或其空载体0.5 μg,每组设3个平行孔。培养24 h,再加入T3(10-7mol/L)或溶剂作用24 h。弃去培养基,用冰预冷的PBS洗2次。每孔细胞加入100 μl 1×被动细胞裂解缓冲液,轻微振荡,室温15 min。取10 μl裂解产物加入1.5 ml EP管中,将10 μl萤光素酶检测试剂Ⅱ加入样本中,吹吸5次,放入发光仪中检测。再在同一个样品中加入Stop & Glo®试剂10 μl。TD-20/20发光测试仪检测每孔的萤火虫荧光素酶的测量值F和海肾荧光素酶的测量值R(作为内参),然后计算F/R。
统计学处理数据以均数±标准差表示。采用SPSS 11.0软件分析,组间均数比较采用t检验,P<0.05为差异具有统计学意义。
结 果
GST拉下实验证明TRα1与IGFBP-3的相互作用及作用结构域
原核表达重组质粒pGEX-6P-1-TRα1和真核表达重组质粒pCMV-HA-IGFBP-3的构建和鉴定:TRα1全长为1233 bp,分两次扩增出全长顺序前后两部分及其克隆(图1A、B)。3片段连接后获得的全长TRα1阳性克隆经BamHⅠ/SalⅠ酶切鉴定见图1C中箭头所示,测序结果读码框和序列均正确。IGFBP-3全长875 bp,扩增片段见图2A,所获得的阳性重组克隆经BglⅡ和NotⅠ酶切鉴定为阳性,图2B中箭头所示为酶切下的IGFBP-3片段,测序结果读码框和序列均正确。
GST拉下实验证实TRα1和IGFBP-3能在体外结合:图3A为考马斯亮蓝染色检测纯化的GST和GST-TRα1(相对分子质量约72 000)。图3C可见GST-TRα1(条带7)免疫复合物泳道中有一条相对分子质量为36 000的特异性条带,其Western结果与被转染的HEK-293细胞裂解液直接上样的HA-IGFBP-3(条带8)一致,而在GST(条带6)泳道中,则无任何条带,该结果说明只有TRα1与IGFBP-3在体外能进行特异性结合。
GST拉下实验证实TRα1的DNA结合区( DNA binding domain,DBD)、配体结合区(ligand binding domain,LBD )能与IGFBP-3在体外结合:图3B为考马斯亮蓝染色检测纯化的GST-TRα1-NTD、GST-TRα1-DBD、GST-TRα1-LBD(条带3~5)。图3D中条带11、12、13即纯化的GST-TRα1-DBD、 GST-TRα1-LBD、GST- TRα1泳道中有一条相对分子质量为36 000的特异性条带,其大小与被转染的HEK-293细胞裂解液中检测到的HA-IGFBP-3一致,而在GST-TRα1-NTD、GST泳道中,则无任何条带,该结果说明TRα1的DBD及LBD可以与IGFBP-3在体外进行特异性结合。

TR:甲状腺激素受体;M:分子量标准;1:空白模板对照;2:TRα1编码顺序上半部分扩增产物;3:TRα1编码顺序后半部分扩增产物;4:重组质粒pGEM-T Easy Vector-TRα1up;5:重组质粒pGEM-T Easy Vector-TRα1up的BamHⅠ及其HindⅢ酶切; 6:重组质粒pGEM-T Easy Vector-TRα1down;7: 重组质粒pGEM-T Easy Vector-TRα1down的HindⅢ及其SalⅠ酶切;8:pGEX-6p-1-TRα1;9:pGEX-6p-1-TRα1的BamHⅠ及其SalⅠ酶切;箭头示TRα1成熟肽编码片段TR: thyroid hormone receptor; M: molecular weight marker; 1: control without template; 2: PCR fragment for TRα1up; 3: PCR fragment for TRα1down; 4: recombinant plasmid pGEM-T Easy Vector-TRα1up; 5: pGEM-T Easy Vector-TRα1up digested with BamHⅠ and HindⅢ; 6: recombinant plasmid pGEM-T Easy Vector-TRα1down; 7: recombinant plasmid pGEM-T EasyVector-TRα1down digested with HindⅢ and SalⅠ; 8: recombinant plasmid pGEX-6p-1-TRα1; 9: recombinant plasmid pGEX-6p-1-TRα1 digested with BamHⅠ and SalⅠ; Arrow shows the mature TRα1 peptide-coding sequenceA.TRα1有关的PCR 片段的扩增; B.pGEM-T重组质粒及其酶切鉴定;C.pGEX-6p-1-TRα1重组质粒及其酶切鉴定A.TRα1 related PCR fragment; B.recombinant plasmids pGEM-T-TRα1 and identification by endonuclease digestion; C.recombinant plasmids pGEX-6p-1-TRα1 and identification by endonuclease digestion
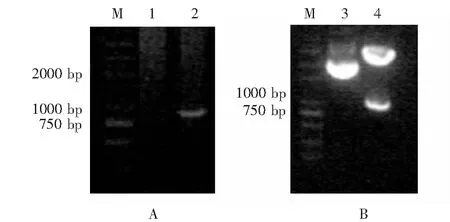
IGFBP-3:胰岛素样生长因子结合蛋白-3;M: 分子量标准;1:空白模板对照; 2:IGFBP-3的扩增片段;3:重组质粒pCMV-HA-IGFBP-3; 4:重组质粒pCMV-HA-IGFBP-3的BglⅡ及NotⅠ酶切;箭头示成熟肽IGFBP-3编码序列片段IGFBP-3: insulin-like growth factor binding protein-3;M: molecular weight marker; 1: control without template; 2. IGFBP-3 PCR fragment; 3: recombinant plasmid pCMV-HA-IGFBP-3; 4: recombinant plasmid pCMV-HA-IGFBP-3 digested with BglⅡ and Not Ⅰ;Arrow shows the mature IGFBP-3 peptide-coding sequenceA.IGFBP-3编码顺序的PCR扩增;B.重组质粒pCMV-HA-IGFBP-3的酶切鉴定A.PCR fragment of IGFBP-3 coding sequence; B.digestion of recombinant plasmid pCMV-HA-IGFBP-3

Mr:相对分子质量; GST: 谷胱甘肽-S-转移酶;M: 分子量标准; 1-5:聚丙烯酰胺凝胶电泳后分离重组蛋白的考马斯亮蓝染色(1: GST; 2:重组蛋白GST-TRα1; 3:重组蛋白GST-TRα1-NTD; 4:重组蛋白GST-TRα1-DBD ;5:重组蛋白GST-TRα1-LBD); 6-14:GST-拉下实验 (6:GST; 7:重组蛋白GST-TRα1; 8:IGFBP-3标准品; 9:GST;10:重组蛋白GST-TRα1-NTD;11:重组蛋白GST-TRα1-DBD;12:重组蛋白GST-TRα1-LBD;13:重组蛋白GST-TRα1; 14:IGFBP-3 标准品);箭头为有关蛋白所在位置Mr: relative molecular mass; GST: glutathione-S-transferase; M: molecular weight marker;1-5:recombinant proteins stained by coomassie blue after SDS-PAGE(1: GST; 2: GST-TRα1;3:GST-TRα1-NTD; 4:GST-TRα1-DBD; 5:GST-TRα1-LBD); 6-14:GST pull-down assay (6:GST;7:GST-TRα1; 8:IGFBP-3 standard; 9:GST;10:GST-TRα1-NTD;11:GST-TRα1-DBD; 12:GST-TRα1-LBD;13:GST-TRα1; 14:IGFBP-3 standard);Arrow showes related GST-fused proteinA. 重组蛋白GST-TRα1的SDS-PAGE后的考马斯亮蓝染色; B. 含TRα1不同结构域的GST融合蛋白的考马斯亮蓝染色;C. GST拉下实验: GST-TRα1蛋白与IGFBP-3蛋白孵育后电泳分离复合物并用IGFBP-3抗体进行免疫杂交分析;D. GST拉下实验:IGFBP-3与含有TRα1不同结构域的GST融合蛋白孵育后电泳分离并以IGFBP-3的抗体行免疫印迹杂交A. recombinant proteins GST-TRα1 stained by coomassie blue after SDS-PAGE; B. recombinant GST-fused proteins containing different domains of TRα1 stained by coomassie blue after SDS-PAGE; C. GST pull-down assay:GST-TRα1 incubated with IGFBP-3 , then the complex was separated by SDS-PAGE fellowed by Western blot analysis with antibody against IGFBP-3; D. GST pull-down assay:IGFBP-3 protein was incubated with GST-fused proteins containing different domains of TRα1 and the complex was analyzed by Western immunoblot analysis using antibody against IGFBP-3
免疫共沉淀验证TRα1与IGFBP-3的相互作用pCMV-HA-IGFBP-3和pCMV-Myc-TRα1共转染HEK-293细胞,转染24 h,再加入T3 10-7mol/L 4h后收获细胞。细胞裂解液加入鼠抗Myc抗体为实验组,加入鼠IgG孵育作为对照组。以蛋白G捕获的免疫复合物,经SDS-PAGE电泳后Western blot分析。抗IGFBP-3杂交后,实验组可以检测到IGFBP-3的存在,而对照组检测不到,说明细胞内TRα1与IGFBP-3可以相互作用(图4)。
FRET实验确定TRα1与IGFBP-3体内的相互作用激光共聚焦显微镜观察显示与黄色荧光蛋白融合的TRα1和与青色荧光蛋白融合的IGFBP-3在同一激光层切面的同一位置上均表达,经图像合成后该位置变成绿色,说明TRα1和IGFBP-3可以共同存在于细胞的细胞核(图5A)。
采用敏化发射光谱法的方法,计算能量转移效率。同样方法计算对照组的转移效率。两组转移效率的平均值进行比较,结果显示增强型青色荧光蛋白-IGFBP-3和增强型黄色荧光蛋白-TR 在T3存在时与增强型青色荧光蛋白/增强型黄色荧光蛋白比较,存在明显的能量转移现象(P<0.01),说明这两种蛋白之间存在直接相互作用。在无T3时,与增强型青色荧光蛋白/增强型黄色荧光蛋白共转染比较,存在有统计学意义的弱的能量转移现象(P<0.05),说明也有较弱的相互作用(图5B)。
IGFBP-3负性调节T3结合的TR对基因的激活作用构建的报告基因含生长激素基因的-500 bp的启动子,其中有甲状腺激素应答元件。在未转染TR的HEK-293细胞中甲状腺素未能刺激报告基因的表达,而在转染了TR后甲状腺素明显刺激报告基因的表达,共转染TR及用于IGFBP-3表达的空载体后结果类似,即也刺激报告基因的表达。但在检测共转染TR及IGFBP-3时发现在无T3作用下对生长激素启动子的影响无统计学意义,但在过表达IGFBP-3的细胞中,T3引起生长激素启动子活性增强的作用明显减弱,差异具有统计学意义(P<0.05)(图6)。
讨 论
核受体是一类需要许多蛋白-蛋白相互作用以调节基因表达的转录因子。甲状腺激素的作用依赖于TR和共调节子。 甲状腺激素受体与RAR、RXR和维生素D受体等同属非类固醇激素核受体超家族。和核受体家族的其他成员一样,TR包括N端转录激活区、DBD、链接区,还有含有AF-2激活区的C端LBD,在配体甲状腺激素结合后TR构象改变。TR以同源二聚体或与RXR以异二聚体形式结合甲状腺激素应答元件,调节基因表达。本研究通过GST-拉下实验证实TR的DBD与LBD均参与了与IGFBP-3的相互作用(图3)。另有研究显示当RXR的不同区域被独立表达时,只有DBD结合IGFBP-3[13]。本研究与其结果相似但存在不同。

IP:免疫沉淀; IB:免疫印迹杂交IP: immunoprecipitation; IB: immunoblot
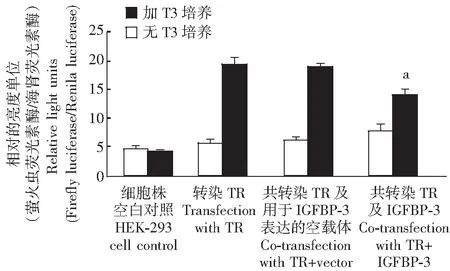
在T3存在下,与TR及用于IGFBP-3表达的空载体共转染组比较,aP<0.01aP<0.01 compared with the co-transfection with TR or TR + vector group in the presence of T3
免疫共沉淀实验说明IGFBP-3与TRα1之间在蛋白过表达的情况下有相互作用(图4)。但是尚需要内源性的蛋白相互作用实验才能更为准确地反应细胞内蛋白相互作用情况。
为了更接近IGFBP-3与核受体生理状态,探寻其在完整的细胞内相互作用的可能性,笔者进行了免疫荧光和FRET实验(图5),免疫荧光实验结果表明IGFBP-3可以与TRα1共定位于HEK-293 细胞的细胞核,为相互作用实验提供了较为直观的实验基础。荧光能量共振转移是距离很近的两个荧光分子间产生的一种能量转移现象。当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10 nm范围以内时,就会发生一种非放射性的能量转移,即FRET现象。本研究构建了pECFPG-N1-IGFBP-3和pEYFP-N1-TR真核表达载体,敏化发射光谱法证实荧光能量转移现象的存在,是在T3作用下IGFBP-3与TR相互作用的再次证明。
GH启动子含有甲状腺素应答元件,加入T3后明显激活启动子介导的基因转录,过表达的IGFBP-3则抑制这种激活,提示IGFBP-3抑制了T3反应性基因的转录(图6)。综上,本研究提示IGFBP-3通过与TR相互作用影响了T3-TR介导的靶基因转录。基于这些实验结果,笔者认为存在着一条新的影响T3-TR信号转导的途径,这为IGFBP-3在核内发挥非IGF依赖的作用提供了新的实验依据。
(本文图5见插图第4页)
[1] Firth SM, Baxter RC. Cellular actions of the insulin-like growth factor binding proteins[J]. Endocr Rev, 2002, 23(6):824-854.
[2] O’Han MK, Baxter RC, Schedlich LJ. Effects of endogenous insulin-like growth factor binding protein-3 on cell cycle regulation in breast cancer cells[J]. Growth Factors, 2009, 27(6):394-408.
[3] Kielczewski JL, Jarajapu YP, McFarland EL, et al. Insulin-like growth factor binding protein-3 mediates vascular repair by enhancing nitric oxide generation[J]. Circ Res, 2009, 105(9):897-905.
[4] Ingermann AR, Yang YF, Han J, et al.Identification of a novel cell death receptor mediating IGFBP-3-induced anti-tumor effects in breast and prostate cancer[J]. J Biol Chem, 2010, 285(39):30233-30246.
[5] Lee KW, Cohen P. Nuclear effects: unexpected intracellular actions of insulin-like growth factor binding protein-3[J]. J Endocrinol, 2002, 175(1):33-40.
[6] Liu B, Lee HY, Weinzimer SA, et al. Direct functional interactions between insulin-like growth factor-binding protein-3 and retinoid X receptor-alpha regulate transcriptional signaling and apoptosis[J]. J Biol Chem,2000, 275(43):33607-33613.
[7] Liu B, Lee KW, Li H, et al. Combination therapy of insulin-like growth factor binding protein-3 and retinoid X receptor ligands synergize on prostate cancer cell apoptosisinvitroandinvivo[J]. Clin Cancer Res, 2005, 11(13):4851-4856.
[8] Zappala G, Elbi C, Edwards J, et al. Induction of apoptosis in human prostate cancer cells by insulin-like growth factor binding protein-3 does not require binding to retinoid X receptor-alpha[J]. Endocrinology, 2008, 149(4):1802-1812.
[9] Schedlich LJ, O’Han MK, Leong GM, et al. Insulin-like growth factor binding protein-3 prevents retinoid receptor heterodimerization: implications for retinoic acid-sensitivity in human breast cancer cells[J]. Biochem Biophys Res Commun, 2004, 314(1):83-88.
[10] Chan SS, Schedlich LJ, Twigg SM, et al. Inhibition of adipocyte differentiation by insulin-like growth factor-binding protein-3[J]. Am J Physiol Endocrinol Metab, 2009, 296(4):E654-E663.
[11] Oetting A, Yen PM. New insights into thyroid hormone action [J]. Best Pract Res Clin Endocrinol Metab,2007, 21(2):193-208.
[12] Efendiev R, Cinelli AR, Leibiger IB, et al. FRET analysis reveals a critical conformational change within the Na,K-ATPase a1 subunit N-terminus during GPCR-dependent endocytosis[J].FEBS Lett, 2006, 580(21):5067-5070.
[13] Schedlich LJ, Graham LD, O’Han MK, et al. Molecular basis of the interaction between IGFBP-3 and retinoid X receptor: role in modulation of RAR-signaling[J]. Arch Biochem Biophys, 2007, 465(2):359-369.
Insulin-likeGrowthFactorBindingProtein-3InteractswiththeThyroidHormoneReceptorα1andModulatesTranscriptionofThyroidHormoneResponsiveGene
QIU Jia, MA Xiao-li, WANG Xin, CHEN Hong, HUANG Bing-ren
National Laboratory of Medical Molecular Biology, Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005, China
HUANG Bing-ren Tel:010-65228797,E-mail: huangbr@public.bta.net.cn;
ObjectiveTo study the interaction between insulin-like growth factor binding protein-3 (IGFBP-3) and thyroid hormone receptor α1 (TRα1) and the modulatory effect of IGFBP-3 on transcription of the thyroid hormone responsive gene.MethodsThe interaction between IGFBP-3 and TRα1 was detected with glutathione-S-transferase pull-down method, co-immunoprecipitation, fluorescence resonance energy transfer test. The cellular distribution of these two proteins was observed by confocal laser scanning microscopy. The effect of IGFBP-3 on the growth hormone promoter activity stimulated by triiodothyronine (T3) was determined by dual-luciferase reporter assay.ResultsIGFBP-3 interacted with TRα1 bothinvivoandinvitro. IGFBP-3 and TRα1 were shown to co-localize in the nucleus of HEK-293 cells. The overexpressed IGFBP-3 inhibited the growth hormone promoter activity stimulated by T3 (P<0.01).ConclusionsIGFBP-3 interacts with TRα1 and inhibits T3 responsive gene transcription. This finding further confirms the insulin-like growth factor-independent role of IGFBP-3 in the nucleus.
insulin-like growth factor binding protein-3; thyroid hormone receptor α1; triiodothyronine; growth hormone promoter
ActaAcadMedSin,2011,33(2):156-161
黄秉仁 电话:010-65228797,电子邮件: huangbr@public.bta.net.cn;
陈 虹 电话:010-65296980,电子邮件: hchen@public.bta.net.cn
Q571
A
1000-503X(2011)02-0156-06
10.3881/j.issn.1000-503X.2011.02.012
CHEN Hong Tel:010-65296980,E-mail: hchen@public.bta.net.cn
2010-07-23)
