ERK5基因-322G/T多态性与散发性结直肠癌易感性的关系
2011-11-20鲜振宇任东林陈典克刁德昌宋顺心黄清华汪建平
鲜振宇, 王 磊, 任东林, 陈典克, 刁德昌, 宋顺心, 黄清华, 汪建平
(中山大学附属第六医院胃肠病研究所, 广东 广州 510655)
ERK5基因-322G/T多态性与散发性结直肠癌易感性的关系
鲜振宇, 王 磊, 任东林, 陈典克, 刁德昌, 宋顺心, 黄清华, 汪建平△
(中山大学附属第六医院胃肠病研究所, 广东 广州 510655)
目的探讨有丝分裂原活化蛋白激酶(MAPK)信号通路ERK5基因-322G/T(rs3866958)单核苷酸多态性与中国华南地区散发性结直肠癌(CRC)易感性的关系。方法采用Taqman-MGB荧光探针法检测华南地区835例肠癌和908例正常对照的ERK5基因-322G/T单个核苷酸的多态性。结果ERK5基因单核苷酸多态性位点-322G/T等位基因在结直肠癌患者和健康对照人群中分布差异无统计学意义(Pgt;0.05),但在BMI≥24 kg/m2的肥胖人群中-322G/T的分布差异显著,与GG基因型相比,GT、TT基因型携带者的CRC发病风险下降42.4%(OR=0.576, 95%CI0.413-0.804,Plt;0.01)。结论ERK5基因-322G/T单核苷酸多态性与结直肠癌发病无明显相关性,但可显著降低肥胖患者发病风险;-322T基因型是中国南方人群散发性结直肠癌肥胖患者的独立保护因素。
结直肠肿瘤; 细胞外信号调节激酶 5; 多态性,单核苷酸
结直肠癌(colorectal cancer,CRC)是最常见的消化道恶性肿瘤之一。近年来随着食物结构和生活方式的改变,我国的结直肠癌发病率和死亡率呈逐年上升的趋势[1],已超越胃癌成为我国第二大癌症。结直肠癌的发病机制尚未完全阐明,现一般认为其发病是环境因素(饮食习惯、肠道细菌等)与内在因素(基因变异、癌前病变)相互作用的一个复杂而漫长的过程。单核苷酸多态性(single nucleotide polymorphism,SNP)标记(主要指基因组单个核苷酸水平上的变异引起的DNA序列多态性)是否会引起基因蛋白表达差异甚至导致疾病日益受到重视。近年来,随着大量的SNP位点的检出,其与结直肠癌的发生、发展、化疗耐药性及预后等方面的相关性日益受到关注。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一个多基因家族,能被各种细胞外信号激活[2]。通过MAPK信号通路级联反应,外部环境信号被传递到细胞质及细胞核内,引起细胞合成相应的蛋白从而对外环境的变化作出反应。目前在哺乳动物细胞中已鉴定出4条MAPK信号转导通路:细胞外信号调节激酶 1/2(extracellular signal- regulated kinase1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、 p38 MAPK和细胞外信号调节激酶5 (extracellular signal-regulated kinase,ERK5)。ERK5是其中最新的一条通路,是MAPK家族的重要组成部分。国外已有文献报道ERK5通路与乳腺癌、肝癌、肺癌及前列腺癌、良性前列腺增生症等疾病的相关性,但尚未有ERK5基因 SNP与结直肠癌关联性的报道。所以本研究拟采用 Taqman -MGB荧光探针法首次探讨ERK5基因-322G/T单核苷酸多态性位点与结直肠癌的相关性。
材 料 和 方 法
1材料
1.1主要仪器与试剂 ABI7500实时定量荧光PCR仪(ABI,No. 275004365);ABI 3730 DNA测序仪(ABI)。Taqman Universal PCR Master Mix(ABI);血液基因组抽提试剂盒(北京天根生化科技公司);1×TE缓冲液(1 mmol/L Tris-HCl, 1 mmol/L EDTA,pH 8.0);测序引物由上海Invitrogen合成;2×GoTaq Master Mix (Promega);PCR引物纯化试剂盒(Promega)。
1.2病人资料 病例组选自2002年7月-2010年2月在广州6个临床中心就诊的835例结直肠癌患者,均经组织病理学确诊,病例组对象纳入标准包括:华南地区汉族人群,无血缘关系。剔除标准为家族性腺瘤性息肉病和遗传性非息肉性结直肠癌。对照组为同时期同一地区无血缘关系的健康体检人群,均为汉族,共908例,对照组与病例组按年龄(±5岁)和性别上相匹配。所有参与实验者均签署知情同意书,并获中山大学附属第六医院伦理委员会批准。
2方法
2.1基因组DNA提取 按常规蛋白酶K消化、苯酚/氯仿抽提、乙醇沉淀法提取外周血白细胞基因组DNA,pH 8.0 TE溶解,-20 ℃保存。部分DNA按照实验要求浓度稀释至10 mg/L,-4 ℃保存备用。
2.2多态性位点的选择 根据GenBank单核苷酸多态性数据库(http://www.ncbi. nlm.nih.gov) Hap-map、GenBank提供的数据库信息,凡亚裔人群中已报道的ERK5等位基因频率gt;0.05的均可入选。最终我们选择了-322G/T(rs3866958)作为我们的研究位点。
2.3TaqMan-MGB探针法基因分型 ABI公司7500实时定量荧光PCR仪进行检测。-322G/T位点等位基因G对应FAM 荧光基团,T对应VIC 荧光基团。FAM 或VIC 荧光明显上升代表检测的样本基因型为其对应基因的纯合子,而FAM和VIC荧光同步升则样本为杂合基因型,见图1。采用合成引物序列:上游引物5’-GAATGTGTCATCCCCGGTAG-3’,下游引物5’-CCTTTCCTTCCAGCTCACAG-3’ 。每次PCR扩增均设立阴性对照(除未加入DNA模板外,其他加入试剂与待检测标本相同)。20 μL PCR 反应体系包括:PCR Mix 0 μL,上、游引物及探针Mix 2 μL,DNA模板:1 μL,ROX 0.04 μL,3 d水 7 μL 。PCR反应循环条件(ABI 7500实时荧光PCR仪):95 ℃预变性10 min,使AmpliTaq Gold® DNA聚合酶活化,然后95 ℃ 15 s,60 ℃ 60 s,55个循环。反应结束由ABI 7500实时荧光PCR等位基因辨别系统对样本进行分型。分成GG、GT、TT型,结果由2位不知道病例或对照分组情况的实验者判断。在实验时设已知基因型的样本为阳性对照,并随机抽取10%的样本加以验证,结果100%吻合。
3统计学处理
在被纳入本研究以前的时间里吸烟总量达100支者定义为“有”吸烟史,否则为“无”吸烟史。在入组本研究前每周至少饮酒1次、持续时间不少于1年者,定义为“有”饮酒史,反之定义为“无”饮酒史。采用基因计数法计算各多态等位基因频率和基因型频率。以拟合优度2检验进行哈迪-温伯格平衡(Hardy-weinberg equilibrium,HWE)检验。病例组和对照组基本信息和基因型分布的比较采用2检验。基因多态性与结直肠癌的关联强度采用校正优势比(adjusted odds ratio,adjusted,)及其95 %可信区间(95% confidence interval,CI)进行描述。数据采用非条件Logistic回归模型计算各基因型与结直肠癌风险的相关性。采用相乘模型来判断基因-环境之间是否存在交互,同时采用似然比检验来分析总的交互模型是否有意义。全部统计分析均在SPSS 9.13.0软件中进行。
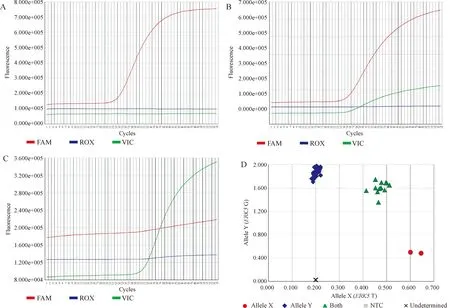
Figure 1. The curves of genotypes detected by TaqMan-MGB fluorescence probe methods. A:fluorescent curves of GG genotype;B:fluorescent curves of GT genotype;C:fluorescent curves of TT genotype;D:auto allelic discriminaion by ABI7500 system.
结 果
1研究对象的一般情况
结直肠癌组与健康对照组比较,年龄、性别分布无差异,Pgt;0.05,吸烟、饮酒、癌症家族史、体重指数分布有明显差异,Plt;0.05,见表1。
2-322G/T与结直肠癌罹患风险关系
-322 G/T多态性位点基因型在病例组与对照组频数分布特征见表2。对照组基因型频率符合哈迪-温伯格平衡规律(Pgt;0.05),通过对对照组与病例组各基因型进行统计分析发现各基因型分布无显著差异(Pgt;0.05),因此尚不能认为ERK5基因-322G/T(rs3866958)多态性位点与结直肠癌发病存在关联性。
3-322G/T位点各基因型在肥胖患者中的分布
我们进一步按年龄、性别、吸烟、饮酒、癌症家族史和体重指数分成亚组,在年龄、性别、吸烟、饮酒和癌症家族史各亚组中,GG与GT+TT基因型分布无显著差异(Pgt;0.05)。在以体重指数BMI进行分层分析时,在BMI≥24 kg/m2的肥胖者中,病例组与对照组GG与GT+TT基因型分布差异显著(Plt;0.01,OR=0.576 ,95%CI0.413-0.804 ) ,见表3。这说明在肥胖者中,ERK5基因-322G/T(rs3866958)多态性与结直肠癌发病可能有关联。
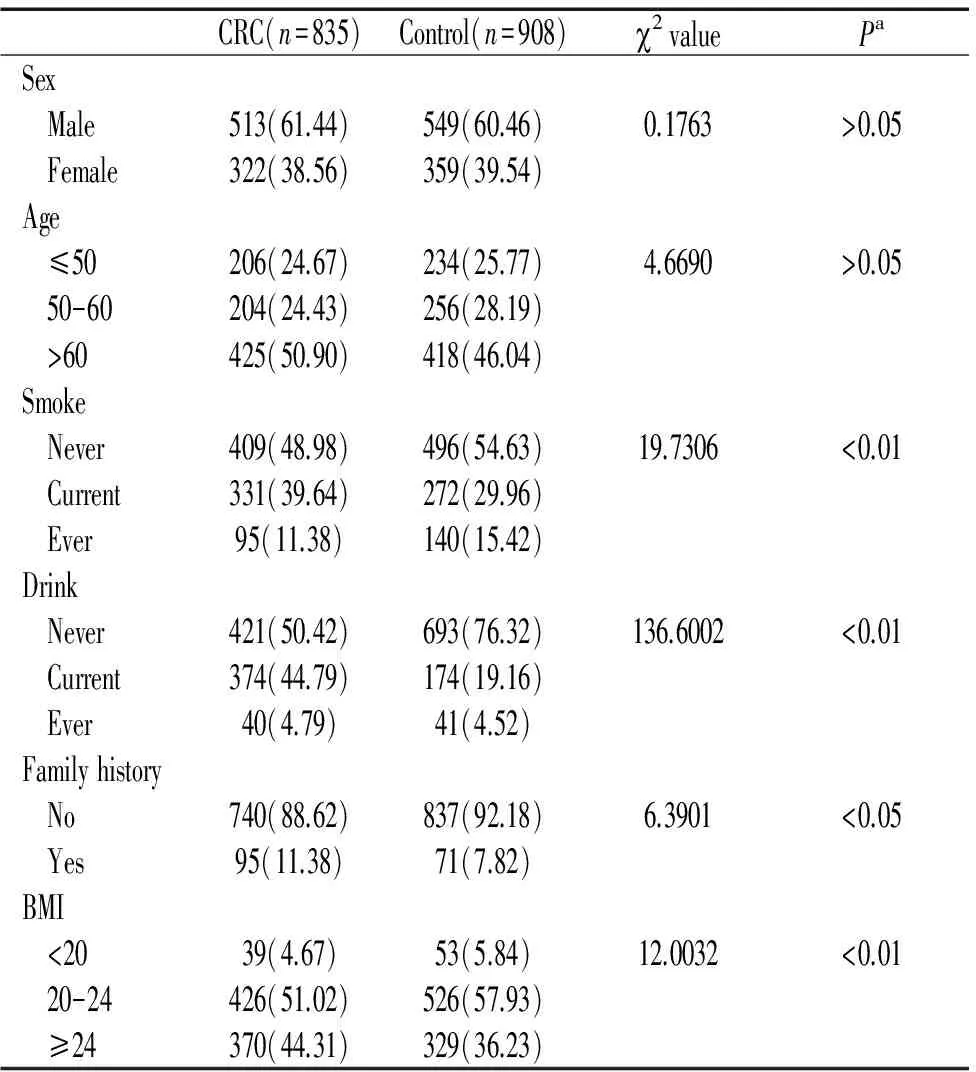
表1 CRC组与对照组多种混淆因素频率比较
4-322G/T与BMI的交互作用
我们通过Logistic回归模型以乘法效应进一步分层分析各基因型与性别、年龄、吸烟、饮酒、BMI、肿瘤家族史等环境暴露因素的交互作用,见表3,发现BMI与 -322 G/T位点基因型存在交互作用(Plt;0.01)。这提示BMI≥24 kg/m2与 -322 G/T位点多态性在促进结直肠癌发生、发展上存在交互作用。
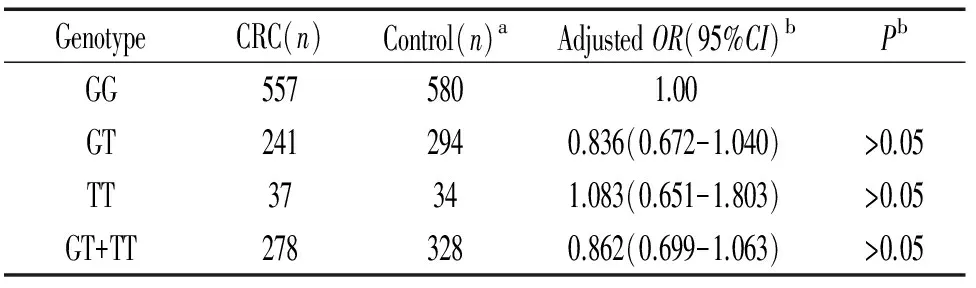
表2 ERK5-322G/T基因型频数分布与散发性结直肠癌风险的关系
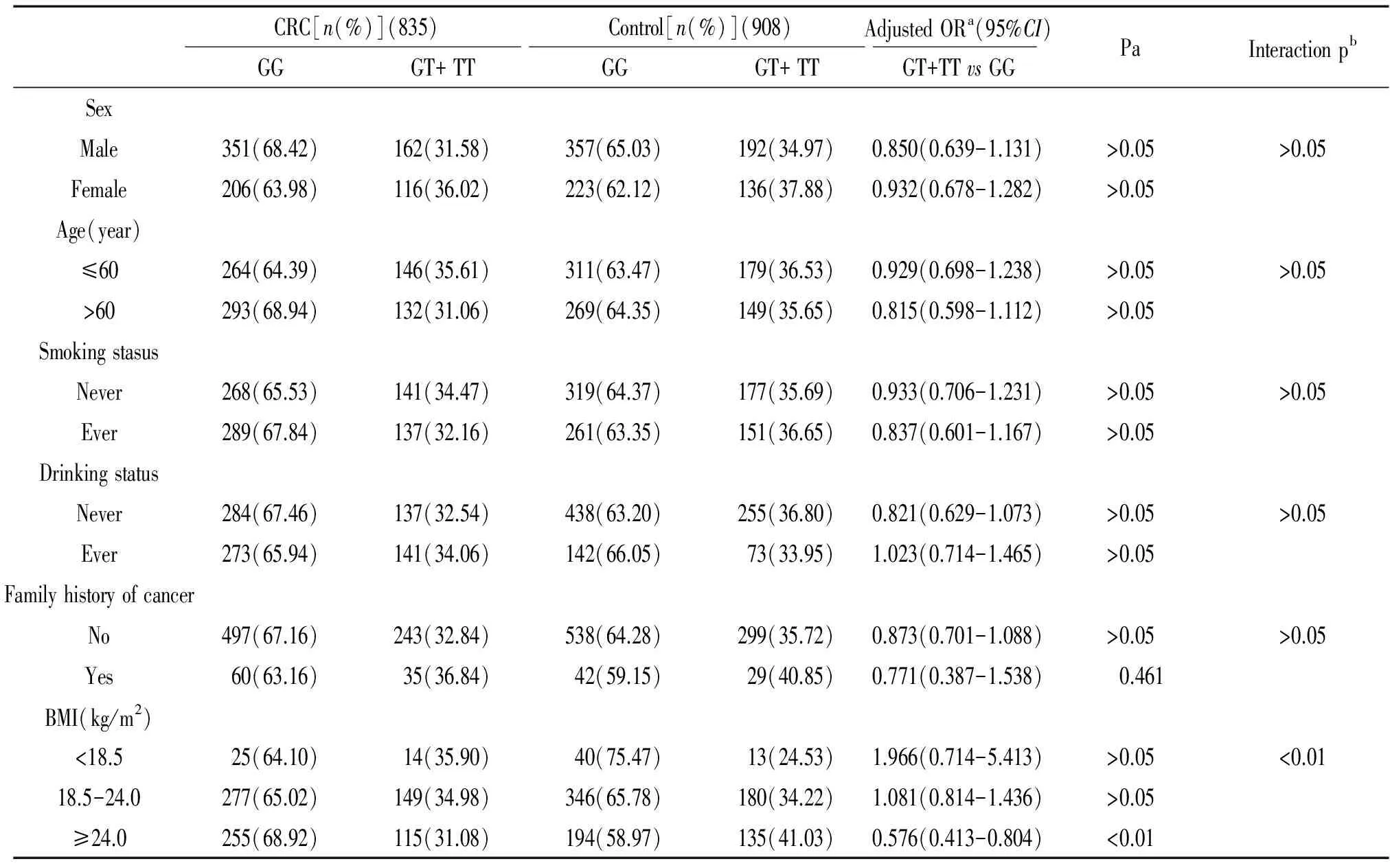
表3 以所选变量分层分析ERK5-322G/T基因型与散发性结直肠癌关系
讨 论
结直肠癌是我国常见的恶性肿瘤之一,其发生发展机制尚未完全阐明,现一般认为其发病是易感人群受环境的有害因素长期作用的结果,此过程涉及到多步骤、多阶段及多基因的改变[3, 4]。
MEK5-ERK5 是MAPK信号通路中最新的一条通路。细胞外的各种刺激因素-应激、高渗透压、生长因子、丝裂原等可以激活MAPKKK(MEKK3或MEKK2) ,依次激活MAPKK(MEK5) , 然后激活ERK5[5],导致相应蛋白表达的变化,从而引起细胞生长、增殖、分化等生物效应。1995年2个研究团队[6, 7]分离鉴定出了ERK5蛋白,并证实了MEK5与ERK5之间结合的高度特异性,MEK5是ERK5唯一的上游激酶,即使在MEK5过表达的情况下也不激活MAPK家族其它成员[6, 8]。小鼠ERK5基因由6个外显子和5个内含子组成,长度5.6 kb,选择性剪接内含子1和/或2可产生3个亚型:a、b、c,ERK5b和ERK5c均没有蛋白激酶活性,但可以通过MEF2C蛋白阻断MEK5和ERK5介导的转录活动[9]。人类ERK5基因位于17P11.2,编码816个氨基酸构成的120 kD蛋白[10]。该蛋白有C端尾巴,长度几乎是其它MAPK家族成员的2倍,而它的独特性也就在于它的C端尾巴。研究发现,C端尾巴有自主抑制功能,ERK5通过磷酸化C端尾巴,能自动激活C端尾巴的活性[11]。MEK5-ERK5级联的作用底物主要为MEF2C(myocyte enhancing factor-2C)[12],MEF2A和MEF2D也是ERK5的下游作用靶点,但对MEF2B没有作用。ERK5介导的MEF2A和MEF2D的磷酸化对EGF诱导的c-Jun基因表达起到非常重要的作用[13]。高浓度的PD98059、U0126和PD184352可以起到抑制ERK5 MAPK通路的作用。
现有研究证实,癌基因ras、cot、src等可以激活ERK5,从而影响细胞的生长、增殖等效应[14-16]。在肿瘤细胞中,ERK5的激活可导致一些蛋白激酶受体(如:ErbB家族)表达上调,而与肿瘤预后差、无病生存期短、肿瘤进展及药物耐受有关。Esparís-Ogando等[7]在对人类肿瘤细胞系中的ERK5进行分析后,发现了呈持续激活状态的ERK5与活化形式的ErbB2、ErbB3、ErbB4,而在人乳腺癌细胞中,ERK5信号通路可以通过ErbB依赖的机制传递加速生长信号。Mehta等[18]通过研究发现MEK5-ERK5级联与前列腺癌的骨转移有关。Carvajal-Vergara等[19]发现在多发性骨髓瘤分离细胞中白细胞介素6(interleukin 6,IL-6)可以激活ERK5,ERK5的显性负性形式可以限制骨髓瘤细胞的增殖,并使细胞对诱导凋亡的药物敏感。Hayashi等[20]通过对黑色素瘤的肿瘤血管的发展进行研究后,认为VEGF及FGF介导的肿瘤血管形成均需要ERK5通路的参与。
本实验首次对ERK5 SNP与CRC的相关性进行了研究,我们通过多中心、大样本的病例对照研究发现ERK5-322G/T(rs3866958)多态性位点与中国华南地区人群CRC发病风险无明显相关性。提示在普通人群中,ERK5 -322G/T单独作用并不能增加CRC的发病风险。从表1可以看出,病例组与对照组在年龄、性别因素的分布上差异无显著(Pgt;0.05),而在吸烟、饮酒、癌症家族史及BMI的分布上差异显著(Plt;0.05)。这也印证了在普通人群中,吸烟、饮酒、癌症家族史及肥胖是结直肠癌发病高危因素的结论。我们进一步按年龄、性别、吸烟、饮酒、癌症家族史和体重指数(BMI)等暴露因素进行分层分析,发现在BMI≥24 kg/m2亚组中,GG与GT+TT基因型分布差异显著(OR=0.576,95%CI0.413-0.804),-322G/T与BMI≥24 kg/m2存在交互作用。说明在肥胖患者中,-322G/T单独作用可明显降低其发病风险,与GG基因型相比,GT、TT基因型携带者的CRC发病风险下降42.4%,-322T是中国南方肥胖人群罹患结直肠癌的保护因素。其可能的解释为-322T变异基因型影响了ERK5的正常功能,从而使其丧失了促进Erb B等蛋白表达上调的能力,无法促进肿瘤血管形成,失去对癌基因的应答,而肥胖人群存在的胰岛素抵抗加强了这些作用,所以该SNP位点可显著降低肥胖人群的罹患风险。这也可能为我们在肥胖人群(BMI≥24 kg/m2)中防治结直肠癌提供一个新的药物作用靶点。在其它各亚组分层分析中,各基因型分布无明显差异,也不存在交互作用,说明在不同年龄段、吸烟、饮酒、家族史等特定人群中,-322G/T多态性并不能降低各亚组特定人群的发病风险,这可能与吸烟、饮酒等有害因素及癌症家族史背景使得该人群失去了-322G/T的保护作用。
综上所述,ERK5 MAPK信号通路与肿瘤的发生、进展、转移及预后密切相关,本试验研究的-322G/T(rs3866958)位点单核苷酸多态性单独作用尚不能认为可增加中国南方人群罹患结直肠癌的风险,但在BMI≥24 kg/m2的肥胖人群中,-322G/T单独作用可明显降低结直肠癌的发病风险,可能为我们在肥胖人群中防治CRC提供新的治疗靶点,但具体作用机制及可能产生的效益需要更进一步深入的研究。本研究由于样本量不够大且不是以人群为基础的研究,可能存在研究对象的选择偏倚。该位点为何可降低肥胖人群的患病风险,尚需进一步的研究。但本实验毕竟是关于ERK5 SNP与结直肠癌关系的最早的实验之一,必将为后来研究者提供一定的参考与借鉴价值。
[1] 郑 树,蔡善荣. 中国大肠癌的病因学及人群防治研究[J]. 中华肿瘤杂志,2004,26(1):1-3.
[2] Abe J, Kusuhara M, Ulevitch RJ, et al. Big mitogen-activated protein kinase 1 (BMK1) is a redox-sensitive kinase[J]. J Biol Chem,1996,271(28):16586-16590.
[3] 吴晓滨,彭俊生,李初俊,等. 蛋白质组学检测结直肠腺瘤及早期恶变患者血清的差异蛋白质变化及意义[J]. 中国病理生理杂志,2009,25(6):1098-1103.
[4] 崔 冀,康玉博,黄 帅,等. 蛋白质组学检测β-原肌球蛋白在结肠癌组织中的表达[J]. 中国病理生理杂志,2009,25(8):1509-1512.
[5] Sun W, Kesavan K, Schaefer BC, et al. MEKK2 associates with the adapter protein Lad/RIBP and regulates the MEK5-BMK1/ERK5 pathway.[J]. J Biol Chem,2001,276(7):5093-5100.
[6] Zhou G, Bao ZQ, Dixon JE. Components of a new human protein kinase signal transduction pathway[J]. J Biol Chem,1995,270(21):12665-12669.
[7] Lee JD, Ulevitch RJ, Han J. Primary structure of BMK1: a new mammalian map kinase[J]. Biochem Biophys Res Commun,1995,213(2):715-724.
[8] English JM, Pearson G, Hockenberry T, et al. Contribution of the ERK5/MEK5 pathway to Ras/Raf signaling and growth control[J]. J Biol Chem,1999,274(44):31588-31592.
[9] Yan C, Luo H, Lee JD, et al. Molecular cloning of mouse ERK5/BMK1 splice variants and characterization of ERK5 functional domains[J]. J Biol Chem,2001,276(14):10870-10878.
[10]Hii CS, Anson DS, Costabile M, et al. Characterization of the MEK5-ERK5 module in human neutrophils and its relationship to ERK1/ERK2 in the chemotactic response.[J]. J Biol Chem,2004,279(48):49825-49834.
[11]Buschbeck M, Ullrich A. The unique C-terminal tail of the mitogen-activated protein kinase ERK5 regulates its activation and nuclear shuttling[J]. J Biol Chem,2005,280(4):2659-2667.
[12]Hayashi M, Kim SW, Imanaka-Yoshida K, et al. Targeted deletion of BMK1/ERK5 in adult mice perturbs vascular integrity and leads to endothelial failure[J]. J Clin Invest,2004,113(8):1138-1148.
[13]Kato Y, Zhao M, Morikawa A, et al. Big mitogen-activated kinase regulates multiple members of the MEF2 protein family[J]. J Biol Chem,2000,275(24):18534-18540.
[14]English J M, Vanderbilt CA, Xu S, et al. Isolation of MEK5 and differential expression of alternatively spliced forms[J]. J Biol Chem,1995,270(48):28897-28902.
[15]Chiariello M, Marinissen MJ, Gutkind JS. Multiple mitogen-activated protein kinase signaling pathways connect the cot oncoprotein to thec-junpromoter and to cellular transformation[J]. Mol Cell Biol,2000,20(5):1747-1758.
[16]Sun W, Wei X, Kesavan K, et al. MEK kinase 2 and the adaptor protein Lad regulate extracellular signal-regulated kinase 5 activation by epidermal growth factor via Src[J]. Mol Cell Biol,2003,23(7):2298-2308.
[17]Esparís-Ogando A, Diaz-Rodriguez E, Montero JC, et al. Erk5 participates in neuregulin signal transduction and is constitutively active in breast cancer cells overexpressing ErbB2[J]. Mol Cell Biol,2002,22(1):270-285.
[18]Mehta PB, Jenkins BL, Mccarthy L, et al. MEK5 overexpression is associated with metastatic prostate cancer, and stimulates proliferation, MMP-9 expression and invasion[J]. Oncogene,2003,22(9):1381-1389.
[19]Carvajal-Vergara X, Tabera S, Montero JC, et al. Multifunctional role of Erk5 in multiple myeloma[J]. Blood,2005,105(11):4492-4499.
[20]Hayashi M, Fearns C, Eliceiri B, et al. Big mitogen-activated protein kinase 1/extracellular signal-regulated kinase 5 signaling pathway is essential for tumor-associated angiogenesis[J]. Cancer Res,2005,65(17):7699-7706.
AssociationbetweenERK5-322G/Tpolymorphismandgeneticsusceptibilitytosporadiccolorectalcancer
XIAN Zhen-yu, WANG Lei, REN Dong-lin, CHEN Dian-ke, DIAO De-chang, SONG Shun-xin, HUANG Qing-hua, WANG Jian-ping
(InstituteofGastroenterology,TheSixthAffiliatedHospital,SunYet-senUniversity,Guangzhou510655,China.E-mail:wangjpgz@yahoo.com.cn)
AIM: To investigate the correlation between extracellular signal-regulated kinase 5 (ERK5) -322G/T polymorphism (rs3866958) and the susceptibility to sporadic colorectal cancer (CRC) in southern Chinese population.METHODSERK5 -322G/T genotypes were determined by Taqman-MGB probes in 835 CRC cases and 908 healthy controls.RESULTSNo significance ofERK5 -322G/T genotype distribution between CRC patients and controls was observed, but -322G/T decreased the susceptibility to CRC in fat people whose BMI was ≥ 24 kg/m2. Compared to GG genotypes, the carriers with GT and TT genotypes had a significant decrease in the risk of CRC(OR=0.576,95%CI0.413-0.804,Plt;0.01).CONCLUSIONERK5 -322G/T polymorphism (rs3866958) has no significant relevance with sporadic CRC susceptibility, but decrease, the risk of CRC in people with fatness. The T variant genotype is an independent protective factor against sporadic CRC of overweight patients in southern Chinese population.
Colorectal neoplasms; Extracellular signal-regulated kinase 5; Polymorphism,single nucleotide
1000-4718(2011)04-0699-06
R735.3
A
10.3969/j.issn.1000-4718.2011.04.015
2010-10-08
2011-02-16
△通讯作者 Tel:020-38785499;E-mail:wangjpgz@yahoo.com.cn
