甲状腺功能减退对新生仔鼠心肌肌浆网钙转运蛋白表达的影响*
2011-11-20毛姗姗赵正言
毛姗姗, 赵正言
(浙江大学医学院附属儿童医院儿童保健科,浙江 杭州 310003)
甲状腺功能减退对新生仔鼠心肌肌浆网钙转运蛋白表达的影响*
毛姗姗, 赵正言△
(浙江大学医学院附属儿童医院儿童保健科,浙江 杭州 310003)
目的探讨甲状腺功能减退(甲减)对新生仔鼠心肌肌浆网钙转运蛋白肌浆网Ca2+-ATP酶(SERCA2a)、磷酸受纳蛋白(PLB) mRNA表达以及肌浆网Ca2+-ATP酶活性的影响,并观察左旋甲状腺素(L-T4)替代治疗后以上指标的改变。方法SD孕鼠自孕15 d起每天予丙基硫氧嘧啶(PTU)(50mg/d)灌胃至仔鼠出生并持续整个哺乳期,制成围生期甲减模型,并对部分甲减仔鼠自出生当天起每天腹腔注射L-T4(20 μg /kg)。收集甲减、治疗及对照组出生3、5、7日龄的仔鼠心室肌组织(每组10只),应用实时荧光定量PCR方法检测SERCA2a及PLB mRNA含量,并同时采用荧光分光光度计法测定心肌细胞内游离钙(MyoCa2+)浓度,无机磷酸根法检测心肌肌浆网钙泵活性。结果实时荧光定量PCR结果显示甲减组新生仔鼠心肌SERCA2a mRNA水平下降(Plt;0.05),PLB mRNA水平升高(Plt;0.01),SERCA2a/PLB下降(Plt;0.01);L-T4治疗组仔鼠SERCA2a mRNA水平较甲减组上升(Plt;0.05),PLB mRNA水平下降(Plt;0.05),SERCA2a/PLB上升(Plt;0.01)。心肌细胞内游离钙浓度检测结果显示甲减组心肌细胞MyoCa2+浓度较同日龄对照组升高(Plt;0.01);L-T4治疗组仔鼠心肌细胞MyoCa2+浓度低于同日龄甲减组仔鼠(Plt;0.05)。酶活性检测结果显示甲减组仔鼠肌浆网Ca2+-ATP酶活性低于同日龄对照组(Plt;0.01);L-T4治疗组仔鼠肌浆网Ca2+-ATP酶活性较同日龄甲减组仔鼠升高(Plt;0.05)。结论甲状腺激素缺乏可使新生大鼠肌浆网Ca2+-ATP酶活性降低,并下调SERCA2a表达,上调PLB表达;肌浆网钙转运蛋白SERCA2a与PLB参与调控围生期甲减诱发的新生仔鼠心功能下降。
甲状腺功能减退症; 肌浆网Ca2+-ATP酶; 磷酸受纳蛋白; 大鼠,新生
先天性甲状腺功能减退症(congenital hypothyroidism,CH)是儿科较常见的一种内分泌疾病,由于其围生期甲状腺激素减少,可对出生患儿的生长和智力发育造成严重影响[1],除了主要对大脑造成严重损伤之外,近年来CH对心脏器官的影响倍受关注,我们前期的研究已证实CH对新生儿就可造成心脏收缩和舒张功能损伤,经过早期甲状腺素替代治疗可得到逆转[2],但其可能机制尚未明确。肌浆网Ca2+-ATP酶(sarcoplasmic reticulum Ca2+-ATPase 2a,SERCA2a)是肌浆网(sarcoplasmic reticulum,SR)膜上重要的Ca2+转运蛋白,对心肌细胞收缩期和舒张期Ca2+浓度调节均发挥着十分重要的作用[3-5]。磷酸受纳蛋白(phospholamban,PLB)是存在于肌浆网中的内源性抑制物,通过蛋白激酶磷酸化反应调节SERCA2a对Ca2+的亲和力[6-8],SERCA2a与PLB之间的定量变化是调节心脏收缩和舒张功能改变的一个重要因素[9]。本实验通过建立围生期甲减及甲状腺素替代治疗仔鼠模型,应用实时荧光定量PCR(real-time PCR)方法从mRNA水平定量分析钙转运蛋白SERCA2a及PLB含量的变化,同时采用荧光分光光度计法测定心肌细胞内游离钙(calcium in myocardium,MyoCa2+)浓度,无机磷酸根法检测各组新生仔鼠的肌浆网Ca2+-ATP酶活性,以观察仔鼠钙转运蛋白基因及表型的变化,探讨围生期甲减诱发新生仔鼠心功能下降的可能机制。
材 料 和 方 法
1材料
1.1实验动物与主要试剂 清洁级SD怀孕大鼠(浙江省医学科学院实验动物中心);丙基硫氧嘧啶(propylthiouracil,PTU)(南通精华制药有限公司);左旋甲状腺素(levothyroxine,L-T4)(Sigma);游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)及促甲状腺激素(thyrotropin,TSH)试剂盒(DPC);考马斯亮蓝蛋白试剂盒、ATP酶试剂盒(南京建成生物工程研究所);Trizol、AMV 逆转录酶(RTase)、Taq酶(上海生工生物工程技术服务有限公司);引物合成(Invitrogen)。
2方法
2.1动物模型的制备和分组 清洁级SD孕鼠自孕15 d起予PTU(50 mg/d)灌胃至仔鼠出生并持续整个哺乳期,出生仔鼠为甲减鼠。部分甲减仔鼠自出生当日起每日予以腹腔注射L-T4(20 μg /kg),为L-T4治疗组。其余孕鼠每天予生理盐水灌胃,出生仔鼠为对照组。取3、5、7日龄仔鼠各10只,称体重(body weight,BW)后断头处死,并立即开胸取出心脏置于冰生理盐水中,剪去心房、腱索及脂肪组织,并洗净血液,滤纸吸干水分,称心室净重量(heart weight,HW)后立即至液氮中冻存。
2.2血清甲状腺激素水平测定 分离各组仔鼠血清,采用天津德普(diagnostic products corporation,DPC)生物技术和医学产品有限公司生产的IMMULITE全自动化学发光免疫分析仪及配套试剂盒测定血清FT3、FT4和TSH水平。
2.3实时荧光定量PCR法
① 总RNA提取与cDNA合成 取30 mg左右心肌组织采用Trizol一步法提取总RNA,采用Du-640紫外分光光度仪检测RNA纯度及浓度。取RNA模板5 μL,利用AMV RTase逆转录生成cDNA,总反应体系为20 μL。RNA模板5 μL,Oligo-dT(0.165 g/L)3 μL,加RNase-free双蒸水定容至11.5 μL,轻轻混匀后离心3-5 s;混合物70 ℃反应5 min,冰浴30 s(0 ℃),离心3-5 s;分别加入5×Buffer 4 μL,RNA酶抑制剂0.5 μL,dNTPs(10 mmol/L)2 μL,混匀后离心3-5 s;37 ℃反应5 min;加入AMV RTase2 μL,终体积为20 μL,37 ℃反应60 min,94 ℃反应5 min,结束反应,置于-20 ℃保存。
② 实时荧光定量PCR反应 检索基因文库大鼠SERCA2a及PLB序列,参考相关文献设计引物序列,引物由上海Invitrogen合成。SERCA2a序列上游5’-ATGAGATCACAGCTATGACTGGTG-3’,下游5’-GCATTGCACATCTCTATGGTGACTAG-3’,产物651 bp;PLB序列上游5’-TACCTTACTCGCTCGGCTATC-3’,下游5’-CAGAAGCATCACAATGATGCAG-3’,产物141 bp;内参照β-actin上游5’-GAGACCTTCAACACCCCAGCC-3’,下游5’-GGCCATCTCTTGCTCGAAGTC-3’,产物312 bp。
总反应体系为50 μL,其中cDNA 2 μL,2×SYBR Premix Ex Taq Buffer 25 μL,目标产物的引物2 μL(上、下游各1 μL),β-actin引物2 μL(上下游各1 μL),RNase-free双蒸水补足至50 μL,混匀后在ABI7500型实时荧光定量PCR基因扩增仪(ABI)上进行PCR扩增。反应条件分别为:预变性 94 ℃4 min,94 ℃15 s,60 ℃1 min,共40次循环;随后进行溶解曲线反应,得到所有标本的所有记录点曲线。ABI Prism 7500 SDS软件将自动进行数据分析,调整基线,计算出threshold cycle (CT值),即每个反应管内的荧光信号到达设定的阈值时所经历的循环数。根据每个样本的CT值,通过公式计算出每个相对于内参照β-actin的定量,从而比较各组样本的表达变化情况。
2.4MyoCa2+浓度测定 取30 g左右心室肌组织参照Beuckelmann等[10]方法测定并加以改良。LC-240型荧光分光光度计(P-E)测定细胞悬液荧光F(激发波长340 nm,发射波长500 nm)。分别加入0.1%Triton X-100和2.5 mmol/L乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)后测定最大荧光值(Fmax)和最小荧光值(Fmin)。按公式(F-Fmin)/×Fmax-F)×224计算MyoCa2+浓度,单位为nmol/L。
2.5肌浆网Ca2+-ATP酶活性测定 参照Jones等[11]差速离心法制备肌浆网,所有操作均在冰上完成。取液氮中冻存30 mg左右心室肌1块,剪碎后置离心管,加入5倍体积A液(10 mmol/L NaHCO3,5 mmol/L NaN3,pH 7.0),冰上匀浆后13 000×g离心10 min,留上清液,沉淀加5倍A液,匀浆后13 000×g离心10 min,留上清液加第1次上清液合并后13 000×g离心20 min,弃沉淀,上清液再离心(43 000×g)30 min,弃上清液,沉淀加2倍体积B液(0.6 mol/L KCl,30 mmol/L组氨酸,pH 7.0),混匀再离心(43 000×g)30 min,弃上清液,沉淀加1 mL C液(0.25 mol/L蔗糖,30 mmol/L组氨酸,pH 7.0)充分混匀,取100 μL采用考马斯亮蓝法测定肌浆网蛋白浓度,无机磷酸根法测定肌浆网Ca2+-ATP酶活性。酶活性单位为1 mmol Pi·g-1protein·h-1。
3统计学处理

重复肾及输尿管畸形及输尿管异位开口,是泌尿系常见的先天畸形疾病。根据畸形部位和特征,重复肾及输尿管畸形分为完全性、不完全性两种。完全性重复指一侧或双侧输尿管全长重复,输尿管可分别开口于膀胱或尿道等部位;不完全性重复指一侧或双侧输尿管部分重复、汇合后共同开口于膀胱。单侧重复较双侧多6倍。完全重复时,上输尿管口位于下内侧,而下输尿管口位于上外侧。如果重复的输尿管开口于膀胱以外,则称为输尿管异位开口。该疾病女性多于男性,临床表现取决于异位开口部位,男性异位开口多见于后尿道及精囊,女性多见于尿道、前庭和阴道,女性患者的典型症状是既有正常自行排尿,又有持续漏尿或尿失禁。
结 果
1动物模型表型与行为特征改变(表1)
各组新生仔鼠BW比较差异显著(Plt;0.01)。正常对照组新生仔鼠体重增加快,活动性强。甲减组新生仔鼠体重增加缓慢,显著低于同日龄正常组新生仔鼠(Plt;0.01),且体形小,尾短,行动迟缓,反应迟钝,张眼晚。L-T4治疗组新生仔鼠一般情况较甲减组仔鼠有明显改善,体形增大、反应灵敏度增强,体重较同日龄甲减组仔鼠显著增加(Plt;0.01),但仍低于同日龄正常组仔鼠水平(Plt;0.01)。

表1 各组新生仔鼠BW、HW和HW/BW重的比较
2HW和HW/BW的变化(表1)
甲减组新生仔鼠HW显著低于同日龄对照组仔鼠(Plt;0.05),但HW/BW无显著差异(Pgt;0.05);L-T4治疗组各日龄段新生仔鼠HW显著高于甲减组同日龄仔鼠(Plt;0.01),除3日龄外(Pgt;0.05),L-T4治疗组HW/BW较同日龄甲减组仔鼠显著升高(5、7日龄Plt;0.05)。
3血清甲状腺激素水平的变化(表2)
甲减组新生仔鼠各日龄段血清FT4水平接近药盒检测底限(2.8 pmol/L),明显低于同日龄对照组新生仔鼠(Plt;0.01);血清FT3水平较同日龄对照组仔鼠相比也显著降低(Plt;0.01);血清TSH水平较同日龄对照组仔鼠显著升高(Plt;0.01)。L-T4治疗组仔鼠血清FT3和FT4水平较同日龄甲减组仔鼠显著升高(Plt;0.01),血清TSH水平显著下降(Plt;0.01),但治疗组各激素水平均尚未达到同日龄正常组水平(Plt;0.05)。

表2 各组新生仔鼠血清FT3、FT4与TSH水平的比较
4心肌SERCA2a与PLBmRNA表达变化(表3)

表3 各组新生仔鼠心肌SERCA2a、PLB及SERCA2a/PLB mRNA水平的比较
5MyoCa2+浓度的变化(图1)
各组间同日龄MyoCa2+浓度具有显著差异(Plt;0.01),3、5、7日龄甲减组仔鼠MyoCa2+浓度分别为(131.63±33.86)nmol/L、(152.74±38.67)nmol/L、(188.23±42.33)nmol/L,显著高于同日龄对照组(88. 34±27.43)nmol/L、(95.23±28.92)nmol/L、(110.22±31.52)nmol/L(Plt;0.01)。3、5、7日龄L-T4治疗组仔鼠MyoCa2+浓度分别为(100.30±29.69)nmol/L、(116.65±31.75)nmol/L、(137.52±34.43)nmol/L,显著低于同日龄甲减组仔鼠(Plt;0.05)。
6心肌肌浆网Ca2+-ATP酶活性的变化(图2)
对照组、甲减组与L-T4治疗组新生仔鼠的肌浆网Ca2+-ATP酶活性随着日龄增加而增加。各组间同日龄心肌肌浆网Ca2+-ATP酶活性具有显著差异(Plt;0.01),3、5、7日龄甲减组仔鼠肌浆网Ca2+-ATP酶活性分别为(1.57±0.26)mmol Pi·g-1protein·h-1、(1.78±0.33)mmol Pi·g-1protein·h-1、(2.06±0.32)mmol Pi·g-1protein·h-1,显著低于同日龄对照组(2.34±0.42)mmol Pi·g-1protein·h-1、(2.68±0.44)mmol Pi·g-1protein·h-1、(3.21±0.50)mmol Pi·g-1protein·h-1(Plt;0.01),分别降低32.91%、33.58%、35.83 %。3、5、7日龄L-T4治疗组仔鼠肌浆网Ca2+-ATP酶活性分别为(1.98±0.35)mmol Pi·g-1protein·h-1、(2.29±0.40)mmol Pi·g-1protein·h-1、(2.70±0.42)mmol Pi·g-1protein·h-1,显著高于同日龄甲减组仔鼠(Plt;0.05),分别上升26.11%、28.65%、31.07%,但仍低于同日龄对照组(Plt;0.05)。

Figure 1. Analysis of concentration of ventricular MyoCa2+ in hypothyroid, L-T4 and control groups. ±s. n=10. *plt;0.05 vs control group; #Plt;0.05 vs hypothroid group.
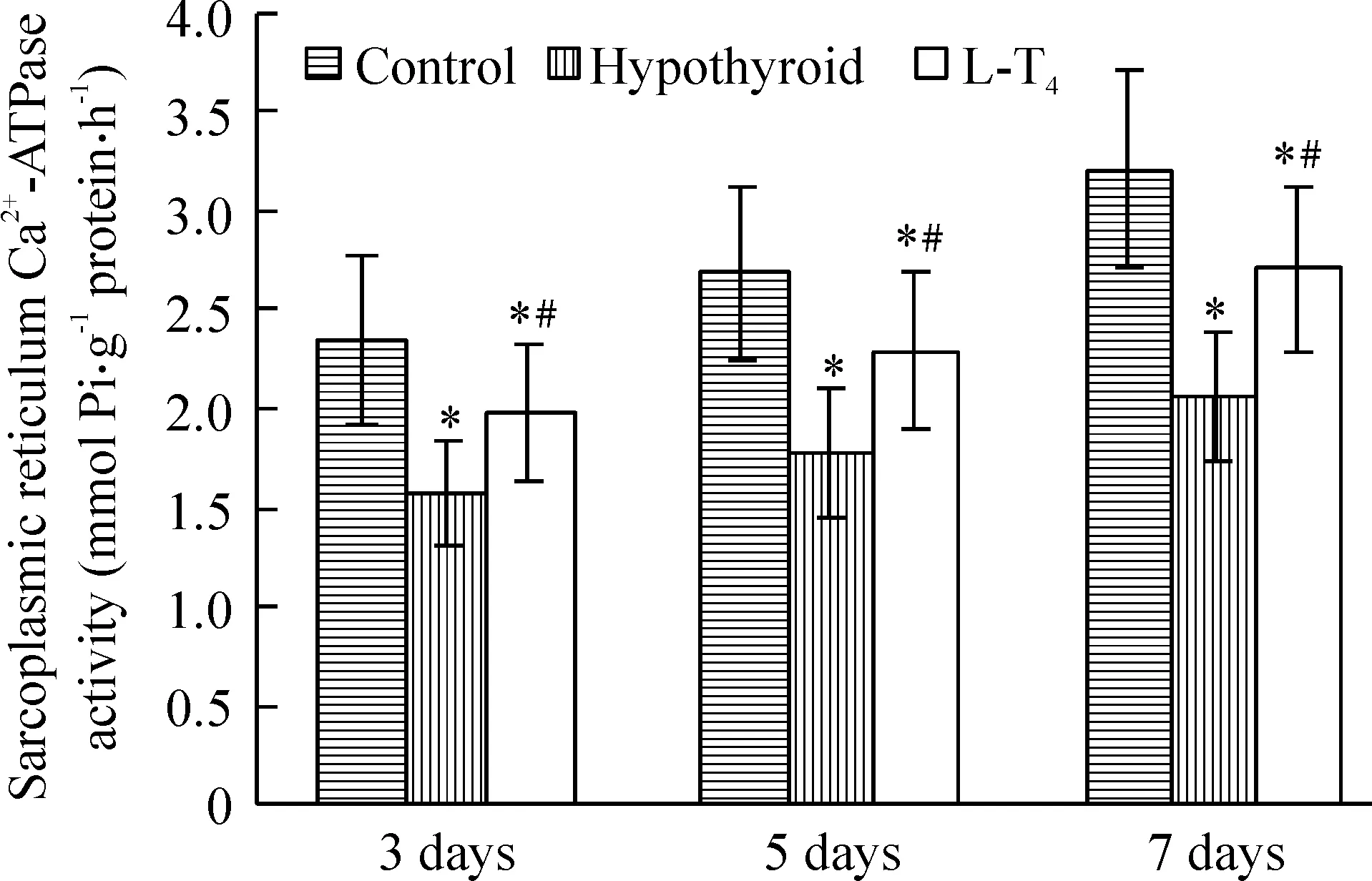
Figure 2. Analysis of sarcoplasmic reticulum Ca2+-ATPase activity in hypothyroid, L-T4 and control groups. ±s. n=10. *Plt;0.05 vs control group;#Plt;0.05 vs hypothroid group.
讨 论
甲状腺激素是调节细胞多种功能的一种重要生理性激素,可影响到细胞代谢、蛋白质合成和物质转运,尤其对小儿生长发育和多器官系统的发育起着重要作用。围生期甲状腺功能减退是由胎儿甲状腺发育不良或者孕母甲状腺激素缺乏引起,出生患儿即表现为先天性甲状腺功能减退。本实验在孕鼠孕15 d至生后15日龄给予PTU灌胃,所生仔鼠体重减轻,生长发育迟缓,血清FT3、FT4下降,TSH升高,提示模型制备是成功的。本研究同时给予部分甲减仔鼠以L-T4治疗,结果发现L-T4替代治疗后仔鼠血清甲状腺激素水平显著上升,替代治疗对恢复甲状腺功能有显著效果,然而甲减仔鼠在短期内(7日龄)尚未到达正常水平,推测可能与替代治疗持续时间或治疗剂量有关。
在本研究中,我们发现新生甲减仔鼠BW与HW均显著下降,HW/BW无显著变化,提示体内低甲状腺激素水平对体格生长及心脏的发育成熟均产生了显著的影响。经L-T4治疗后,新生仔鼠BW与HW均明显上升,其中HW在7日龄时已接近正常水平,HW/BW在5日龄和7日龄时也均高于甲减组仔鼠,7日龄还高于正常组仔鼠,提示随着甲状腺功能的逐渐恢复,仔鼠体格生长与心脏发育均呈现追赶现象,且随着日龄增长和激素水平的提高,对心脏的发育的影响似乎更大。
心肌细胞内Ca2+浓度的变化是细胞兴奋-收缩偶联和心肌收缩舒张功能的主要决定因子。胞浆内游离钙浓度异常增高可致心肌细胞钙超载,从而导致心功能障碍。心肌肌浆网则是调控心肌细胞内Ca2+稳态的重要细胞器,肌浆网Ca2+-ATP酶为存在于肌浆网上调控细胞内Ca2+浓度的最重要的钙转运蛋白,主要靠水解ATP将细胞质中的Ca2+逆浓度梯度泵入肌浆网内,使心肌细胞内Ca2+浓度急剧下降而介导舒张,同时肌浆网内贮存的Ca2+又将是下一次心肌收缩的基础[4,5]。磷酸受纳蛋白(PLB)是存在于肌浆网中的内源性抑制物,为肌浆网钙泵的活性调节蛋白。PLB的过度表达可抑制SERCA2a的活性,降低其对Ca2+的亲和力, Ca2+浓度减少,从而引起心肌细胞收缩和舒张频率下降,心肌收缩时间延长。
钙转运蛋白在调控成年甲减动物心功能改变中的可能机制已有部分研究,其中有报道大鼠和兔的SERCA2a mRNA及蛋白表达均下降,给予T3治疗后SERCA2a表达可显著上升[12],然而对于PLB表达的研究结果并不一致,甲减动物心肌PLB的表达变化为上升或下降甚至无变化者均有报道[12-14]。迄今为止关于甲状腺激素对钙转运蛋白的调节大多局限于成年动物模型的研究,而围生期甲减是否会对出生的新生仔鼠心肌肌浆网钙转运蛋白的表达产生影响以及甲状腺素替代治疗的反应如何,目前则尚未见报道。
本实验通过real-time PCR方法对各组新生仔鼠的心肌SERCA2a及PLB mRNA表达水平进行研究,发现甲减仔鼠SERCA2a mRNA表达下降,PLB mRNA表达升高,说明甲状腺激素减少直接影响了SERCA2a及PLB的基因转录水平,由于SERCA2a表达的下调及PLB表达的上调,SERCA2a/PLB比值下降,对Ca2+-ATP酶活性的抑制作用加强,使后者对胞浆内游离Ca2+的再摄取功能减低,出现松弛功能障碍。经L-T4替代治疗后,SERCA2a mRNA表达显著上升,PLB mRNA表达显著下降,两者比例上升,提示甲状腺素替代治疗对调整钙转运蛋白的基因转录,从而最终改善心功能十分有效。我们同时发现治疗组仔鼠其SERCA2a mRNA表达在短期治疗(5-7 d)后可达到正常对照组水平,提示甲状腺激素水平的上升对SERCA2a mRNA表达的影响较大,替代治疗可在短期内使之完全恢复正常。然而PLB mRNA表达以及两者比例SERCA2a/PLB仍未达到正常组水平,推测其原因可能与甲状腺激素水平尚未在短期内恢复正常有关,继续替代治疗是否能完全逆转尚需进一步研究。
本研究同时发现新生甲减大鼠MyoCa2+浓度升高,肌浆网钙泵活性显著下降,说明甲状腺激素水平可影响肌浆网对Ca2+的转运,引起肌浆网 Ca2+摄取速度减慢和摄取量减少,导致心肌细胞钙超载,心肌舒张缓慢和舒张不完全,继而再影响心肌兴奋-收缩偶联,最终引起心肌收缩力降低。本实验同时对部分新生甲减仔鼠进行L-T4替代治疗,结果发现治疗后随着甲状腺激素水平的上升,其MyoCa2+浓度显著降低,提示甲状腺素替代治疗能减轻甲减引起的心肌细胞内游离钙增高,并使肌浆网钙泵活性增加,但在7日龄内尚未到达正常组水平,钙泵活性在生后早期短期替代治疗后未能完全恢复正常,推测可能与甲状腺功能尚未完全恢复正常有关。
综上所述,本研究提示甲状腺激素减少可使新生大鼠心肌SERCA2a表达下降,PLB表达上升,SERCA2a/PLB比值下降,直接抑制了肌浆网Ca2+-ATP酶活性,导致心肌细胞内Ca2+超载,这一系列反应可能为先天性甲状腺功能减退症引起新生儿心脏收缩和舒张功能下降[2]的重要分子机制之一,早期L-T4替代治疗后以上指标可得到部分或全部恢复,从而促使受损心功能在生后短期内得到改善。
[1] Büyükgebiz A. Congenital hypothyroidism clinical aspects and late consequences[J]. Pediatr Endocrinol Rev, 2003,1 (Suppl 2): 185-190.
[2] Mao S,Wang Y,Jiang G,et al. Effects of levothyroxine therapy on left and right ventricular function in neonates with congenital hypothyroidism: a tissue Doppler echocardiography study [J]. Eur J Pediatr, 2007, 166(12): 1261-1265.
[3] Díaz ME, Graham HK, O’neill SC. The control of sarcoplasmic reticulum Ca content in cardiac muscle[J]. Cell
Calcium, 2005, 38(3-4): 391-396.
[4] Rossi AE, Dirksen RT. Sarcoplasmic reticulum: the dynamic calcium governor of muscle [J]. Muscle Nerve, 2006, 33(6): 715-731.
[5] Periasamy M, Kalyanasundaram A. SERCA pump isoforms: their role in calcium transport and disease [J]. Muscle Nerve, 2007, 35(4): 430-442.
[6] Rodriguez P, Kranias EG. Phospholamban: a key determinant of cardiac function and dysfunction [J]. Arch Mal Coeur Vaiss, 2005, 98(12): 1239-1243.
[7] Kadambi VJ, Ponniah S, Harrer JM, et al. Cardiac-specific overexpression of phospholamban alters calcium kinetics and resultant cardiomyocyte mechanics in transgenic mice [J]. J Clin Invest, 1996, 97(2): 533-539.
[8] Frank K, Kranias EG. Phospholamban and cardiac contractility[J]. Ann Med, 2000, 32(8): 572-578.
[9] Koss KL, Grupp IL,Kranias EG. The relative phospholamban and SERCA2 ratio a critical determinant of myocardial contractility[J]. Basic Res Cardiol, 1997, 92(Suppl 1): 17-24.
[10]Beuckelmann DJ, Näbauer M, Erdmann E. Intracellular calcium handling in isolated ventricular myocytes from patients with terminal heart failure[J]. Circulation, 1992, 85(3): 1046-1055.
[11]Jones LR, Besch HR Jr, Fleming JW, et al. Separation of vesicles of cardiac sarcolemma from vesicles of cardiac sarcoplasmic reticulum. Comparative biochemical analysis of component activities [J]. J Biol Chem, 1979, 254(2): 530-539.
[12]Shenoy R, Klein I, Ojamaa K. Differential regulation of SR calcium transporters by thyroid hormone in rat atria and ventricles[J]. Am J Physiol Heart Circ Physiol, 2001, 281(4): H1690-H1696.
[13]Ojamaa K, Kenessey A, Klein I. Thyroid hormone regulation of phospholamban phosphorylation in the rat heart[J]. Endocrinology, 2000, 141(6): 2139-2144.
[14]Reed TD, Babu GJ, Ji Y,et al. The expression of SR calcium transport ATPase and the Na+/Ca2+exchanger are antithetically regulated during mouse cardiac development and in hypo/hyperthyroidism[J]. J Mol Cell Cardiol, 2000, 32(3): 453-464.
AlterationofmyocardialsarcoplasmicreticulumCa2+transportproteinexpressioninneonatalhypothyroidrats
MAO Shan-shan, ZHAO Zheng-yan
(1DepartmentofChildHealthCare,TheChildren’sHospital,ZhejiangUniversitySchoolofMedicine,Hangzhou310003,China.E-mail:maoshanshan33@163.com)
AIM: To investigate the alteration of sarcoplasmic reticulum (SR) Ca2+transport proteins including sarcoplasmic reticulum Ca2+-ATPase 2a(SERCA2a) and phospholamban(PLB) mRNA expression as well as the alteration of myocardial SR Ca2+-ATPase activity in neonatal hypothyroid rats, and to explore the effect of levothyroxine(L-T4) substitution therapy on the above indexes.METHODSHypothyroidism was induced by the administration of propylthiouracil (PTU, 50 mg/d) to the pregnant SD rats by gavage beginning on embryonic day 15 and continuing throughout the lactational period. A subgroup of neonatal hypothyroid rats were intraperitoneally injected with L-T4levothroxine (20 μg/kg BW daily), starting from the day of birth. Other pregnant SD rats
normal saline instead of PTU. The samples of the rats in all 3 groups were harvested at postnatal day 3, 5 and 7 respectively (n=10). After measurement of serum thyroid hormone levels, the hearts were removed and the ventricles were weighed (HW). The concentration of calcium in ventricular myocardium(ventricular myoCa2+) was detected by fluorospectrophotometry and the activity of SR Ca2+-ATPase was determined by the inorganic phosphorus method. The mRNA expression of SERCA2a and PLB was also detected by real-time PCR.RESULTSNeonatal hypothyroid rats had a significant lower level of SERCA2a mRNA (Plt;0.05) and a higher level of PLB mRNA (Plt;0.01), and subsequent lower SERCA2a/PLB at each postnatal day (Plt;0.01) was observed. Compared with hypothyroid group, the mRNA expression of SERCA2a significantly increased (Plt;0.05) and that of PLB significantly decreased (Plt;0.05) in L-T4treatment group. The concentration of ventricular MyoCa2+in hypothyroid group was significantly higher than that in control group (Plt;0.01), and that in L-T4treatment group showed a significant decrease as compared with hypothyroid group (Plt;0.05). The activity of sarcoplasmic reticulum Ca2+-ATPase in hypothyroid group was significantly lower than that in control group (Plt;0.01), and that in L-T4treatment group showed a significant increase as compared to hypothyroid group (Plt;0.05).CONCLUSIONThe deficiency of thyroid hormone, resulting in decreased expression of SERCA2a mRNA as well as increased PLB mRNA, contributes to the reduction of SR Ca2+-ATPase activity in neonatal rats. This may be one of the most important mechanisms of myocardial systolic and diastolic dysfunctions.
Hypothyroidism; Sarcoplasmic reticulum Ca2+-ATPase; Phospholamban; Rats,neonatal
1000-4718(2011)04-0763-06
R363.2+1
A
10.3969/j.issn.1000-4718.2011.04.027
2010-09-25
2011-02-25
浙江省教育厅科研资助项目(No.Y201019211)
△通讯作者 Tel:0571-87061007-12121; E-mail:maoshanshan33 @163.com
