尾悬吊模拟失重对雌性大鼠生殖功能的影响
2011-11-20贾木天宋昕宸张怡明王立祥
贾木天, 宋昕宸, 张怡明, 王立祥
(1山东大学医学院药理学研究所,山东 济南 250012;2山东省实验中学,山东 济南 250001)
尾悬吊模拟失重对雌性大鼠生殖功能的影响
贾木天1,2, 宋昕宸1,2, 张怡明1,2, 王立祥1△
(1山东大学医学院药理学研究所,山东 济南 250012;2山东省实验中学,山东 济南 250001)
目的探讨模拟失重对雌性大鼠生殖功能的影响及其发生机制,为太空探索者的健康保护提供可借鉴的科学线索。方法利用尾部悬吊法建立模拟失重状态大鼠模型;选取Wistar雌性大鼠72只,随机均分为6组,3个实验组分别为:模拟失重7 d组、模拟失重14 d组和模拟失重21 d组;3个对照组是与模拟失重组相对应的自由活动组。应用酶联免疫吸附法(ELISA)检测血清中雌二醇(E2)、卵泡刺激素(FSH)和黄体生成素(LH)水平;HE染色观察卵巢组织结构,特异性脂褐素染色观察卵巢组织衰老状况;逆转录定量PCR(qRT-PCR)技术检测细胞衰老相关分子端粒酶逆转录酶(TERT)、p53、p16、p21和P27的mRNA表达水平;免疫组织化学方法检测P53、P16、P21和P27的蛋白表达;随机取健康雄性大鼠分别与各组雌性大鼠合笼,比较生育仔鼠数量和存活率。结果与各对照组相比, 模拟失重7 d组、14 d组和21 d组大鼠血清中E2下降,FSH和LH上升(Plt;0.05);大鼠卵巢组织卵泡数量明显减少,卵巢组织发生细胞衰老现象,细胞衰老相关分子TERT mRNA表达被抑制(Plt;0.05),衰老相关的细胞周期调控分子p53、p16、p21和p27在mRNA和蛋白水平表达均升高(Plt;0.05)。各模拟失重组雌性大鼠生育的仔鼠数量较相应的对照组明显减少(Plt;0.05),仔鼠存活率显著下降(Plt;0.01)。结论尾悬吊模拟失重导致雌性大鼠生殖功能下降,该现象与模拟失重诱导卵巢组织细胞衰老和下丘脑-垂体-卵巢轴内分泌功能紊乱相关。
尾悬吊; 失重; 卵巢; 生殖
我国在掌握了载人航天飞行技术后,将逐步进入到空间站时代,如何保障航天员在太空环境中长期生活是亟待解决的科学问题。宇航员进入太空将面临失重环境威胁,失重对机体多器官产生不良影响,可累及心血管、神经、内分泌、骨骼肌肉等系统。近期有研究发现模拟失重对性成熟期雄性大鼠生殖功能有较明显的损害,这种损伤可能与失重引起睾丸生精细胞凋亡有关[1]。卵巢属女性生殖和内分泌器官,是人类繁衍和女性健康的基础,失重环境对卵巢功能影响的研究罕见报道。尾部悬吊大鼠模型是由Wronski等[2]于1987年首次建立研究模拟失重的动物模型,至今这一实验方法仍为研究模拟失重环境的的经典动物模型[1,3-5]。本研究利用鼠尾悬吊法模拟失重状态,研究模拟失重对雌性大鼠生殖功能的影响,旨在为太空探索者的健康保护提供可借鉴的科学线索。
材 料 和 方 法
1动物及主要试剂
Wistar大鼠购自山东大学实验动物中心;Trizol购自Invitrogen;RT试剂盒购自Fermentas;逆转录定量PCR试剂盒购自大连宝生物公司;TERT、p53、p16、p21和p27的引物由北京华大基因合成,抗体购自Santa Cruz;DAB染色试剂盒、伊红和苏木素购自北京中杉公司;免疫组化试剂盒购自Invitrogen;石蜡切片衰老相关脂褐素染色试剂盒购自上海杰美生物有限公司。
2动物模型的建立和分组
选择清洁级成年Wistar雌性大鼠,体重250-300 g,采用尾部悬吊法建立模拟失重大鼠模型[2],大鼠单笼饲养,实验组大鼠置于悬吊笼,大鼠尾部悬于笼顶,前肢踏于笼底,使大鼠头低位,躯干与笼底水平面呈30°,后肢自由悬空不负重, 前肢着地可自然活动并正常觅食饮水。正常对照组不悬吊并自由活动。选取Wistar雌性大鼠72只,先适应性喂养1周后,随机均分为6组,3个实验组分别为:模拟失重7 d组、14 d组和21 d组;3个对照组:是与模拟失重组相对应的自由活动组,即自由活动7 d组、14 d组和21 d组。
3ELISA法检测大鼠血清中雌二醇(estradiol,E2)、卵泡刺激素(folliclestimulatinghormone,FSH)和黄体生成素(luteinizinghormone,LH)水平
取大鼠血置于促凝管中,待血清析出后离心收集。按照E2、FSH和LH的ELISA检测试剂盒说明书进行检测,在450 nm波长依序测量吸光度(A值)。
4逆转录定量PCR(qRT-PCR)检测细胞衰老相关分子端粒酶逆转录酶(telomerasereversetranscriptase,TERT)、p53、p16、p21和p27mRNA表达
4.1引物的设计与合成 TERT游引物5’-CGAAAGAGTGTCTGGAGCAA-3’,下游引物5’-GGATGAAGCGGATTCTGGA-3’;p53上游引物5’- CAGCTTTGAGGTTGGTGTTTGT -3’,下游引物5’- ATGCTCTTCTTTTTTGCGGAAA-3’;p16上游引物5’-CATCTCCGAGAGGAAGGCGAACT-3’,下游引物5’-CGCAGTTCGAATCTGCACCATAG-3’;p21上游引物5’-ATGTCCGATCCTGGTGATGT-3’,下游引物5’-GGGCTTTCTCTTGCAGAAGA- 3’; p27上游引物5’-GAGGGCAGATACGAGTGGCAG-3’,下游引物5’-CTGGACACTGCTCCGCTAACC-3’;β-actin上游引物5’-CACCCGCGAGTACAACCTTC-3’, 下游引物5’- CCCATACCCACCATCACACC -3’。
4.2RNA提取与逆转录反应 取100 mg大鼠卵巢放入研磨器中,加入1 mL Trizol,提取卵巢组织RNA。将4 μL总RNA、1μL 随机六聚体引物在离心管中混合,补DEPC水至10 μL,65 ℃保温5 min,置于冰上;每管中再加入4 μL 5×RT缓冲液,2 μL DTT,2 μL 10 mmol/L dNTP,1 μL RNA酶抑制剂和1 μL逆转录酶,小心混匀,按25 ℃ 5 min、42 ℃ 60 min、72 ℃ 10 min的程序处理样品,获得cDNA。
4.3实时定量PCR 将cDNA按照1∶5的比例进行稀释;建立PCR体系后,在实时定量PCR仪上按程序95 ℃ 30 s,[95 ℃ 10 s、60 ℃ 31 s(40个循环)] 进行PCR。
5组织切片HE染色观察卵巢结构
常规脱蜡水化,Harris苏木素染色 4-8 min;自来水洗返蓝15-30 min;0.5%伊红染色30s-60s;依次梯度乙醇脱水,二甲苯透明;中性树胶封片;观察结果并照相记录。
6特异性脂褐素原染色观察卵巢组织衰老状况
用组织衰老特异性脂褐素染色试剂盒进行卵巢组织染色,封片观察拍照。
7免疫组化检测细胞衰老相关分子P53、P16、P21和P27蛋白表达
常规脱蜡水化;3%H2O2消除内源性过氧化物酶;10%血清封闭;滴加适当比例稀释的Ⅰ抗或Ⅰ抗工作液,4 ℃过夜;PBS冲洗,5 min×3次;滴加适当比例稀释的生物素标记Ⅱ抗,37 ℃孵育10-30 min; PBS冲洗,5 min×3次;滴加适当比例稀释的辣根酶标记链霉卵白素(PBS稀释),37 ℃孵育10-30 min;PBS冲洗,5 min×3次;DAB显色剂显色;自来水充分冲洗,苏木素复染,封片观察结果照相。
8雌性大鼠产仔数量及仔鼠存活率观察
随机取健康雄性大鼠分别与模拟失重组雌性大鼠和相应对照组雌性大鼠合笼,比较产仔鼠数量和存活率。
9统计学处理
结 果
1模拟失重组雌性大鼠血清E2、FSH和LH浓度升高
各组大鼠血清中性激素水平见表1,结果显示与各地面对照组相比,各模拟失重组雌鼠E2水平显著下降,均有显著差异(Plt;0.05),各模拟失重组雌鼠FSH和大鼠LH水平均有所上升,与对照组相比均有显著差异(Plt;0.05)。
2模拟失重组雌性大鼠卵巢组织中卵泡数量减少,卵巢组织出现衰老现象
与地面对照组相比,各模拟失重组大鼠卵巢组织中卵泡数量减少,见图1。与各对照组相比,各模拟失重组雌性大鼠卵巢组织衰老脂褐素染色出现棕色阳性信号,表明卵巢组织发生衰老现象,见图2。

表1 模拟失重对雌性大鼠血清中性激素水平的影响
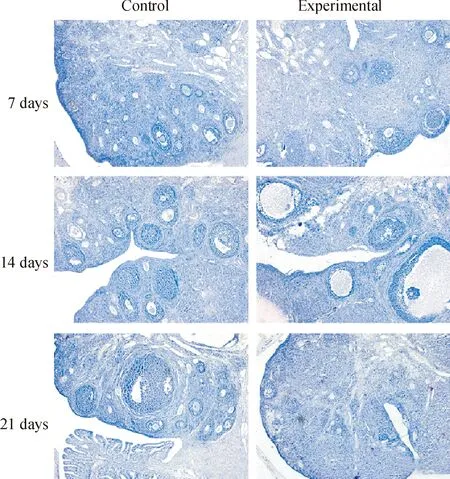
Figure 1. The results of HE staining showed that the number of ovarian follicle in the experimental groups reduced compared with the control groups(×100).
3模拟失重组雌性大鼠卵巢细胞衰老相关分子TERT、p53、p16、p21和p27mRNA表达变化
与各正常对照组相比,TERT在各模拟失重组大鼠卵巢组织表达受到抑制,显著差异(Plt;0.05);在细胞周期中起关键调控作用的p53、p16、p21、和p27的表达则呈现升高趋势,与各对照组相比均存在显著差异(Plt;0.05),见表2。

表2 细胞衰老相关分子TERT、p53、p16、p21和p27 mRNA的表达变化
4模拟失重组雌性大鼠卵巢细胞衰老相关分子P53、P16、P21和P27蛋白的表达变化
与各对照组相比,各模拟失重组P53、P16、P21和P27表达阳性的细胞显著增多,见图3-6。对各切片分别进行计算机扫描和数据分析,结果表明,与各对照组相比,各模拟失重组棕色阳性信号明显增强,(Plt;0.01),见表3。
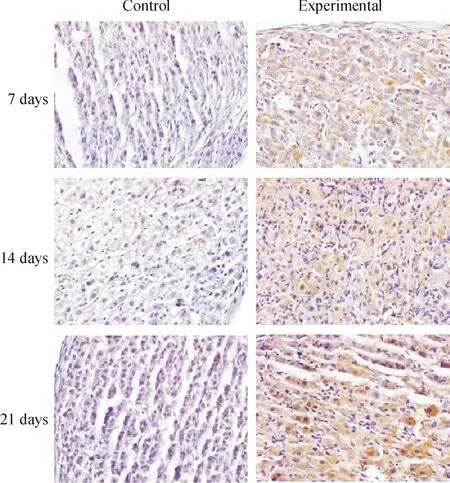
Figure 3. Immunohistochemical staining(×600).The result showed that P53 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.
5模拟失重组雌性大鼠生育功能减低
分别将各对照组和模拟失重组雌性大鼠与雄性Wistar大鼠同笼,计数雌鼠生育仔鼠的数目及仔鼠存活率。结果显示,与各对照组相比,各模拟失重组雌性大鼠生育仔鼠的数目明显减少(Plt;0.05),各模拟失重组雌性大鼠生育的仔鼠存活率明显下降,(Plt;0.01),见表4。
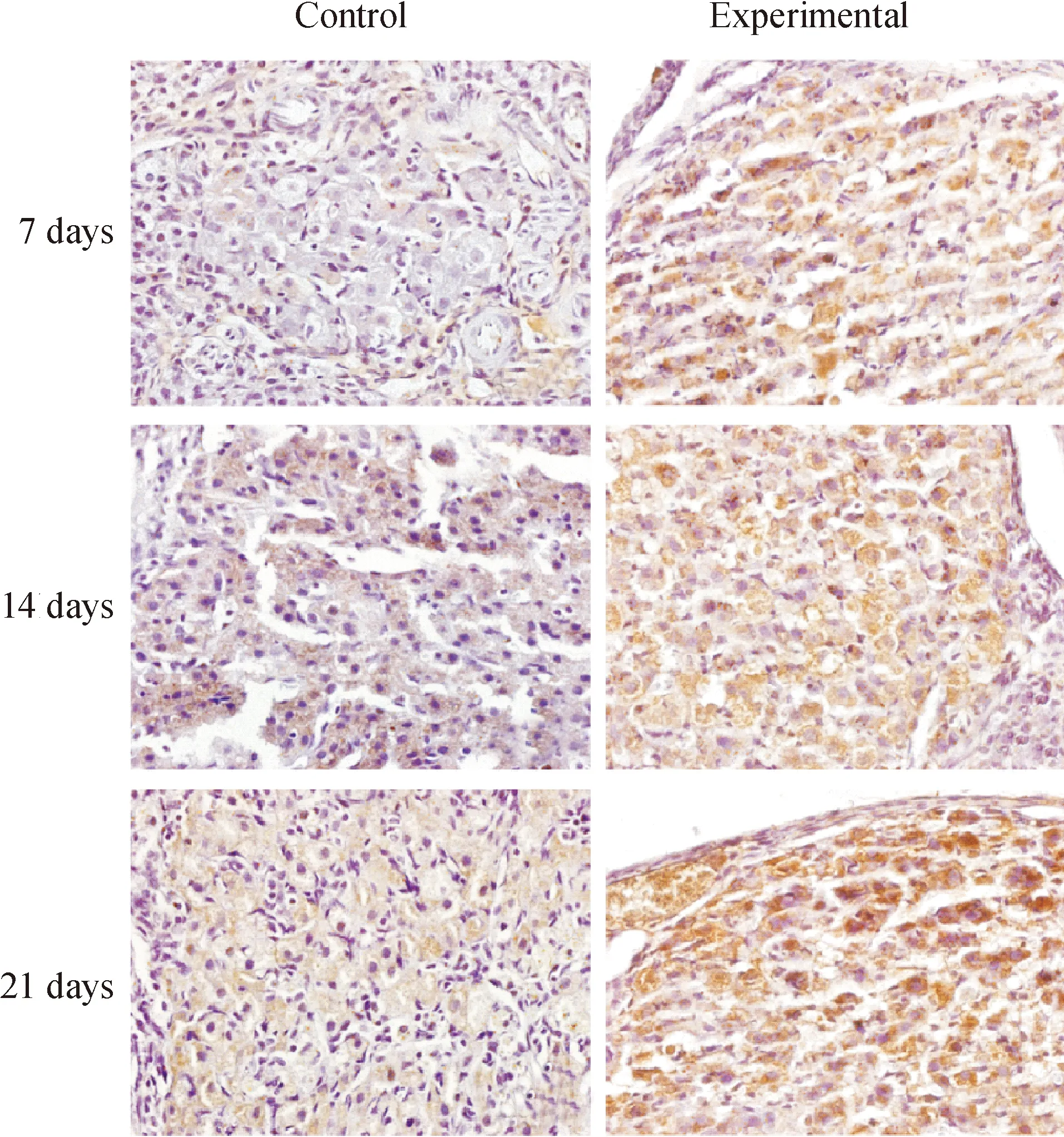
Figure 4. Immunohistochemical staining(×600). The result showed that P16 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.
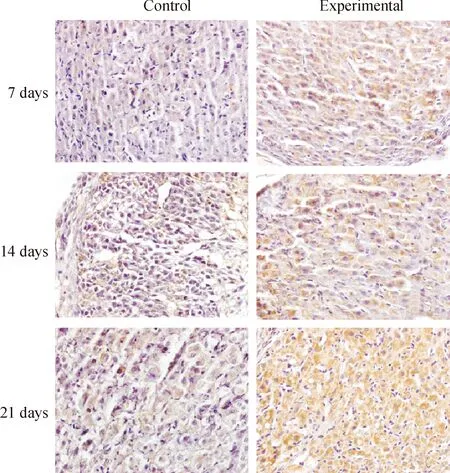
Figure 5. Immunohistochemical staining(×600). The result showed that P21 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.
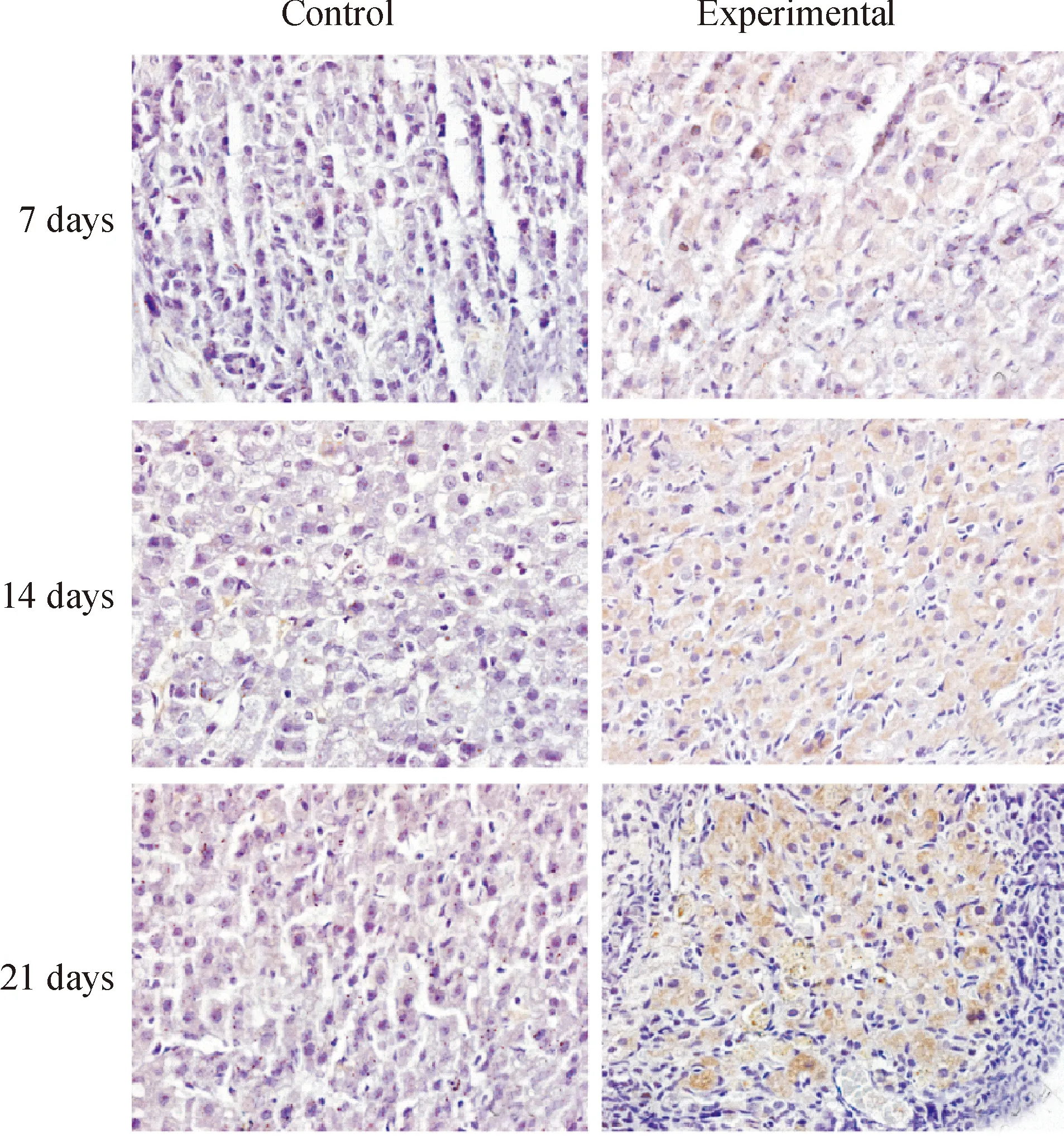
Figure 6. Immunohistochemical staining(×600). The result showed that P27 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.

表3 细胞衰老相关分子P53、P27、P21和P16蛋白表达变化
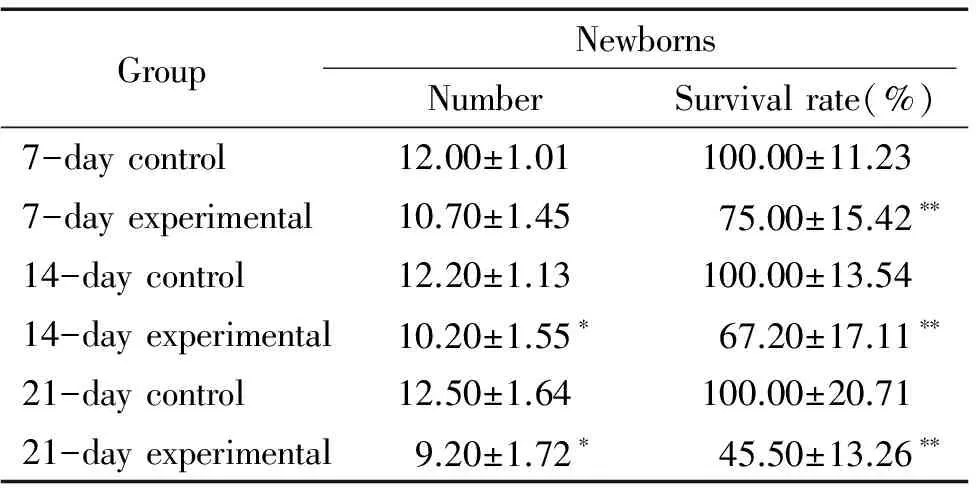
表4 模拟失重对雌性大鼠生育仔鼠数和仔鼠存活率的影响
讨 论
地面模拟失重状态对生命活动规律影响的研究将为太空失重环境的生命保障体系建立提供可借鉴的参考线索。对于人类而言,40岁以前的育龄女性出现卵巢功能减退的现象,称为卵巢早衰(premature ovarian failure,POF),其后果是生育障碍和内分泌功能紊乱,失重状态能否导致卵巢早衰及其发生机制未见研究。
本研究运用鼠尾悬吊法模拟失重状态,研究模拟失重对雌性大鼠卵巢功能的影响及其发生机制。卵巢功能受下丘脑-垂体-卵巢轴内分泌系统调控,我们采用ELISA方法对各组大鼠血清中E2、FSH和LH水平进行了检测,结果显示模拟失重组大鼠较各地面对照组E2水平明显下降,FSH和LH水平上升;血清E2下降是生育力减低的重要原因[6]。卵巢分泌的E2下降通过下丘脑-垂体-性腺轴的负反馈机制导致垂体分泌FSH和LH增加,因此,FSH和LH明显升高也是卵巢功能衰退的表现[7]。我们的研究表明鼠尾悬吊模拟失重可引起下丘脑-垂体-卵巢轴内分泌功能紊乱,卵巢生殖功能衰退。
组织切片HE染色发现模拟失重大鼠卵巢中卵泡数量减少;模拟失重大鼠卵巢组织衰老特异性脂褐素染色阳性率显著高于各对照组,表明模拟失重可导致雌性大鼠卵巢细胞衰老。细胞衰老(cell senescence)是指细胞不可逆地脱离细胞周期并丧失增殖能力后进入的一种相对稳定的衰老状态,但在一段时间内仍存在代谢活性[8]。在这一过程中,端粒缩短、衰老相关的信号分子P53、P16及下游的P21等在其中发挥作用[9]。TERT是端粒酶发挥作用的限速成分,通过TERT的诱导端粒酶被激活,是细胞逃逸衰老的重要环节。细胞周期相关分子P53、P21和P16是启动细胞逃逸衰老程序的重要效应分子。最近研究还发现P27也参与了细胞的衰老进程。为明确鼠尾悬吊模拟失重导致卵巢细胞衰老的分子机制,我们运用逆转录定量PCR(qRT-PCR)和免疫组化技术对上述衰老相关重要分子的表达进行了检测。结果显示,与各正常地面组相比,各尾悬吊模拟失重组TERT的表达受到抑制,而P53、P16、P21和P27的表达则显著上升。这表明鼠尾悬吊模拟失重可导致大鼠卵巢细胞端粒活性下降,细胞周期受阻,细胞发生衰老,进而使生殖功能受损。
卵巢功能受损的重要生物学效应是生育能力下降。为此,我们将各组雌性大鼠与正常雄性大鼠同笼,通过与各对照组大鼠比较,我们发现模拟失重组大鼠生育的仔鼠数量明显减少,更为重要的是仔鼠的死亡率显著上升。由此可见,尾悬吊模拟失重使雌性大鼠的生育能力下降。我们发现鼠尾悬吊模拟失重可通过抑制端粒活性、阻遏细胞周期,诱导雌性大鼠卵巢细胞衰老,同时下丘脑-垂体-卵巢轴内分泌功能紊乱,进而使雌性大鼠的生殖功能受损,该初步研究结果对进一步研究失重与生殖的关系提供了参考性线索。
[1] 周党侠, 邱曙东, 王志勇,等. 尾悬吊状态对性成熟期雄性大鼠生殖功能的影响[J]. 中华男科学杂志, 2006, 12(4): 326-329.
[2] Wronski TJ, Morey-Holton ER. Skeletal response to simulated weightlessness: a comparison of suspension techniques[J]. Aviat Space Environ Med, 1987,58(1):63-68.
[3] Sharma CS, Sarkar S, Periyakaruppan A, et al. Simulated microgravity activates apoptosis and NF-κB in mice testis[J]. Mol Cell Biochem, 2008,313(1-2):71-78.
[4] 王俊锋,刘长庭,李向红,等. 血管内皮生长因子在尾悬吊模拟失重大鼠肺组织中表达的研究[J]. 中国病理生理杂志,2002, 18(11):1392-1395.
[5] Wang KX, Shi Y, Denhardt DT. Osteopontin regulates hindlimb-unloading-induced lymphoid organ atrophy and weight loss by modulating corticosteroid production[J]. Proc Natl Acad Sci USA, 2007, 104(37):14777-14782.
[6] 马灵芝,李 爽,夏 天. 卵巢储备力降低的监测[J]. 现代中西医结合杂志,2010, 19(11):1425-1427.
[7] 彭国庆,钟才高,张 琼,等.甲醛对雌性大鼠卵巢储备功能的影响[J]. 癌变·畸变·突变,2010, 22(1):32-34.
[8] Hayflick L. The limitedinvitrolifetime of human diploid cell strains[J]. Exp Cell Res, 1965, 37(3):614-636.
[9] Majumder PK, Grisanzio C, O’Connell F, et al. A prostatic intraepithelial neoplasia-dependent p27Kip1checkpoint induces senescence and inhibits cell proliferation and cancer progression[J]. Cancer Cell, 2008, 14(2):146-155.
Effectsofweightlessnesssimulatedbytail-ventrofixationonreproductivefunctionsinfemalerats
JIA Mu-tian1, 2, SONG Xin-chen1,2, ZHANG Yi-ming1,2, WANG Li-xiang1
(1DepartmentofPharmacology,ShandongUniversitySchoolofMedicine,Jinan250012,China;2ShandongExperimentalHighSchool,Jinan250001,China.E-mail:wanglx@sdu.edu.cn)
AIM: To investigate the effects of weightlessness simulated by tail-ventrofixation on reproductive functions in female rats and the underlying mechanism, and to provide some clues to health protection for the space explorers.METHODSTo mimic the weightless state, the rat model of tail-ventrofixation was set up. Seventy-two female Wistar rats were randomly divided into 6 groups: 7-day,14-day and 21-day tail-ventrofixation groups and the corresponding 3 control groups without tail-ventrofixation. The levels of estradiol (E2), follicle stimulating hormone (FSH) and luteinizing hormone (LH) in the serum were detected by ELISA. The morphological characters of the ovary were examined under microscope with HE staining. The character of senescence was checked by senescence-specific lipofuscin staininginsitu. The RNA of the ovary was extracted to detect the mRNA expression levels of telomerase reverse transeriptase(TERT),p53, p27,p21 and P16 by qRT-PCR. The protein levels except TERT were also detected by immunohistochemistry. The male Wistar rats cohabited with the female ones to test the quantity and the survival rate of their offspring.RESULTSCompared with the corresponding control groups, the serum level of E2decreased in tail-ventrofixation groups (Plt;0.05). However, the levels of FSH and LH increased (Plt;0.05). At the same time, the number of ovarian follicle in tail-ventrofixation groups reduced compared with the corresponding control groups, and the ovary cells showed the characteristics of senescence. The expression of TERT was inhibited in tail-ventrofixation groups compared with the corresponding control groups not only in the level of mRNA but also of the proteins (Plt;0.05). Meanwhile, the expression of p53, p27 and p16 increased (Plt;0.05). Both the number and the survival rate of offspring rats decreased in tail-ventrofixation groups as compared with the corresponding control groups (Plt;0.01).CONCLUSIONThe state of simulated weightlessness results in decreased reproductive functions in female rats. Simulated weightlessness induces cell senescence and endocrine dysfunction of hypothalamus-pituitary-ovarian axis.
Tail-ventrofixation; Weightlessness; Ovary; Reproduction
1000-4718(2011)04-0769-06
R774.1
A
10.3969/j.issn.1000-4718.2011.04.028
2011-01-21
2011-03-10
△通讯作者 Tel:0531-88382036;E-mail:wanglx@sdu.edu.cn
