丁苯酞对缺氧缺糖条件下血管内皮细胞VEGF和 HIF-1α表达的影响*
2011-11-20殷建瑞谭丽华
殷建瑞, 张 波, 谭丽华, 傅 贤, 魏 欢, 李 玲
(1广州医学院第二附属医院神经内科,广东 广州 510260; 2昆明市延安医院,云南 昆明 650051;3中山大学附属第一医院神经科,广东 广州 510080)
丁苯酞对缺氧缺糖条件下血管内皮细胞VEGF和 HIF-1α表达的影响*
殷建瑞1, 张 波1, 谭丽华1, 傅 贤1, 魏 欢2, 李 玲3△
(1广州医学院第二附属医院神经内科,广东 广州 510260;2昆明市延安医院,云南 昆明 650051;3中山大学附属第一医院神经科,广东 广州 510080)
目的探讨丁苯酞(NBP)保护缺氧缺糖(OGD)细胞损伤的机制。方法对人脐静脉内皮细胞(HUVECs)予以OGD损伤,MTT法检测细胞活性;Hoechst 33342染色检测细胞核形态;免疫荧光法观察血管内皮生长因子(VEGF)和缺氧诱导因子-1α(HIF-1α)表达,IPP软件分析荧光强度,进行定量分析;Western blotting检测加以验证。结果NBP在0.01- 10 μmol/L浓度之间剂量依赖性减少了OGD导致的细胞活性下降和细胞核形态改变。NBP促进了OGD后HUVECs内VEGF和HIF-1α的表达,均高于OGD组,荧光定量分析差异显著。两者表达的高峰分别为OGD后6 h和8 h。结论NBP可以促进内皮细胞在缺氧缺糖条件下HIF-1α的表达,从而引起下游VEGF的表达增多,最终保护内皮细胞免受缺氧缺糖损伤。
丁苯酞; 血管内皮细胞; 缺氧缺糖; 血管内皮生长因子; 缺氧诱导因子-1
左旋丁基苯酞又名芹菜甲素,是从芹菜种籽中分离出的有效成分,根据它的结构式,其异构体右旋丁基苯酞被合成出来。之后它们的混合物消旋丁基苯酞(dl-3-n-butylphthalide,NBP)作为临床药物被发展起来,也称为丁苯酞[1]。 大量的研究证实NBP在治疗脑卒中和其它一些疾病中具有良好效果,而且发现其可能通过多种途径发挥保护作用,如改善供血、保护血脑屏障、抗血栓形成、抗炎症、改善线粒体功能失调等[2-4]。然而,NBP发挥保护作用的具体机制并非完全清楚。阐明NBP对细胞的具体保护机制,可以对NBP进行改进和发展,使此药能够更加有效地发挥保护作用。
材 料 和 方 法
1细胞培养和试剂
人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)(购自上海晶赛公司)培养于含10%胎牛血清(Gibco)的高糖DMEM培养基中,置于37 ℃、90%湿度、含 5% CO2和 95% 空气(V/V) 的培养箱中。
NBP(石家庄恩必普药业有限公司赠送,99.9%临用前使用溶剂DMSO)溶解,再使用细胞培养基稀释至所需浓度。NBP的最终浓度为0.01、0.1、1、10、100 μmol/L。在溶剂对照组中只单独加入溶剂。
2缺氧缺糖(oxygen-glucosedeprivation,OGD)细胞模型
将内皮细胞种植于各种规格的培养皿,先培养24 h。在NBP处理组将培养液换成含有不同浓度NBP的无糖DMEM培养液(其中含0.2%DMSO),在溶剂处理组换为仅含有0.2%DMSO的无糖DMEM培养液,再培养30 min。之后细胞被放置于持续充以95%N2+ 5%CO2混合气体的密封低氧槽中,根据不同实验所需,在37 ℃条件下的细胞培养箱中温育所需时间。 当OGD结束,在移入正常氧压条件前,将培养液换成含有相同浓度NBP或者DMSO的正常培养基。在正常对照组,细胞接受除了无糖培养基或者缺氧处理之外的所有实验操作步骤。
3细胞活性测定
依照测试盒中厂家提供的说明书来测定细胞活性。在OGD结束时,每个细胞培养孔中加入100 μL 0.5 g/L MTT,置于37 ℃、90%湿度、含 5% CO2和 95% 空气(V/V)的培养箱中4 h。培养结束后,小心吸弃培养液,每个孔中加入100 μL溶媒。最后,在酶联免疫仪上,570 nm波长测定各孔吸光度值(A570)。由于只有活细胞线粒体的琥珀酸脱氢酶能使外源性MTT 还原为难溶性蓝紫色结晶物,故各孔A570的变化可间接反映活细胞数量。所有结果来自5次独立实验,每次实验中设3个平行组。
4Hoechst染色
使用Hoechst 33342对OGD后HUVECs进行染色,以检测OGD后细胞核形态的变化。在4孔板中培育细胞,直至生长融合85%左右,在暴露于OGD后,每个培养孔中加入1 μL Hoechst 33342(5 g/L,Sigma)和1 mL的培养基,培育30 min。使用PBS溶液对染色细胞冲洗2次,然后在荧光显微镜下进行观察。为定量分析细胞核形态变化,具有异常胞核的细胞百分数被计数。在10幅随机挑选的40倍放大显微镜视野中的所有细胞均被计数。所有结果来自5次独立实验,每次实验中设3个平行组。
5免疫荧光
将生长于盖玻片上的HUVECs使用新鲜配制的4%多聚甲醛(pH 7.4)固定20min,PBS洗净,使用含1% Triton X-100的PBS破膜30 min,PBS洗净。含5%驴血清的PBS封闭非特异性结合位点30 min,使用以下的Ⅰ抗孵育细胞1 h:兔来源抗内皮细胞生长因子(vascular endothelial growth factor,VEGF)抗体(chemicon),老鼠抗缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)抗体(Abcam),(所有Ⅰ抗均使用3%BSA/PBS 按1∶500稀释)这些结合的Ⅰ抗通过与FITC标记的驴抗兔Ⅱ抗和TR标记的驴抗鼠Ⅱ抗孵育后进行检测(所有Ⅱ抗均使用3%BSA/PBS 按1∶1 000稀释)。PBS冲洗干净后,所有玻片均通过倒置显微镜进行计数和分析。所有的荧光图片均在同样的曝光条件下进行拍摄。为进行核计数染色,所有的细胞均在染色后使用10 g/L DAPI孵育10 min。使用IPP软件分析荧光强度。所有结果来自5次独立实验,每次实验中设3个平行组。
6免疫印迹(Westernblotting)检测VEGF和HIF-1α蛋白表达
处理后的细胞使用PBS洗净,使用含PMSF的细胞裂解液冰上裂解30 min,13 000×g离心10 min(4 ℃),收集上清。按照说明以BCA-100蛋白定量分析试剂盒测定蛋白浓度。蛋白高温变性,加样,5%积层胶和8%分离胶进行跑胶,转膜至PVDF膜,含5%脱脂牛奶的TBS-T封闭1 h,Ⅰ抗4 ℃孵育过夜。TBS-T洗净,Ⅱ抗37 ℃孵育1 h,TBS-T洗净。使用超敏反应盒进行曝光、拍片。
7统计学处理
结 果
1NBP剂量依赖性地减少了OGD导致的细胞损伤
通过MTT法和观察细胞核形态来评估细胞活性。与溶剂对照组相比,在0.01-100 μmol/L浓度之间NBP并不影响HUVECs的细胞活性。OGD处理8 h后,溶剂处理组的相对MTT值是50%,而10 μmol/L NBP组大约为80%,见图1。在0.01-10 μmol/L浓度之间,NBP剂量依赖性地抑制了OGD导致的MTT值下降,见图1。然而10 μmol/L与 100 μmol/L之间的作用无显著差异,说明当NBP的浓度达到10μmol/L时已经是作用的饱和浓度,超过10 μmol/L的浓度不会提高其保护效果。
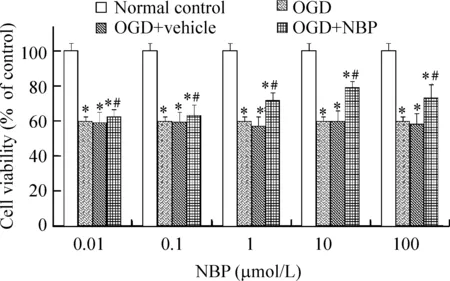
Figure 1. NBP significantly prevents OGD-induced decrease of viability of HUVECs in a dose-dependent manner. s.n=5.*Plt; 0.05 vs normal control; #Plt;0.05 vs OGD+vehicle.
在细胞核形态学分析中,我们也观察到了同样的结果。在OGD处理后出现了核皱缩和核聚集等形态学变化,而这种形态变化在正常细胞中基本是未见的。我们使用NBP预处理后,显著减少了这种形态学变化,见图2。
2NBP对OGD作用后VEGF表达的影响
在正常培养条件下,免疫荧光几乎检测不到HUVECs内VEGF的表达,但经过OGD处理8 h后HUVECs的VEGF表达量明显升高,主要在细胞胞浆中表达,较均匀分布。在OGD+NBP组中,细胞内VEGF生成的量得到更进一步的升高,荧光强度更高,且有表达聚集的现象,见图3。使用IPP图像分析软件进行定量分析,可确定3组间的VEGF表达具有明显差异,见图3。 Western blotting可以观察到相同的蛋白表达趋势,见图3。
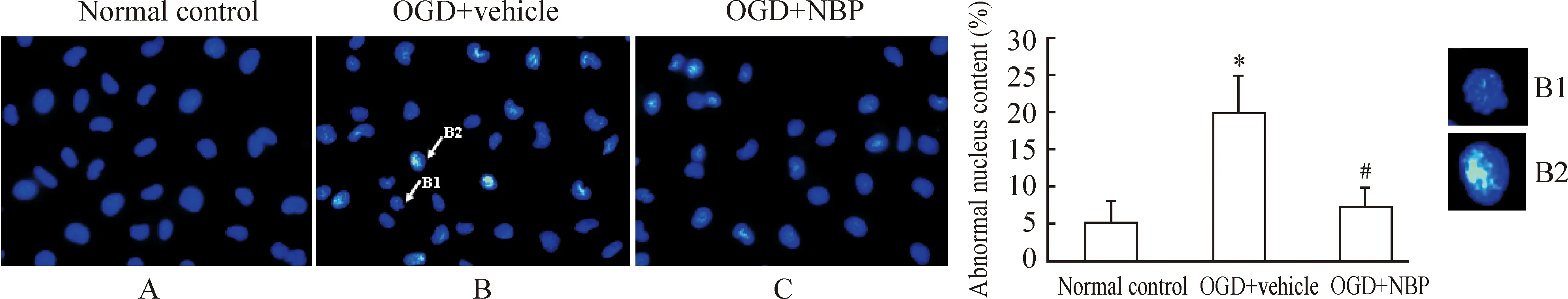
Figure 2. NBP significantly prevents OGD-induced changes of nuclear morphology in cultured HUVECs(Hoechst 33342 staining,×200). There were visible crenation of nuclei (B1,×600) and condensation of chromatin (B2,×600) in HUVECs after OGDtreatment(marked with arrows, B), which were less visible in control cells (A) and obviously improved in the cells pretreated with NBP (10 μmol/L) (C). ±s.n=5.*Plt;0.05 vs normal control; #Plt;0.05 vs OGD +vehicle.
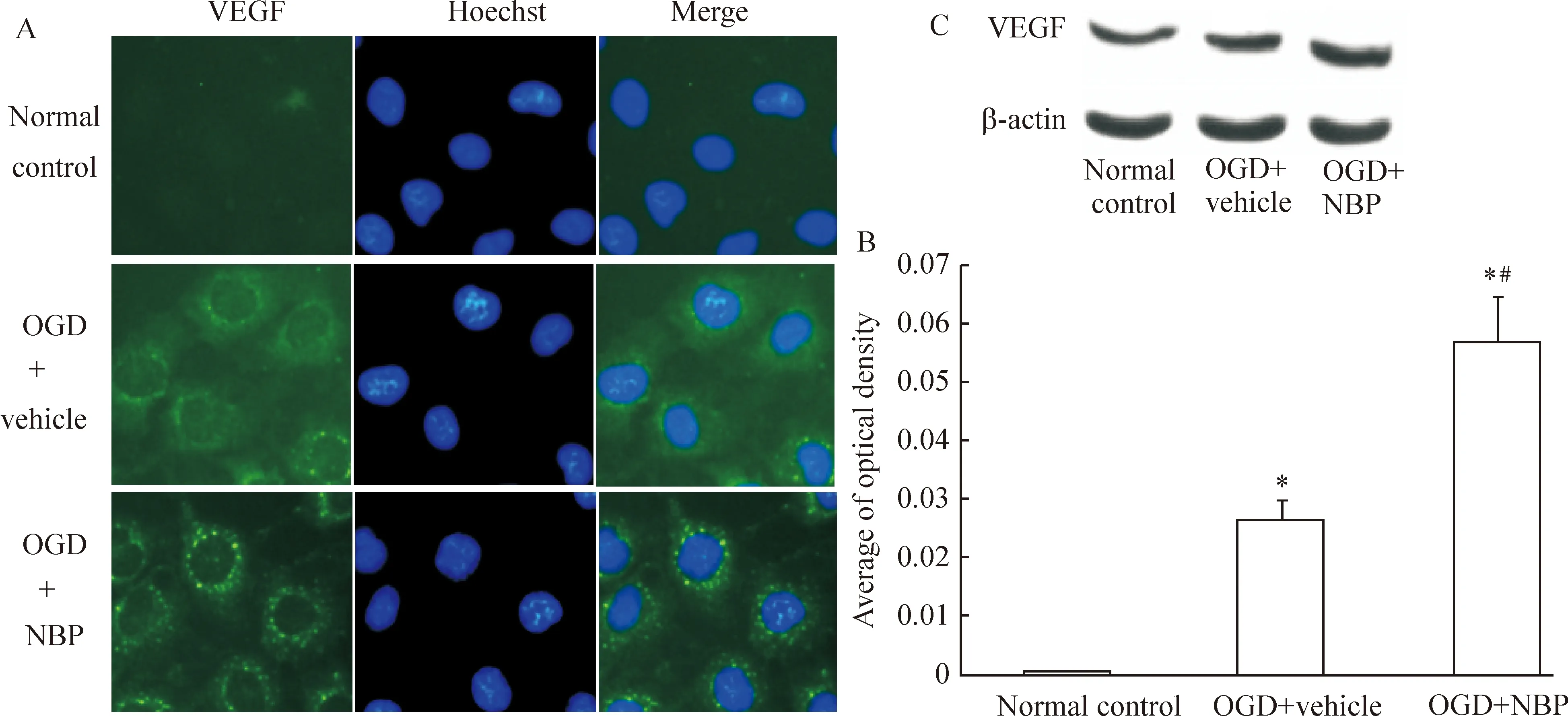
Figure 3. NBP enhances OGD-induced expression of VEGF.A:digital photomicrograph under fluorescent illumination showed the expression of VEGF was mainly in the cytoplasm(×400). B:bar graph showing the average quantitative optical density of VEGF obtained through IPP analysis. The VEGF level was indicated by the value of optical density over the area with fluorescent. C:Western blotting detected the same results. ±s.n=5 *Plt;0.05 vs normal control; #Plt; 0.05 vs OGD +vehicle.
3NBP促进了OGD导致的HIF-1α表达和其在核内的聚集
在正常的培养条件下,几乎检测不到HUVECs内HIF-1α的表达,OGD处理6 h后, HUVECs核内的HIF-1α表达明显增高。在OGD+NBP组中,HIF-1α的免疫荧光强度较单独的OGD处理明显增加,而且聚集在细胞核的位置,见图4。使用IPP图像分析软件进行定量分析,可确定3组间的HIF-1α表达差异显著,见图4。Western blotting可以观察到相同的蛋白表达趋势,见图4。
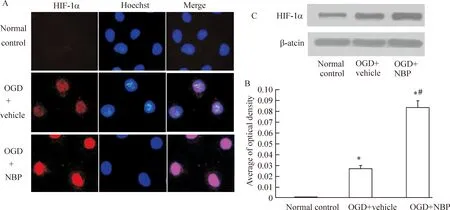
Figure 4. NBP enhances OGD-induced expression of HIF-1α. A:digital photomicrograph under fluorescent illumination showed the expression of HIF-1α was overlapped with the stain of nuclei (×400). B:bar graph showing the average quantitative optical density of HIF-1α obtained through IPP analysis. The HIF-1α level was indicated by the value of optical density over the area with fluorescent.C:Western blotting detected the same results. ±s.n=5.*Plt;0.05 vs normal control;#Plt;0.05 vs OGD +vehicle.
讨 论
大量的研究报道了NBP的积极保护作用[2,6]。在本研究中,我们同样观察到NBP对缺氧缺糖条件下血管内皮细胞的保护作用。虽然发现了如此多的保护作用,但这些结果仅仅揭示了表面现象,我们对于NBP保护缺血脑组织的确切机制并不清楚。
血管内皮细胞在血管再生和血管形态、功能维持中具有重要地位。我们既往的研究发现 NBP可以通过增加脑内微血管数目和逆转其结构改变,从而达到有效减少寒潮时双肾双夹高血压大鼠模型(stroke-prone renovascular hypertensive rats ,RHRSP)脑卒中发生及减轻脑损害[5]。研究结果提示NBP可能作用于血管内皮细胞,从而达到预防脑卒中发生的作用,这为我们探索NBP保护作用的具体机制提供了线索。之后发表的相关研究[7]报道NBP可以促进局灶缺血脑组织和短暂缺血脑组织中VEGF的表达,VEGF是一种促进血管形成和分化的重要调节因子,同时具有神经保护特性[8]。综合分析发表的研究,我们推测NBP可能通过促进血管内皮细胞VEGF的表达进一步促进血管再生,从而发挥保护作用。
VEGF蛋白既可表达于血管内皮细胞,也可表达于多种神经组织细胞[9],之前的研究并未阐明NBP主要是促进何种细胞大量表达VEGF。在本研究中我们发现NBP可以促进OGD条件下血管内皮细胞中VEGF的表达。与正常氧压条件相比较,OGD促进了血管内皮细胞胞浆中VEGF的表达,经过NBP处理后,VEGF的总量得到进一步提高。这一结果与既往大鼠体内研究是一致的[7],同时也揭示了NBP可以直接促进血管内皮细胞大量表达VEGF,从而发挥自分泌作用。
VEGF表达的上游受到多种因子调节,为更深入阐明NBP的作用机制,我们进一步探讨了NBP促进VEGF表达的上游通路。既往研究表明在缺氧条件下HIF-1α可促进血管的再生[10],而HIF-1α也可作为调节因子促进下游VEGF的表达[11]。本研究中我们探讨了NBP是否可以通过上调HIF-1α从而达到促进VEGF的表达。实验结果表明,在缺氧条件下HIF-1α的表达增多而且在细胞核内聚集,NBP可进一步促进这种变化。这一结果与我们观察到的NBP促进缺氧条件下VEGF变化趋势是一致的。基于HIF-1α对VEGF表达的重要调节作用,我们推测NBP通过上调HIF-1α,从而最终促进了VEGF的表达,两者表达的最高峰分别出现在OGD后6h和8h,也支持HIF-1α是NBP促进VEGF表达的重要上游通路。
NBP不仅促进了血管内皮细胞中HIF-1α、VEGF的表达,也提高了血管内皮细胞对缺氧的耐受性,增加了缺氧条件下细胞的存活。既往研究表明在多种损伤条件下,HIF-1α在保护细胞存活中发挥着重要作用[12]。同时VEGF对细胞也具有良好的保护作用[13]。所以NBP可以促进缺氧条件下HIF-1α的稳定和聚集,从而直接保护血管内皮细胞免受缺氧损伤。NBP也可间接通过HIF-1α下游的VEGF产生对血管内皮细胞的保护作用。
综上所述,我们认为NBP可以促进血管内皮细胞在缺氧条件下HIF-1α的表达和在细胞核内的聚集,从而增加下游VEGF的表达,并保护血管内皮细胞免受缺氧损伤。血管内皮细胞分泌的VEGF可作用于细胞自身的VEGF抗体,促进血管再生和血管形态功能的保存,最终达到预防和治疗脑卒中的作用。
[1] Peng Y, Zeng X, Feng Y, et al. Antiplatelet and antithrombotic activity of L-3-n-butylphthalide in rats [J]. J Cardiovasc Pharmacol, 2004,43(6):876-881.
[2] 冯亦璞,胡 盾,张丽英. 丁基苯酞对小鼠全脑缺血的保护作用[J]. 药学学报, 1995,30(10): 741-744.
[3] 熊 杰,冯亦璞. 丁基苯酞对局灶性脑缺血过程中线粒体损伤的保护作用[J]. 药学学报, 2000,35(6):408-412.
[4] 徐皓亮,冯亦璞. 丁基苯酞对局灶性脑缺血大鼠软脑膜微循环障碍的影响[J]. 药学学报, 1999,34 (3):172-175.
[5] Liu CL, Liao SJ, Zeng JS, et al.dl-3n-butylphthalide prevents stroke via improvement of cerebral microvessels in RHRSP[J]. J Neurol Sci, 2007,260(1-2):106-113.
[6] 崔丽英,刘秀琴,朱以诚,等. dl-3-正丁基苯酞治疗中度急性缺血性脑卒中的多中心、随机、双盲和安慰剂对照研究[J]. 中华神经科杂志, 2005,38(4):251-254.
[7] 曹文英, 德吉曲宗, 李其富, 等. 丁基苯酞对大鼠短暂性缺血脑组织VEGF及bFGF 表达的影响[J].四川大学学报(医学版), 2009,40(3) :403- 407.
[8] 李 飞, 李树清. VEGF表达在局灶性脑缺血后亚低温脑保护中的作用研究[J].中国病理生理杂志,2010, 26(10): 2053.
[9] 侯德仁, 薛 俐, 陈 坤, 等. 丁苯酞对阿尔茨海默病模型大鼠海马GFAP和VEGF的影响[J]. 中南大学学报(医学版), 2010,35(2):111-115.
[10]李玉珍,蔡莉蓉,孙 胜,等. 低氧诱导因子-1α参与低氧预处理诱导的心肌血管生成[J].中国病理生理杂志,2005, 21(12): 2301-2304.
[11]江从庆,樊利芳,刁路明,等. 低氧及一氧化氮对SW480 细胞缺氧诱导因子- 1α、VEGF 及iNOS 表达的初步研究[J].中国病理生理杂志,2005, 21(4): 722-726.
[12]Carmeliet P, Dor Y, Herbert J, et al. Role of HIF-1α in hypoxia-mediated apoptosis, cell proliferation and tumor angiogenesis[J]. Nature, 1998,394(6692):485-490.
[13]Carmeliet P, Storkebaum E. Vascular and neuronal effects of VEGF in the nervous system: implications for neurological disorders[J]. Semin Cell Dev Boil, 2002, 13(1) : 39-53.
EffectsofNBPonexpressionofVEGFandHIF-1αinHUVECsundertheconditionofoxygen-glucosedeprivation
YIN Jian-rui1, ZHANG Bo1, TAN Li-hua1, FU Xian1, WEI Huan2, LI Ling3
(1DepartmentofNeurology,SecondAffiliatedHospital,GuangzhouMedicalCollege,Guangzhou510260,China;2Yan’anHospital,Kunming650051,China;3DepartmentofNeurology,FirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:bozhang.1982 @yahoo.com.cn)
AIM: To investigate the mechanism that dl-3-n-butylphthalide (NBP) protects cells from the induced by oxygen-glucose deprivation (OGD).METHODSHuman umbilical vein endothelial cells (HUVECs) were exposed to OGD to induce endothelial damage. Endothelial injury was assessed by measuring the changes of chromatin morphology and MTT method. The protein levels of vascular endothelial growth factor (VEGF) and hypoxia inducible factor-1 alpha (HIF-1α) were determined by immunofluorescence and quantitatively analyzed with the software IPP. Western blotting was applied to verify the results.RESULTSNBP at the concentrations of 0.01 to 100 μmol/L dose-dependently protected against OGD-induced cell damage. Compared with OGD group, NBP enhanced OGD-induced the expression of VEGF and HIF-1α, and the difference was statistically significant. The expression of VEGF and HIF-1α reached to the peak at the time points of 6 h and 8 h after OGD, respectively.CONCLUSIONUnder the condition of OGD, NBP enhances the expression of HIF-1α in HUVECs, subsequently promotes the expression of downstream VEGF, and eventually elevates the survival of the cells.
dl-3-n-Butylphthalide; Vascular endothelial cells; Oxygen-glucose deprivation; Vascular endothelial growth factors; Hypoxia inducible factor-1
1000-4718(2011)04-0643-05
R363
A
10.3969/j.issn.1000-4718.2011.04.004
2010-09-09
2011-03-03
广东省科技计划资助项目(No.2008B080703029);广东省科技计划资助项目(No.2010B080701008);国家自然科学基金资助项目(No.81071069)
△通讯作者 Tel:020-34153252; E-mail: bozhang.1982 @yahoo.com.cn
