3个香蕉品种果实过氧化物酶的特性分析
2011-11-18李健杨昌鹏陈智理郭静婕
李健 杨昌鹏 陈智理 郭静婕


摘要:对3个香蕉品种果实POD的最适pH值与pH值稳定性、最适温度与热稳定性以及化合物的影响进行了比较分析,为控制3个香蕉品种过氧化物酶(POD)引起的酶促褐变提供理论依据。结果表明,威廉斯蕉、大蕉及粉蕉POD最适pH值分别为6.5、5.0、5.5;pH值稳定性范围分别在6.0~9.0、8.0~9.0、5.0~9.0;POD最适温度分别是35、25、30 ℃;POD的耐热性表现为大蕉POD>威廉斯蕉POD>粉蕉POD;威廉斯蕉、大蕉及粉蕉POD活性的最佳抑制剂都是抗坏血酸,其次是盐酸-L-半胱氨酸。
关键词:香蕉;过氧化物酶;特性
中图分类号:S668.1文献标识码:A文章编号:0439-8114(2011)15-3093-04
Characteristic Analysis of Peroxidase from Banana Pulp of Three Cultivars
LI Jian1,2,YANG Chang-peng1,2,CHEN Zhi-li2,GUO Jing-jie2
(1. College of Agricultural, Guangxi University, Nanning 530005,China;
2. Guangxi Agricultural Vocational and Technical College, Nanning 530007, China)
Abstract: The characteristics of POD in fruits of three banana cultivars were studied. In Williams jiao, Da jiao and Fen jiao, the optimum pH for POD activity was respectively 6.5, 5.0, 5.5, and the pH stability range was at pH6.0~9.0, pH8.0~9.0, pH5.0~9.0 respectively. The optimum temperature for POD activity was respectively 35 ℃, 25 ℃, 30℃. The heat tolerance of POD activity was Da jiao >Williams jiao >Fen jiao. The optimum inhibitor of POD activity in all three banana cultivars wasascorbic acid, and then followed by hydrochloride-L-cysteine.
Key words: banana cultivars; peroxidase; characteristics
香蕉为世界“四大水果”之一,世界年产量近1亿t,居全世界水果产量第二位。香蕉属呼吸跃变型水果,成熟后质地柔软,对其长期保鲜或储运比较困难。目前,香蕉仍以鲜食为主,除少量被加工成香蕉干、香蕉粉和香蕉酱外,其他的加工品则很少见,原因是香蕉果实中富含的多酚物质在酚酶(多酚氧化酶和过氧化物酶)的催化下进行氧化还原反应而醌式化,再通过一系列的反应聚合成黑色素[1],影响其加工性能及感观质量,严重制约着香蕉的深加工和综合利用。
过去,大多数学者研究的是引起香蕉酶促褐变的多酚氧化酶(PPO)[2-7],对引起香蕉酶促褐变的过氧化物酶(POD)研究较少,除了对香牙蕉果皮的
POD[8]、果肉的POD[9]有少量报道外,对香牙蕉以外的香蕉品种果实的POD鲜见报道。为此,试验对我国栽培面积较大的香蕉品种威廉斯蕉、大蕉及粉蕉果实POD的最适pH值与pH值稳定性、最适温度与热稳定性、化合物对POD活性影响的相关特性进行分析比较,以期为香蕉品种果实加工原料的选择以及不同香蕉品种果实POD引起的酶促褐变的控制提供理论依据。
1材料与方法
1.1材料
采用八成熟的市售威廉斯蕉(Musa cavendishii L., AAA)、大蕉(Musa sapientum L., ABB)及粉蕉(Musa paradisiaca L.,ABB)。
1.2方法
1.2.1POD的提取将香蕉果实去皮,去除果肉四周的丝络,精确称取50 g果肉,将果肉切成细块状, 按料液比1∶1(m/v,g∶mL)的比例加入含有0.03%果胶酶和3% Tween80的磷酸盐缓冲溶液(0.1 mol/L,pH值7.0),一起打浆40 s后,置于40 ℃水浴中酶解90 min,除去果胶物质,取出用纱布过滤后,再在
10 000 r/min、2 ℃条件下离心20 min,收集上清液作为POD的粗酶提取液。
1.2.2POD的测定采用杨昌鹏等[9]的方法,用分光光度计比色法测定香蕉果实POD活性。反应液由3.8 mL磷酸盐缓冲液(0.1 mol/L,pH值7.0)、0.5 mL 愈创木酚-乙醇溶液(0.1mol/L)、0.5 mL过氧化氢(0.3%)和0.2 mL酶液组成。在30 ℃下反应5 min,于470 nm 波长下测定其吸光值的变化。以每毫升酶液每分钟吸光度改变0.1为1个酶活性单位(U)。
1.2.3pH值对香蕉POD活性及稳定性的影响
1)pH值对威廉斯蕉、大蕉及粉蕉POD活性影响的测定。分别用pH值3.0、4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0、11.0的混合缓冲溶液取代0.1 mol/L pH值7.0的磷酸盐缓冲溶液,测定威廉斯蕉、大蕉及粉蕉果实的POD活性。以吸光值最大处酶活性为100%,计算出其他pH值的相对活性,绘出相对酶活性曲线,从而判定其POD的最适pH值。
2)pH值对威廉斯蕉、大蕉及粉蕉POD稳定性的测定。分别取2 mL pH值3.0~11.0的各种混合缓冲溶液,再分别加入0.5 mL威廉斯蕉、大蕉及粉蕉酶液,放置在冰箱内72 h后,再取2 mL 0.1 mol/L pH值7.0的磷酸盐缓冲溶液和1 mL处理过的各酶液相混合,测定威廉斯蕉、大蕉及粉蕉果实的POD残存的酶活性。以吸光值最大处活性为100%,计算出其他pH值处理条件下POD的相对酶活性。
1.2.4温度对香蕉POD活性及稳定性的影响
1)温度对威廉斯蕉、大蕉及粉蕉POD活性影响的测定。将酶促反应混合液分别置于20、25、30、35、40、50、60、70 ℃水浴下反应5 min,测定威廉斯蕉、大蕉及粉蕉果实POD活性。以吸光值最大处酶活性为100%,计算出其他温度的相对活性,绘出相对酶活性曲线,并判定其POD的最适温度。
2)威廉斯蕉、大蕉及粉蕉POD的热稳定性测定。将提取的酶液分别在30~100 ℃水浴加热10 min和30 min,冷却后测定威廉斯蕉、大蕉及粉蕉果实POD的残余酶活性。以吸光值最大处活性为100%,计算出其他温度处理条件下的相对POD活性。
1.2.5化合物对香蕉果实POD活性的影响
用于研究的化合物分别有氯化钠、柠檬酸、植酸、亚硫酸氢钠、抗坏血酸、盐酸-L-半胱氨酸、EDTA-Na2、氟化钠、氯化镁、硫酸铜、乙酸锌、氯化锰、氯化钙等。
测定化合物对香蕉果实POD活性影响时,用3.3 mL的磷酸盐缓冲溶液(0.1 mol/L,pH值7.0)和0.5 mL的一定浓度的上述化合物取代POD酶活性测定反应体系中的3.8 mL磷酸盐缓冲溶液(0.1 mol/L,pH值7.0),在470 nm波长下测定其反应物吸光值的变化,再分别计算出威廉斯蕉、大蕉及粉蕉POD活力。以在酶活性测定反应体系中不添加任何化合物测得的香蕉果实POD的酶活性为100%,分别计算出添加各种化合物后反应体系的香蕉果实的相对POD活性。
2结果与分析
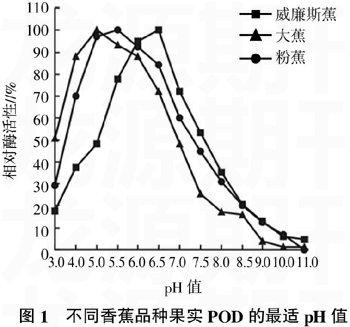
2.1威廉斯蕉、大蕉及粉蕉果实POD最适pH值及其稳定性
威廉斯蕉、大蕉及粉蕉POD与最适pH值的关系见图1。由图1可以看出,威廉斯蕉、大蕉及粉蕉POD最适pH值分别是6.5、5.0、5.5。威廉斯蕉POD最适pH值与杨昌鹏等[9]报道的巴西蕉果肉POD最适pH值相同,比香蕉皮POD最适pH 值6.0[8] 略高。
威廉斯蕉POD在峰值过后,pH值7.0时活性快速下降至72.06%,而大蕉及粉蕉POD活性下降速度则相对较慢,由此可见,威廉斯蕉POD对pH值变化的敏感性高于粉蕉POD和大蕉POD。
当pH值为3.0时,威廉斯蕉、大蕉及粉蕉的POD活性分别是其最大活性的17.65%、50.67%、29.43%;当pH≥9.0时,三者的POD活性远低于其最大活性,由此可知,低酸能较好地抑制威廉斯蕉POD的活性,也对香蕉PPO活性有较好的抑制效果[3];低酸对粉蕉POD活性也有一定的抑制效果,但对大蕉POD抑制效果较差;而当pH≥9.0时,都能较好地抑制三者的POD活性。生产上若采用低酸度处理威廉斯蕉、粉蕉原料及其加工制品,应该可以有效控制威廉斯蕉果肉由PPO和POD共同引起的酶促褐变。
威廉斯蕉、大蕉及粉蕉POD活性的pH值稳定性曲线如图2所示。由图2可以看出,威廉斯蕉、大蕉及粉蕉POD的pH值稳定范围分别是6.0~9.0、8.0~9.0、5.0~9.0,三者POD活性的pH值稳定性范围依次是:粉蕉>威廉斯蕉>大蕉。其中威廉斯蕉POD粗酶的pH值稳定范围与巴西蕉果肉POD纯酶的接近[9]。大蕉POD在pH≤5.0时活性较低,之后随着pH值增大活性快速上升,在pH值8.0时达到峰值,而后又快速下降,表现为波动较大,pH值稳定性较差。
2.2威廉斯蕉、大蕉及粉蕉果实POD的最适温度及其热稳定性
威廉斯蕉、大蕉及粉蕉POD活性与最适温度的关系见图3。由图3可以看出,威廉斯蕉、大蕉及粉蕉POD活性最适温度分别是35、25、30 ℃,其中威廉斯蕉POD粗酶最适温度与杨昌鹏等[9]报道的巴西蕉果肉POD纯酶最适温度相同,比香蕉皮POD最适温度30 ℃[7]稍高。
图4显示了威廉斯蕉、大蕉及粉蕉POD的热稳定性。由图4可以看出,70 ℃加热30 min,大蕉POD保持最大活性;80 ℃加热10 min,威廉斯蕉POD、大蕉POD仍残存25%左右的活性,而粉蕉POD基本失活;100 ℃加热30 min,威廉斯蕉POD、大蕉POD残存活性分别保持14.45%、18.28%,仍然不易完全失活,这与杨昌鹏等[9]报道的90 ℃高温加热条件下,巴西蕉果肉POD仍然不易完全失活相符。由此可见,大蕉POD的热稳定性较高,3个蕉类品种的POD耐热性表现为大蕉>威廉斯蕉>粉蕉。
威廉斯蕉POD粗酶在60 ℃加热10 min,其残存活性是57.58%,而杨昌鹏等[9]报道的巴西蕉POD纯酶在60 ℃加热10 min,其残存活性已低于10%。可见,威廉斯蕉POD粗酶的热稳定性高于其POD纯酶的热稳定性。类似的有王瑧等[10]的报道。
2.3化合物对威廉斯蕉、大蕉及粉蕉果实POD活性的影响
不同化合物对威廉斯蕉、大蕉及粉蕉果实POD 活性的影响如表1所示。从表1可以看出,10 mmol/L的盐酸-L-半胱氨酸、抗坏血酸对威廉斯蕉POD活性有较显著的抑制效果。因此,威廉斯蕉POD最佳抑制剂是抗坏血酸,其次是盐酸-L-半胱氨酸,这与杨昌鹏等[9]报道的相符;再次是低浓度EDTA-Na2、10 mmol/L亚硫酸氢钠对威廉斯蕉POD活性也有一定的抑制效果;但是10 mmol/L EDTA-Na2、低浓度的亚硫酸氢钠以及氯化钠、柠檬酸、植酸、氟化钠、氯化镁则对威廉斯蕉POD活性无明显影响;而乙酸锌、氯化锰、硫酸铜、氯化钙则对威廉斯蕉POD有明显的激活作用,其中以乙酸锌的激活作用最为显著。
10 mmol/L的盐酸-L-半胱氨酸和抗坏血酸对大蕉POD活性有较显著的抑制效果,因此大蕉POD的最佳抑制剂也是抗坏血酸,其次是盐酸-L-半胱氨酸;10 mmol/L亚硫酸氢钠对大蕉POD活性也有一定的抑制效果;但是低浓度的亚硫酸氢钠以及氯化钠、柠檬酸、植酸、氟化钠、氯化镁、EDTA-Na2则对大蕉POD活性无明显影响;而乙酸锌、氯化锰、硫酸铜、氯化钙对大蕉POD有明显的激活作用,其中以氯化锰的激活作用最为显著。
10 mmol/L的盐酸-L-半胱氨酸和10、1、0.5 mmol/L抗坏血酸对粉蕉POD活性均有显著的抑制效果,因此粉蕉POD的最佳抑制剂也是抗坏血酸,其次是盐酸-L-半胱氨酸;10 mmol/L的亚硫酸氢钠对大蕉POD活性也有一定的抑制效果;但是低浓度的亚硫酸氢钠以及氯化钠、柠檬酸、植酸、氟化钠、EDTA-Na2、氯化镁则对粉蕉POD活性无明显影响;而乙酸锌、氯化锰、硫酸铜,氯化钙对粉蕉POD同样有明显的激活作用,其中以乙酸锌的激活作用最为显著。
3结论与讨论
威廉斯蕉、大蕉及粉蕉POD最适pH值分别是6.5、5.0、5.5,威廉斯蕉POD对pH值变化的敏感性高于粉蕉和大蕉。其中威廉斯蕉POD粗酶最适pH值与巴西蕉果肉POD纯酶最适pH值相同,比香蕉皮POD最适pH值略高。
威廉斯蕉、大蕉及粉蕉POD的pH值稳定范围分别是6.0~9.0、8.0~9.0、5.0~9.0,三者POD活性的pH值稳定性范围依次是粉蕉>威廉斯蕉>大蕉。其中威廉斯蕉POD粗酶的pH值稳定范围与巴西蕉果肉POD纯酶的接近。
威廉斯蕉、大蕉及粉蕉POD的最适温度分别是35、25、30 ℃,其中威廉斯蕉POD粗酶最适温度与巴西蕉果肉POD纯酶的相同,比香蕉皮POD最适温度稍高。
3个香蕉品种的POD耐热性表现为大蕉>威廉斯蕉>粉蕉。威廉斯蕉POD粗酶的热稳定性高于其POD纯酶的热稳定性。
威廉斯蕉、大蕉及粉蕉POD的抑制剂基本一致,即威廉斯蕉、大蕉及粉蕉POD活性的最佳抑制剂都是抗坏血酸,其次是盐酸-L-半胱氨酸;低浓度的亚硫酸氢钠以及氯化钠、柠檬酸、植酸、氟化钠、EDTA-Na、氯化镁对威廉斯蕉、大蕉及粉蕉POD活性无明显影响;乙酸锌、氯化锰、硫酸铜、氯化钙对威廉斯蕉、大蕉及粉蕉POD有明显的激活作用;其中乙酸锌对威廉斯蕉、粉蕉POD激活作用最为显著,而氯化锰对大蕉POD激活作用最为显著。
试验采用威廉斯蕉、大蕉及粉蕉果肉POD的粗酶液进行研究,还未进一步开展大蕉、粉蕉POD纯化试验及其纯酶特性的研究,这方面的试验研究有待进一步开展。
生产上如果采用可食性盐酸-L-半胱氨酸、抗坏血酸处理威廉斯蕉、大蕉及粉蕉原料及其加工制品,应该可以有效地抑制香蕉果实由POD引起的香蕉酶促褐变,但实际抑制效果如何,还有待进一步的研究。
参考文献:
[1] MONTGOMERY M W, SGARBIERI V C. Isoenzymes of banana polyphenol oxidase[J]. Phytochemistry,1975,14(4):1245-1249.
[2] FUJITA S, YANG C P, MATSUFUJI K, et al. Changes of polyphenol oxidase of banana (Musa sapientum L.) fruits during ripening treatment by ethylene[J]. Food Preservation Science, 2001,27(2):79-82.
[3] YANG C P, FUJITA S, ASHRAFUZZAMAN M D, et al. Partial purification and characterization of polyphenol oxidase from banana (Musa sapientum L.) pulp[J]. Agriculture Food Chemistry,2000,48(7):2732-2735.
[4] YANG C P, FUJITA S, KOHNO K, et al. Partial purification and characterization of polyphenol oxidase from banana (Musa sapientum L.) peel[J]. Agriculture Food Chemistry,2001,49(3):1446-1449.
[5] YANG C P, NONG Z R., LU J L, et al. Banana polyphenol oxidase: occurrence and change of polyphenol oxidase activity in some banana cultivars during fruit development[J]. Food Science Technology,2004,10(1):75-78.
[6] 李光磊,惠明,王清德, 等. 香蕉中多酚氧化酶特性探讨[J]. 粮油加工与食品机械,2001(6):28-29.
[7] 张勇,池建伟,温其标,等. 香蕉酶促褐变的研究[J]. 食品科学,2004,25(3):45-48.
[8] 鲍金勇,赵国建,梁淑如,等. 香蕉皮多酚氧化酶和过氧化物酶特性的研究[J]. 食品科技,2005(11):17-20.
[9] 杨昌鹏,罗菊珍,郭静婕,等.香蕉果肉过氧化物酶初步纯化及特性研究[J]. 安徽农业科学,2008,36(36):16148-16150.
[10] 王瑧,廖祥儒,张建国,等. 女贞果实过氧化物酶的纯化及热稳定性研究[J]. 河北农业大学学报,2007,30(5):23-27.
