高效液相色谱法测定辅酶Q10冻干乳在大鼠体内血药浓度及其初步药动学研究
2011-11-17冯秀珍丁燕飞丁劲松
冯秀珍,丁燕飞,丁劲松,姚 瑶
(1.中南大学 药学院,湖南 长沙 410013;2.湖南省常德市药品检验所,湖南 常德 415000)
辅酶Q10是广泛存在于各类细胞中的脂溶性类维生素物质,是人体内不可缺少的内源性物质,临床上广泛应用于心肌梗死、慢性或充血性心力衰竭、高血压、糖尿病、帕金森病、癌症及艾滋病等的辅助治疗[1]。辅酶Q10冻干乳剂是可供注射用的新剂型,具有载药量大、稳定、便于贮存运输等优点[2-4]。本实验建立测定大鼠体内辅酶Q10血药浓度方法,并对辅酶Q10冻干乳在大鼠体内药动学作初步研究。
1 材料
辅酶Q10对照品(中国药品生物制品检定所,批号:611-200102);辅酶Q10冻干乳(中南大学药剂教研室制备);维生素K1(安徽万和制药有限公司);无水乙醇、甲醇为色谱纯,其他试剂均为分析纯。
SHIMADZU LC-2010AHT型高效液相色谱仪、UV/Vis检测器、Lc-solution工作站(日本岛津)。
Wastar大鼠,雄性,上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2007-005。
2 方法与结果
2.1 色谱条件
色谱柱:Hypersil BDS C18柱(4.6 mm×200 mm,5 μm);流动相:甲醇 - 无水乙醇(30∶70);柱温30℃;检测波长:275 nm;进样量:20μL。内标为含约1.5μg/mL维生素K1的无水乙醇溶液。
2.2 给药方案及大鼠血样采集
取健康成年Wastar大鼠12只,雄性,随机分配成2组(冻干乳组、空白组),每组6只,实验前禁食12 h,自由饮水,按0.8mg/kg剂量尾静脉注射给药,于给药前和给药后0.125,0.25,0.5,1,2,4,8,12,24 h眼眶静脉取血约250μL,3 000 r/min离心2 min,取血浆于-20℃保存。每取4个时间点血样,灌胃给予大鼠生理盐水2mL,以保持血容量。
2.3 对照品溶液的配制
精密称取辅酶Q10对照品9.87mg,加无水乙醇溶解并稀释至100mL,得对照品贮备液。再用无水乙醇稀释成含辅酶 Q100.17,0.33,0.67,1.34,2.68,5.36,10.73和21.46 μg/mL 的系列标准溶液。
2.4 血浆样品处理
取血浆100μL,加入内标溶液50μL,30℃水浴吹干,加萃取液[正已烷-无水乙醇(8∶1)混合液]4mL,涡旋混合60 s后2 000 r/min离心5 min,吸取上层萃取液3.0mL于离心管中,置30℃水浴上吹干,加无水乙醇100μL溶解即得。
2.5 方法专属性
取2.4项下处理好的空白大鼠血浆样品、空白大鼠血浆加对照品及内标样品、给药后的大鼠血浆样品以及含对照品和内标的溶液分别进样,记录色谱图,结果表明辅酶Q10及内标与血浆中杂质分离良好,内源性物质不干扰测定,结果见图1。
2.6 线性范围和定量下限
分别取辅酶Q10系列标准溶液100μL,加入空白血浆100μL后,按2.4项下自加入内标起操作并进样,以辅酶Q10峰面积与内标峰面积之比R为纵坐标,辅酶Q10浓度C为横坐标绘制标准曲线,得标准曲线回归方程:R=1.365 7 C+0.029 4(r=0.999 8,n=6)。最低定量浓度为0.17 μg/mL,RSD(n=6)为5.35%。
2.7 萃取回收率
分 别取2.3项下含辅酶Q105.3 6,1.34,0.33μg/mL的标准溶液各5份,每份取100 μL,加入空白血浆100μL后,按2.4项下自加入内标起操作;同时取上述相同浓度辅酶Q10标准溶液加入内标溶液,不经萃取直接氮气吹干,用前加100μL无水乙醇溶解。分别进样,计算辅酶Q10与内标的回收率。3种浓度血浆样品辅酶Q10的萃取回收率分别为:(92.09±2.59)%,(89.39±2.38)%,(93.80±1.46)%(n=5);内标的萃取回收率分别为(93.27±1.41)%,(94.56± 2.69)%,(95.16± 1.42)%(n=5)。结果表明辅酶Q10与内标萃取回收率较高且差别不大,符合血样测定要求。

图1 高效液相色谱图Fig.1 HPLC chromatograms
2.8 方法回收率和精密度
取含辅酶 Q105.36,1.34,0.33 μg/mL 的标准溶液,加入空白血浆100μL后,按2.4项下自加入内标起同法操作,每个浓度各配制5份,连续测定5 d,计算回收率及日内、日间精密度。3种浓度血浆样品辅酶Q10的回收率分别为:(102.0±8.86)%,(102.6±5.28)%和(97.8±3.79)%(n=5),方法精密度见表1。
2.9 稳定性考察
将含辅酶 Q105.36,1.34,0.33 μg/mL 的血样于-20℃放置,冷冻-融化循环3次,实验中均无明显降解。将3种浓度的辅酶Q10血样配制后放置12 h内稳定。将3种浓度的辅酶Q10血样-20℃放置10 d后,辅酶Q10浓度变化不大,浓度测定结果的RSD均小于7%。
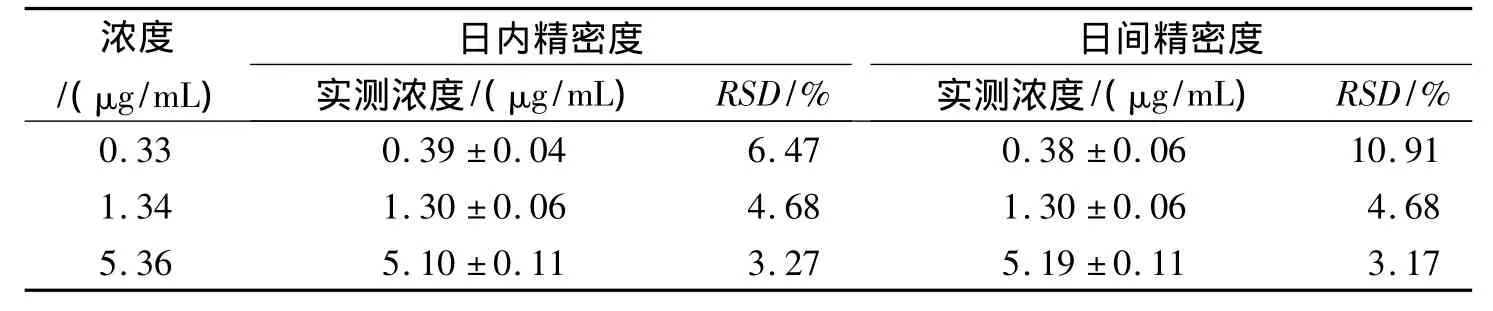
表1 精密度测定结果(n=5)Tab.1 Result of intra-day and inter-day precision(n=5)
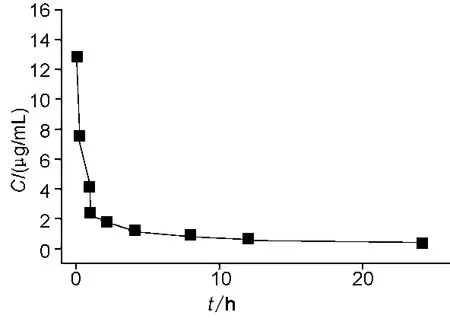
图2 注射给药后辅酶Q10平均血药浓度-时间曲线Fig.2 Mean plasma concentration-time curve of CoQ10 in rats after iv coenzyme Q10 in lyophilized emulsion
2.10 血浆样品测定及初步药动学测定结果
12只大鼠按2.2项下给药及采集血样后,再按2.4项下处理,进样分析,测得平均血药浓度-时间曲线见图2。
血药浓度-时间数据利用DAS 2.1.1版药动学分析软件处理。结果表明,静注辅酶Q10冻干乳后辅酶Q10在大鼠体内的药动学行为符合二室开放模型。求得药动学参数如下:t1/2α为(0.15±0.04)h,t1/2β为(6.31±2.84)h,K10为(0.84±0.15)h-1,K12为(3.90± 1.83)h-1,K21为(0.39± 0.65)h-1,AUC0-24为(22.80±5.42)(μg·h)/mL,AUC0-∞为(26.82±6.70)(μg·h)/mL。
3 讨论
6只空白大鼠与制剂同时间点取样,同法测定各取样时间点内源性辅酶Q10浓度,在各时间点均未检测出明显内源性辅酶Q10。大鼠血浆中主要含辅酶Q9[5],空白内源性辅酶Q10的量本实验方法灵敏度范围内未检出,因此实验中未考虑内源性辅酶Q10的影响。
有报道,萃取时分别加入无水乙醇及正已烷,然后进行萃取操作[5],本实验将无水乙醇及正已烷按比例混合后一次加入,减少操作步骤,同时经比较两种方法测定结果没有明显差异。
选用正已烷-无水乙醇为萃取溶剂[6],考察了不同比例(5∶1,6∶1,7∶1,8∶1,9∶1,10∶1,11∶1,12∶1)的萃取效果。结果表明,无水乙醇比例增加,萃取效率提高,但乳化严重,管壁上固体物多,正已烷层与醇水混合层界面不清晰。当大于9∶1时,萃取效率急剧下降,8∶1时萃取效率最高,油水界面最清晰,不发生乳化。因此选择正已烷-无水乙醇(8∶1)为萃取溶剂。
文献报道测定辅酶Q10血样时采用辅酶Q9作为内标[7],因大鼠血中含内源性辅酶Q9,干扰测定,我们选用维生素K1作为内标,测定结果良好,内标放置稳定,处理过程中不降解。
由于辅酶Q10脂溶性强、乳剂可被动靶向于含巨噬细胞丰富的组织如肝、脾、淋巴等器官,因此辅酶Q10冻干乳注射给药后快速分配,t1/2α较小。
[1]钱 雪,王祖巧,韩国平.辅酶Q10的药理与应用[J].食品与药品,2006,8(1):16-19.
[2]丁燕飞,姚 瑶,陶昱斐,等.辅酶Q10亚微乳注射剂的制备及其性质研究[J].中南药学,2007,5(5):448-451.
[3]冯秀珍,姚 瑶,丁燕飞,等.高效液相色谱法测定注射用辅酶Q10冻干乳含量及有关物质[J].中南药学,2008,6(3):298-230.
[4]李玉林,董 志,彭 力,等.辅酶Q10冻干乳剂的研究[J].中国生化药物杂志,2009,30(5):305-308.
[5]Ernster L,Dallner G.Biochemical,physiological and medical aspects of ubiquinone function[J].Biochim Biophys Acta,1995,1271(1):195-204.
[6]肖淑华,魏广力,陆 榕,等.辅酶Q10片的人体生物利用度研究[J].中国临床药理学与治疗学,2000,5(1):39-41.
[7]张伟英,李士敏,王彤文,等.辅酶Q10片药动学与人体相对生物利用度试验[J].中国医院药学杂志,2004,24(9):257-259.
