纳米银生物海绵的制备及抗菌性能
2011-11-17李东红刁俊林刘建仓
李东红,刁俊林,刘建仓,胥 婷
(创伤、烧伤、复合伤国家重点实验室,第三军医大学 大坪医院野战外科研究所第二研究室,重庆 400042)
为提高敷料的抗菌性能,人们进行了大量的尝试,研究发现银原子具有一定的杀菌能力,尤其是当被制成纳米级的颗粒后,由于其比表面积大幅提高,表面原子所占比例增大,其杀菌活性也相应提高[1-4]。由于纳米银的这些特点,纳米银敷料的研制受到人们的关注。如姜会庆等[5]将纳米银材料种植附着在棉纱纤维上制得一种纳米银敷料,用于治疗烧伤创面及久治不愈的褥疮收到了良好效果。本文报道了一种载纳米银生物海绵的制备方法及其对金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌的抑制能力,为其作为新型抗菌生物敷料用于临床提供实验依据。
1 材料
壳聚糖(台州康多海洋生物医药化工有限公司);海藻酸钠、戊二醛、硝酸银(国药集团上海化学试剂有限公司);胶原蛋白(北京嘉康源化学试剂有限公司);可吸收性明胶海绵(南京金陵制药厂);水解酪蛋白琼脂板(温州市康泰生物科技有限公司)。
金黄色葡萄球菌(ATCC25922)、大肠埃希菌(ATCC25923)和铜绿假单胞菌(ATCC27853)均由第三军医大学第三附属医院检验科提供。
SD大鼠,STF级,雌雄不拘,体重200~225 g,由第三军医大学第三附属医院野战外科研究所实验动物中心提供,合格证号:SCXK(渝)2007-0005。
2 方法
2.1 生物海绵及纳米银生物海绵的制备
将一定比例的壳聚糖、海藻酸钠和胶原蛋白混合胶液用戊二醛交联,冷冻干燥后得生物海绵;将一定量的硝酸银溶液加入一定比例的壳聚糖、海藻酸钠和胶原蛋白的混合胶液中,戊二醛交联,冷冻干燥,100℃烘烤4 h,紫外线照射2 h后形成纳米银生物海绵。
2.2 纳米银粒径的测定
样品表面镀金后,用场发射扫描电镜(FEI NOVA nano SEM 400)对该纳米银生物海绵表面纳米银的粒径进行分析(加速电压:10 kV;工作距离:5.0 mm)。
2.3 体外抑菌效果的测定
将生物海绵、纳米银生物海绵和可吸收性明胶海绵擀压成薄片,裁剪成直径为6 mm的圆片,紫外线照射杀菌。将细菌配制成1.5×108个/mL的菌液,用灭菌后的棉拭子蘸取菌液,反复、均匀地涂布于整个水解酪蛋白琼脂板上,用镊子取海绵平贴在平板表面,37℃孵箱中培养24 h,用游标尺测量抑菌圈大小。
2.4 在体抑菌效果的测定
将30只SD大鼠背部作为致伤部位,伤前1 d用8%Na2S去毛。3%戊巴比妥钠腹腔注射麻醉后,将大鼠俯卧固定于手术台上,背部用碘酒和75%酒精消毒,于正中剪去大约1.5cm×1.5 cm的皮肤(深至肉膜)制成受伤创面,用无菌棉拭子擦去血液后,在创面涂抹金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌的混合菌液(混合前,各菌液均为1.0麦氏浓度),然后在创面上覆盖受试海绵,再以无菌脱脂纱布覆盖海绵,包扎固定。随机分成两个组,可吸收性明胶海绵组和纳米银生物海绵组,每组各15只大鼠,分别于致伤后1,2,3,7和14 d开启敷料(中途如有敷料脱落,及时更换),观察创面的大体情况,少量生理盐水冲洗创面后,用无菌棉拭子擦刮痂下组织渗液,作细菌培养,鉴定细菌的种属和数量。
3 结果
3.1 海绵中纳米银的粒径
扫描电镜观察发现,在生物海绵表面弥散分布有纳米银颗粒,呈球形,颗粒尺寸大小不一,分布范围为20~80 nm,但大约85%的纳米银颗粒的粒径为40 nm,结果见图1。
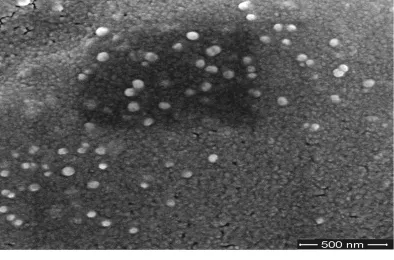
图1 载纳米银生物海绵SEM图Fig.1 SEM of bio-sponge loading Ag nanoparticle
3.2 体外抗菌实验结果
如图2所示,可吸收性明胶海绵和生物海绵对金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌三个菌种都没有产生抑菌圈,而纳米银生物海绵对三个菌种都有一定的抑制作用,对金黄色葡萄球菌和大肠杆菌的抑菌能力稍弱一点,可产生10~11 mm的抑菌圈(包括海绵的直径),而对铜绿假单胞菌的抑制作用明显,可产生13~14 mm的抑菌圈。且纳米银生物海绵抑菌能力与纳米银的含量有一定关系,当硝酸银含量小于3.8%,抑菌效果不明显(照片未显示),但当硝酸银的含量大于7.6%后再增加硝酸银的含量并不能明显增强其抑菌能力。
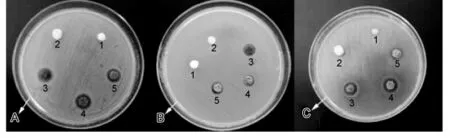
图2 体外抑菌实验结果Fig.2 Results of anti-bacteria in vitro
3.3 伤口的大体观察及细菌培养鉴定结果
明胶海绵组在细菌感染后的前3 d,大鼠背部伤口有明显脓斑,1周后伤口痂下可见明显新生肉芽组织,但伤口仍有小量脓斑,2周后大鼠伤口愈合良好,痂面缩小到原伤口的1/2~1/3;载纳米银海绵组在细菌感染后的第3天,大鼠背部也可见脓斑,但较明胶海绵组少,1周后伤口痂下可见明显新生肉芽组织,已无脓斑,2周后大鼠伤口愈合良好,痂面缩小到原伤口的1/2~1/3,与明胶海绵组比较无明显差别。细菌培养鉴定结果见表1。在感染后的第1天,明胶海绵组检测到大量的铜绿假单胞菌和中量的金黄色葡萄球菌,而载纳米银海绵组只检测到少量的铜绿假单胞菌和中量的金黄色葡萄球菌;在随后各时间点,明胶海绵组检测到的铜绿假单胞菌和金黄色葡萄球菌均明显多于载纳米银海绵组,到第2周,载纳米银海绵组已基本检测不到细菌,但明胶海绵组仍可以检测到少量细菌。但两组在各时相点均没有检测到大肠杆菌。

表1 海绵的在体抑菌实验结果Tab.1 Results of anti-bacteria of sponge in vivo
4 讨论
在因创伤、擦伤、烧伤及溃烂等而导致皮肤伤害后,很容易造成细菌感染、体液流失并引起各种并发症。因此,创面感染一直是平战时创伤、烧伤等治疗中面临的重要课题[6]。在治疗这种有组织损失的人体皮肤损伤时,通常采用敷料对伤口进行保护,防止伤口的感染和脱水,在伤口处维持有利于治疗的潮湿环境,改善治疗效果,促进伤口愈合。理想敷料应具备如下特征[7]:(1)安全无毒,无刺激性;(2)良好的生物相容性和可降解性;(3)可保持创面的湿润环境,具较好的吸收能力和一定的透气性;(4)阻止细菌侵入,抑制细菌生长;(5)最好有止血、止痛等作用,可促进肉芽生长和皮肤再生,加速愈合,减少疤痕;(6)贮存稳定性好。目前还没有敷料能完全达到这些要求。
现临床上使用最多的敷料还是纱布。这种惰性敷料,虽然具有吸收性好、保护创面、制作简单、价格便宜等优点,但由于其无法保持创面湿润、易与伤口粘连、不能阻止细菌入侵等缺点,因而对伤口的感染和化脓无能为力,对创面的愈合无明显促进作用,在换药时还会造成对新生组织的再次损伤,增加病人的痛苦。为了克服传统纱布敷料的不足,许多生物敷料如可吸收性明胶海绵、胶原蛋白海绵等应运而生。这些生物载药敷料由于其独特的性能,如良好的组织相容性和可降解性、安全低毒、在保护创面的同时还能有效地治疗伤口,促进组织修复等而倍受人们的关注。
为了改善敷料的性能,人们通过在敷料中载入不同的抗生素[8-9]、单质碘[10]等来提升敷料的抑菌能力,但由于许多菌种对抗生素产生了耐药性,而碘不稳定,易升华,使这类敷料的应用受到限制。单质银具有广谱杀菌能力,特别是在制备成纳米级的颗粒后。且银的杀菌机制不同于化学合成的抗菌剂,主要是基于重金属离子对细菌蛋白质的变性作用,因而具有广谱杀菌及很少产生耐药菌的特点[11]。
纳米银的制备方法有多种,本文采用简单实用的射线辐照法[12],通过紫外线照射含硝酸银的生物海绵得到了载有纳米银的生物海绵。经SEM测试,证实银颗粒的粒径主要为40 nm。
在体外抑菌试验中,我们发现,纳米银生物海绵对金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌都有一定的抑制作用,尤其是对铜绿假单胞菌,而可吸收性明胶海绵和未载纳米银生物海绵对三个菌种都没有产生抑菌圈。壳聚糖的抑菌作用已有文献报道[13-15],生物海绵中的主要成分为壳聚糖,没有观察到生物海绵的抑菌作用可能与壳聚糖的抑菌机理有关。文献报道的壳聚糖抑菌研究都是在液态中测定的,在酸性条件下,壳聚糖分子中的质子化铵具有正电性,可吸附带有负电荷的细菌,使细菌细胞壁和细胞膜上的负电荷分布不均,干扰细胞壁的合成,破坏细胞膜的功能,使细胞膜因不能承受渗透压而变形破裂,发生细菌溶解而亡[16]。但在我们的试验条件,生物海绵中的壳聚糖处于中性的固体状态,因而很难实现它的抑菌作用。另外,在交联过程中,壳聚糖分子中的氨基很可能与戊二醛发生反应,而壳聚糖分子中氨基上的反应也会改变壳聚糖的抑菌性能[17]。由此可见,载纳米银生物海绵产生的抑菌作用应归功于海绵表面上的纳米银颗粒。
在体抑菌实验结果也进一步印证了载纳米银海绵对细菌,尤其是铜绿假单胞菌的抑制能力。另外,我们还发现,在各时相点,两组均没有检测到大肠杆菌。据报道[18-20],某些铜绿假单胞菌菌株能够产生拮抗物质,对其他菌种的生长产生抑制和灭杀作用,因此,我们认为没有检测到大肠杆菌可能归因于铜绿假单胞菌对大肠杆菌的灭杀作用。
[1]Vigneshwaran N,Kathe A A,Varadarajan P V,etal.Functional finishing of cotton fabrics using silver nanoparticles[J].JNanosci Nanotechnol,2007,7(6):1893-1897.
[2]Hyang Y L,Hyoung K P,Yoon M L,etal.A practical procedure for producing silver nanocoated fabric and its antibacterial evaluation for biomedical applications[J].Chem Comm,2007:2959-2961.
[3]Liu B S,Huang T B.Nanocomposities of genipin-crosslinked chitosan/silver nanoparticles-structural reinforcement and antimicrobial properties[J].Micromol Biosci,2008,8:932-941.
[4]Ong SY,Wu J,Moochhala S M,etal.Development of a chitosanbased wound dressing with improves hemostatic and antimicrobial properties[J].Biomaterials,2008,29:4323-4332.
[5]姜会庆,汪 军,胡心宝,等.纳米银敷料在烧伤创面的应用[J].医学研究生学报,2001(5):439.
[6]陈玉林,关于烧伤感染防治的几点思考[J].中华烧伤杂志,2006,22(2):81-84.
[7]赵成如,史文红,金 刚.医用敷料[J].中国医疗器械信息,2007,13(7):15-21.
[8]高怀生,黄是是,张世达,等.烧伤生物敷料的配方及加工工艺:中国,CN1079909[P].1993-12-29.
[9]李东红,胡德耀,田昆仑,一种用于创伤医治的生物敷药:中国,ZL200510057157.9[P].2007-05-23.
[10]高怀生,黄是是,张世达,等.壳聚糖碘创烧伤敷料的制备:中国,CN1115254[P].1996-01-24.
[11]Siegel R W.Creating nanophase materials[J].Sci Am,1996,275(6):42-45.
[12]张昊然,李清彪,孙道华,等.纳米级银颗粒的制备方法[J].贵金属,2005,26(2):51-56.
[13]汤朝晖,侯春林,陈庆泉.几丁聚糖和透明质酸钠抑菌作用的研究[J].中国修复重建外科杂志,2002,16(4):259-261.
[14]王秀文,刘占龙,金桂菊,等.胶原-壳聚糖冻干海绵的制备及其抑菌作用[J].中国生化药物杂志,2002,23(4):187-188.
[15]Takanori F,Yasuo T,Michinori T,etal.Antibacterial effects of Chitosan solution® against Legionella pneumophila,E.coli,and S.aureus[J].Inter J Food Microbio,2006,112:96-101.
[16]陈 威,吴清平,张菊梅,等.壳聚糖抑菌机制的初步研究[J].微生物学报,2008,48(2):164-168.
[17]Chung Y C,Chen C Y.Antibacterial characteristics and activity of acid-soluble chitosan[J].Bioresource Technol,2008,99:2806-2814.
[18]Kimura S,Tateda K,Ishii Y,etal.Pseudomonas aeruginosa Las quorum sensing autoinducer suppresses growth and biofilm production in legionella species[J].Microbiology,2009,155:1934-1939.
[19]丛延广,饶贤才,胡福泉.铜假单胞菌XQ17提取物对革兰阳性菌的拮抗作用[J].微生物学杂志,2006,26(3):105-107.
[20]张伏军,林立鹏,唐 婧,等.一株烟草枯菌拮抗细菌的筛选及鉴定[J].西南大学学报:自然科学版,2007,29(9):91-94.
