生长抑素对胃癌VEGFs和VEGF受体影响的实验研究
2011-11-15孙勇伟
赵 滨 杨 静 孙勇伟 蔡 端
胃癌是人类常见的恶性肿瘤,每年全世界都有80万人因此死亡,一般而言,胃癌患者平均5年存活率大约22%,而晚期胃癌患者5年存活率低于5%。研究表明,血管和淋巴管的恶性增生是肿瘤转移和恶化的重要原因[1]。内皮细胞特异性生长因子及其受体是血管淋巴管增生的重要原因之一[2~5]。
研究表明,VEGF过表达与胃癌患者不良预后密切相关,抑制VEGF表达能够减弱胃癌的成瘤性[6~9]。表明 VEGF过表达会引起肿瘤的恶化,并且能将VEGF作为肿瘤治疗的重要靶点。
生长抑素是1种重要的内生性抑制因子,最初由猪的下丘脑中获得[10]。生长抑素的激动剂如奥曲肽(octreotide)被广泛用于肢端肥大患者,胰岛瘤和许多良性肿瘤的激素调控[11~13]。研究表明生长抑素很有可能通过抑制VEGF而发挥抑制血管生成的作用,因此可能在内分泌瘤中发挥着重要的作用[14]。有研究表明,生长抑素及其类似物在体内和体外发挥作用依赖于血管的发育程度[15]。我们推断,生长抑素在胃癌血管生成中发挥着作用,并能影响VEGF水平。为此,我们通过建立随机实验,以探讨生长抑素对胃癌患者VEGF水平的影响。
1 材料与方法
1.1 一般资料
选择本院普通外科收治的行根治性手术胃癌患者60例,均经病理检查证实,病理分期Ⅲ~Ⅳ期,并有可测客观病灶。随机分组,两组性别比例和平均年龄等见表1。两组患者术前肝、肾功能均正常,无糖尿病、甲状腺功能亢进等代谢性疾病,无任何免疫性疾病,以往6个月内未接受过糖皮质激素和其他免疫抑制剂,未接受过放疗或化疗,愿意接受全肠内营养,在性别、年龄、病变部位及术式等方面两组差异无统计学意义(P >0.05),见表 1。

表1 2组患者基本资料的比较(例,%)
1.2 治疗方法
实验组患者术前静脉注射生长抑素3 mg,3次/天,连续3天。对患者行常规检查,记录患者相关的各项体征、体重、全血计数和血清学指标,药物引起的不良反应均记录在案。
1.3 标本收集
手术切除的新鲜胃癌标本用10%的福尔马林液固定,常规石蜡包埋或直接溶于Trizol备用。
1.4 免疫组化
常规石蜡包埋的组织,切成4 μm切片,依次经二甲苯脱蜡、100%、95%、80%、70%梯度酒精复水。抗原修复采用玻片浸入柠檬酸缓冲液加热至99℃,保持30 min再室温自然冷却。3%过氧化氢浸泡5 min以去除内源性过氧化物酶活性。一抗KDR/Flt-1(购自Santa Cruze),均以1∶100配成工作浓度,4℃孵育过夜。磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤2次后用生物素标记的二抗(上海长岛)室温孵育30 min,再用链酶素辣根过氧化物酶孵育30 min,DAB(上海长岛)试剂盒显色。苏木精复染后封片。PBS代替一抗作为阴性对照,根据抗体说明书以大肠癌标本作为阳性对照。
每张切片选取5个200倍视野,用Olympus BX51显微镜拍摄(日本)。图像分析采用 Image-Pro Plus 6.0软件计算每张图片中阳性表达部分的平均光密度(mean optical density,mean OD)及累积光密度(integral OD,IOD)。
1.5 实时定量PCR
胃癌组织50~100 mg溶于1 ml TRIzol中,根据试剂说明书提取总 RNA,并测定浓度。取总 RNA 1 mg,补充无核酸酶水至9.9 ml,70 ℃孵育10 min后,短暂离心后,置于冰上;在同管中依次加入:MgCl2(25 mmol/L)4 μl、10 × 逆转录缓冲液 2 μl、dNTP 混合液(10 mmol/L)2 μl、RNA 酶抑制剂(40 U/μl)0.5 μl、Oligo(dT)15 引物(0.5 μg/μl)1 μl、AMV 逆转录酶(5 U/μl)0.6 μl。42 ℃下孵育 15 min,然后 95 ℃作用5 min终止反应,4℃下孵育5 min,逆转录产物cDNA保存于-20℃备用。使用iCycler IQ(Bio-Rad,美国)进行 Realtime PCR分析。以 β-actin作为内参。VEGF-A的引物序列为5’-CCA TGA ACT TTC TGC TGT CTT-3’(sense)和 5’-TCG ATC GTT CTG TAT CAG TCT-3’(antisense),β-actin 引物序列为 5’-GTG CGT GAC ATT AAG GAG-3’(sense)和5’-CTA AGT CAT AGT CCG CCT-3’(antisense)。
1.6 酶联免疫反应实验
实验组分别在给药前和术后24、48、72 h时行抽血取样。通过离心获得血清后行酶联免疫分析血清VEGF水平。
1.7 统计学处理
2 结果
2.1 生长抑素抑制VEGF表达水平
生长抑素预处理前两组血清VEGF水平无明显差异,而术前及术后生长抑素预处理组VEGF水平均明显低于对照组(图1)。
2.2 生长抑素对VEGF各亚型mRNA水平的影响
实时定量PCR检测结果显示,VEGF各亚型A、B、C的RNA水平,生长抑素预处理组与对照组比较并无明显差异(图2)。
2.3 生长抑素对VEGFR2和VEGFR1水平的影响
免疫组化结果显示,VEGF受体表达位于胃癌原发灶及临近黏膜组织中。生长抑素预处理并未明显改变VEGFR1和R2表达水平,而VEGFR3水平明显下降,同样VEGFR3不仅表达于原发灶,而且表达于黏膜组织。VEGFR3主要表达于内皮细胞中及黏膜下。VEGFR3阳性表达血管主要位于正常胃黏膜的下半部及临近肌肉部位的黏膜下层(图3)。
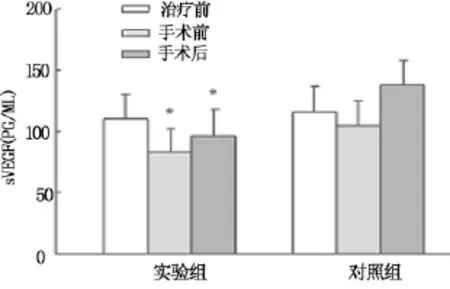
图1 两组血清VEGF水平比较

图2 生长抑素预处理对VEGF各组mRNA水平的影响
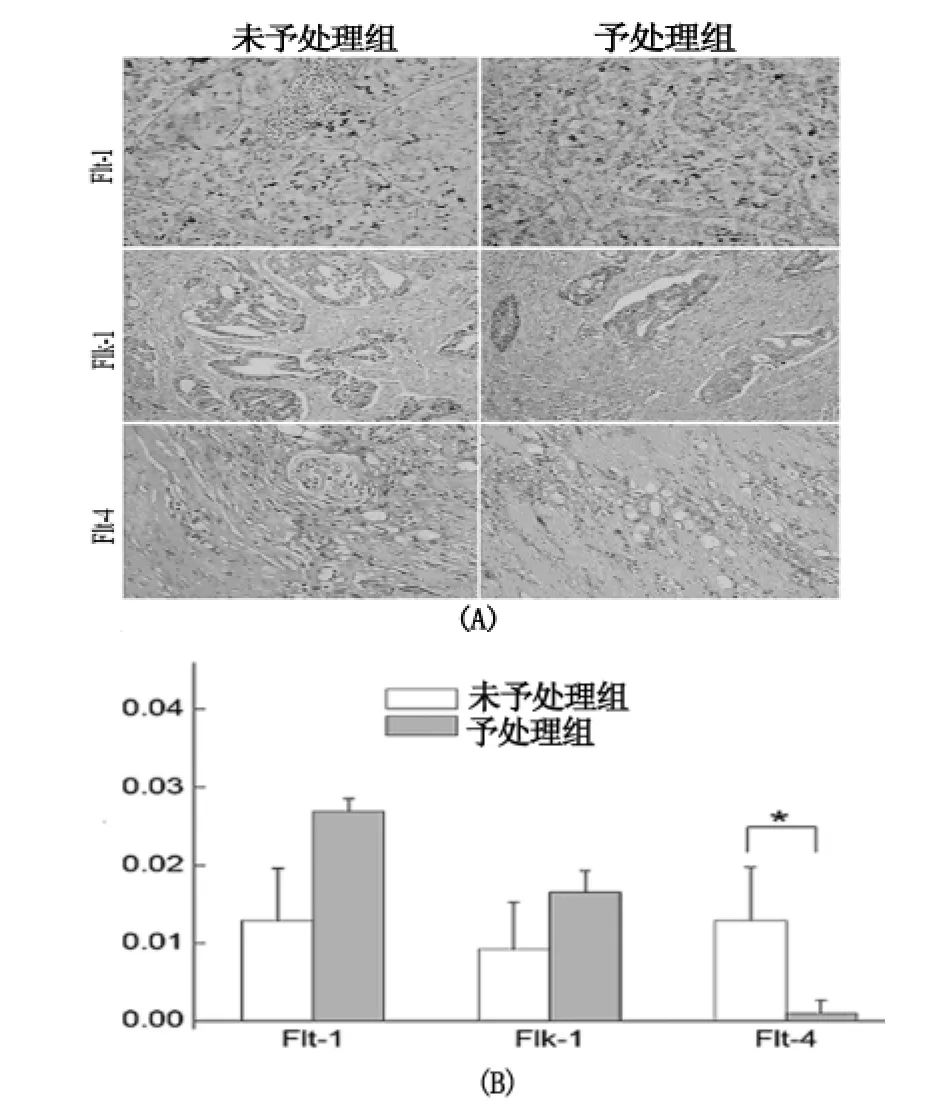
图3 2组中VEGFR1、R2、R3表达的平均光密度图
3 讨论
胃癌是最常见的恶性肿瘤之一。在全世界范围仅次于肺癌而居各种恶性肿瘤死因的第二位。胃癌患者生存率的提高有赖于胃癌的早期诊断、早期治疗、对转移和复发的有效预防及寻找新的治疗靶点提高胃癌的治疗水平。血管生成对于肿瘤的转移起着至关重要的作用。肿瘤细胞能够产生和释放许多促血管和抗血管的因子来调节血管的生成。VEGFs是最常见的血管生长因子家族,其能够通过与受体的结合促进血管的生成,从而影响肿瘤的进程。在胃癌患者中,VEGF过表达与不良预后紧密相连,提示我们抗VEGF治疗对胃癌的治疗可能存在作用[16,17]。生长抑素及其类似物能够抑制VEGF的产生,从而影响血管的生长,起到治疗肿瘤的作用[18]。同样也有研究报道生长抑素及其类似物可能是通过影响VEGF的水平来影响血管生成的[18]。在本实验中,我们发现生长抑素的预处理可以降低血清VEGF的水平,并且下调VEGF受体的表达。
除了影响血管生成以外,VEGF同样可以作为1个调控血管生成的标志[19,20]。我们研究结果显示,可溶性VEGF血清水平的下降,可能影响到后来的血管生成。但同时VEGF各亚型的mRNA水平并没有改变。我们推断生长抑素可能是通过影响VEGF蛋白的合成和降解来发挥作用。也有研究报道,在肝癌患者中使AZD2171引起时间和剂量依赖的VEGFR2的减少,VEGF水平反而升高[22~24]。说明在不同肿瘤的发展过程中,促血管生长因子起着两面的作用[21]。
另外,我们的研究结果显示,在生长抑素预处理的患者中VEGF受体3的表达水平明显下降,而其配体VEGF-C并没有改变。VEGF-C与VEGF受体3的表达有利于淋巴管的生成,而淋巴管对于肿瘤基质有重要影响。VEGF-C与VEGF受体3的活化,肿瘤细胞更易于发生转移。有研究报道,VEGF-C与VEGF受体3存在着重要的关联,肿瘤基质中VEGF受体3阳性细胞数量与胃癌恶性侵袭程度相关[25]。
综上所述,在进行胃癌切除术的患者中,预先使用生长抑素,可降低血清VEGF水平,同时可影响VEGF受体3的表达。生长抑素可以通过调控VEGF及其受体水平,从而影响血管和淋巴管的生成,而作为胃癌切除术患者治疗的1种重要佐剂。
[1]Coultas L,Chawengsaksophak K,Rossant J.Endothelial cells and VEGF in vascular development〔J〕.Nature,2005,438:937.
[2]Werther K,Christensen IJ,Brünner N,et al.Soluble vascular endothelial growth factor levels in patients with primary colorectal carcinoma.The Danish RANX05 Colorectal Cancer Study Group〔J〕.Eur J Surg Oncol,2000,26:657.
[3]Seo Y,Baba H,Fukuda T,et al.High expression of vascular endothelial growth factor is associated with liver metastasis and a poor prognosis for patients with ductal pancreatic adenocarcinoma〔J〕.Cancer,2000,88:2239.
[4]Ikeda N,Adachi M,Taki T,Huang C,et al.Prognostic significance of angiogenesis in human pancreatic cancer〔J〕.Br J Cancer,1999,79:1553.
[5]Claudio PP,Russo G,Kumar CA,et al.pRb2/p130,vascular endothelial growth factor,p27(KIP1),and proliferating cell nuclear antigen expression in hepatocellular carcinoma:their clinical significance〔J〕.Clin Cancer Res,2004,10:3509.
[6]Erenoglu C,Akin ML,Uluutku H,et al.Angiogenesis predicts poor prognosis in gastric carcinoma〔J〕.Dig Surg,2000,17:581.
[7]Kolev Y,Uetake H,Iida S,et al.Prognostic significance of VEGF expression in correlation with COX-2,microvessel density,and clinicopathological characteristics in human gastric carcinoma〔J〕.Ann Surg Onco,2007,14:2738.
[8]Eroĝlu A,Demirci S,Ayyildiz A,et al.Serum concentrations of vascular endothelial growth factor and nitrite as an estimate of in vivo nitric oxide in patients with gastric cancer〔J〕.Br J Cancer,1999,80:1630.
[9]Karayiannakis A,Syrigos KN,Polychronidis A,et al.Circulating VEGF levels in the serum of gastric cancer patients〔J〕.Ann Surg,2002,236:37.
[10]Poulsen JE.Recovery from retinopathy in a case of diabetes with Simmonds’disease〔J〕.Diabetes,1953,2:7.
[11]Hofland LJ and Lamberts SW.Somatostatin receptor subtype expression in human tumors〔J〕.Ann Oncol,2001,12(Suppl 2):S31.
[12]de Herder WW and Lamberts SW.Somatostatin and somatostatin analogues:diagnostic and therapeutic uses〔J〕.Curr Opin Oncol,2002,14:53.
[13]Melmed S,Vance ML,Barkan AL,et al.Current status and future opportunities for controlling acromegaly〔J〕.Pituitary,2002,5:185.
[14]Mentlein R,Eichler O,Forstreuter F,et al.Somatostatin Somatostatin inhibits the production of vascular endothelial growth factor in human glioma cells〔J〕.Int J Cancer,2001,92:545.
[15]Woltering EA.Development of targeted somatostatin-based antiangiogenic therapy:a review and future perspetive〔J〕.Cancer Biother Radiopharm,2003,18:601.
[16]Karayiannakis A,Syrigos KN,Polychronidis A,et al.Circulating VEGF levels in the serum of gastric cancer patients〔J〕.Ann Surg,2002,236:37.
[17]Mentlein R,Eichler O,Forstreuter F,et al.Somatostatin inhibits the production of vascular endothelial growth factor in human glioma cells〔J〕.Int J Cancer,2001,92(4):545.
[18]Barrie R,Woltering EA,Hajarizadeh H,et al.Inhibition of angiogenesis by somatostatin and somatostatin-like compounds is structurally dependent〔J〕.J Surg Res,1993,55(4):446.
[19]Brostjan C,Bayer A,Zommer A,et al.Monitoring of circulating angiogenic factors in dendritic cell-based cancer immunotherapy〔J〕.Cancer,2003,98(10):2291.
[20]Norden-Zfoni A,Desai J,Manola J,et al.Blood-based biomarkers of SU11248 activity and clinical outcome in patients with metastatic imatinib-resistant gastrointestinal stromal tumor〔J〕.Clin Cancer Res,2007,13(9):2643.
[21]Casanova ML,Larcher F,Casanova B,et al.A critical role for ras-mediated,epidermal growth factor receptor-dependent angiogenesis in mouse skin carcinogenesis〔J〕.Cancer Res,2002,62(12):3402.
[22]Drevs J,Siegert P,Medinger M,et al.Phase I clinical study of AZD2171,an oral vascular endothelial growth factor signaling inhibitor,in patients with advanced solid tumors〔J〕.J Clin Oncol,2007,25(21):3045.
[23]Drevs J.Soluble markers for the detection of hypoxia under antiangiogenic treatment〔J〕.Anticancer Research,2003,23(2A):1159.
[24]Yang JC,Haworth L,Sherry RM,et al.A randomized trial of bevacizumab,an anti-vascular endothelial growth factor antibody,for metastatic renal cancer〔J〕.N Engl J Med,2003,349(5):427.
[25]Yonemura Y,Fushida S,Bando E,et al.Lymphangiogenesis and the vascular endothelial growth factor receptor(VEGFR)-3 in gastric cancer〔J〕.Eur J Cancer,2001,37(7):918.
