栀子黄多酚含量与抗氧化活性的相关性研究
2011-11-15王文君向灿辉何晓彤
陈 阳,张 浩,王文君,向灿辉,何晓彤,蔡 乐
(1.遵义医学院珠海校区化学教研室,广东珠海519041;2.四川大学华西药学院生药学教研室,四川成都610041;3.云南大学化学科学与工程学院,教育部自然资源药物化学重点实验室,云南昆明650091)
栀子黄多酚含量与抗氧化活性的相关性研究
陈 阳1,张 浩2,王文君1,向灿辉1,何晓彤1,蔡 乐3,﹡
(1.遵义医学院珠海校区化学教研室,广东珠海519041;2.四川大学华西药学院生药学教研室,四川成都610041;3.云南大学化学科学与工程学院,教育部自然资源药物化学重点实验室,云南昆明650091)
目的:揭示栀子黄抗氧化能力是否与多酚含量有关,为栀子黄中抗氧化能力成分的确定提供线索。方法:分别采用还原能力实验、DPPH自由基清除能力实验和亚铁离子螯合实验测定西红花苷、绿原酸、栀子粗提物和栀子黄的抗氧化活性,同时分别采用HPLC和UV来测定栀子粗提物和栀子黄中西红花苷和多酚的含量。结果:在还原能力和DPPH自由基清除活性模型中,栀子黄色素中起抗氧化作用的主要化学成分是多酚类,而不是西红花苷。另一方面,与前两个模型不同,西红花苷和多酚类成分都具有明显的亚铁离子螯合活性,栀子黄中具有螯合活性的主要化学成分同时包括西红花苷和多酚类。结论:结合前期研究结果推测,栀子黄抗氧化作用的主要化学成分是多酚类,而西红花苷具有明显的亚铁离子螯合活性。
栀子黄,西红花苷,多酚,抗氧化,UV,HPLC
栀子黄是从茜草科植物栀子果实(gardenia fruits)中提取的黄色素,是国内外使用最广泛、稳定性能较好的食用天然黄色素之一,在亚洲各国广泛用作食品色素。西红花苷(crocins)是栀子黄色素的主要成分[1],具有保护心血管系统疾病[1-3]、抑制肿瘤细胞增殖[4]、神经保护作用[5-7]和保护肝脏作用[8-9]。对该类成分各种药理机制的研究发现,抗氧化作用是这类类胡萝卜素产生各种药理作用的基础。我们前期的研究发现,栀子黄在4个体外抗氧化模型中显示非常强的活性,而数据统计结果又显示强抗氧化活性与西红花苷含量没有相关性[10]。鉴于栀子黄显示出较西红花苷明显更强的抗氧化活性,本课题进一步研究发现,栀子黄中除了西红花苷外,以绿原酸为标准品测定到栀子黄中还含有相当量的多酚,为了揭示栀子黄的强抗氧化能力是否与多酚含量有关,我们进一步采用3个抗氧化能力测试模型结合HPLC和UV来评价栀子黄的抗氧化能力,从而为栀子黄中抗氧化成分提供线索。考虑到模型中亚铁离子螯合实验和还原能力实验是前期没有采用过的,本课题中也一并对比研究了栀子黄和西红花苷-1的抗氧化能力。
1 材料与方法
1.1 材料与仪器
二苯代苦味酰肼自由基(DPPH·)、Folin-Ciocalteu试剂(Fluca) 购自Sigma公司;实验所用试剂 均为分析纯;绿原酸对照品 中国药品生物样品检定所,批号0749-9605。
UV-2550紫外分光光度系统 岛津;自动双重纯水蒸馏器 上海申顺生物科技有限公司。
1.2 实验方法
1.2.1 粗提物的制备 西红花苷-1、西红花苷-2、西红花苷-3、栀子黄及栀子粗提物的提取和分离参见文献[10-11]。
1.2.2 多酚含量的测定 采用Folin-Ciocalteu法测定[12]。取1mL不同浓度的样品溶液加入试管中,依次加入去离子水1mL,福林-酚试剂0.5mL,26.7% Na2CO3溶液1.5mL,再加水6mL,在50℃水浴中反应5min,冷却至室温,在760nm下测定其吸光度,以绿原酸为对照品,求得试样中总多酚的浓度。
1.2.3 西红花总苷含量的测定 以西红花苷-1、西红花苷-2和西红花苷-3为对照品,测定栀子黄中西红花总苷的含量,HPLC方法参照文献[10]。
1.2.4 DPPH自由基清除实验 样品DPPH自由基清除活性的测定方法参考文献[13]。测定试剂为0.06mol/L的DPPH乙醇溶液,将0.5mL不同浓度的样品液加入3.5mL的DPPH乙醇溶液中,室温放置30min后测定517nm下的吸收度,利用下式转化为抗氧化活性(AA):

式中:A0是指不加样品溶液的空白吸收度;A1指含有样品的DPPH溶液的吸收度;As是指没有DPPH,只有样品溶液的吸收度,用于校正空白。
517nm处吸光度下降的幅度可以反映出样品清除自由基能力的大小。计算每个样品的EC50,实验重复三次,结果取平均值。
1.2.5 还原力的测定 参照文献[14]。将所有样品溶解于去离子水中,稀释成一定浓度的溶液,取2.5mL稀释液,加入2.5mL 200mol/L的PBS(pH=6.6)和2.5mL 1%的K3Fe(CN)6,混合物在50℃恒温放置20min,加入2.5mL 10%三氯乙酸,将混合物离心分离(200×g,10min)。取上清液5mL,加入5mL去离子水和1mL0.1% FeCl3,测定700nm处的吸光度,扣除空白。反应混合物的吸光度值越高,表明样品的还原力越强。计算每个样品的EC50,实验重复三次,结果取平均值。
1.2.6 亚铁离子螯合能力的测定 参照文献[14]。将所有样品溶解于去离子水中,稀释成一定浓度的溶液,取稀释液1.0mL,加入3.7mL甲醇和0.1mL三氯化铁(2mmol/L)。反应由0.2mL ferrozine(5mmol/L)启动,在室温条件下静置10min后,测定混合物在562nm处的吸光度。计算每个样品的EC50,实验重复三次,结果取平均值。
2 结果与讨论
2.1 栀子黄与粗提物多酚含量
课题采用绿原酸为对照品,使用UV-Visibl测定栀子粗提物和栀子黄的多酚含量,结果分别为7.03%和21.16%(图1)。同时,采用HPLC分别测定西红花总苷含量,含量分别为8.9%和44.9%。数据显示,栀子黄中多酚和西红花苷含量都明显较栀子粗提物含量更高,说明HPD100大孔吸附树脂能有效富集栀子黄中的西红花苷和多酚。
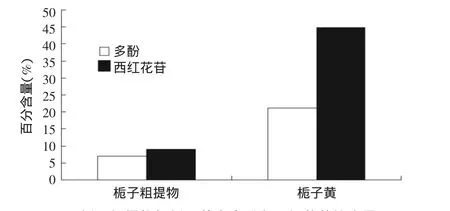
图1 栀子粗提物与栀子黄中多酚和西红花苷的含量
2.2 还原能力的测定

图2 还原能力测定结果
还原能力实验在国内外广泛用作植物药抗氧化能力评价的方法。本研究显示,所有样品在一定浓度范围内的还原性与它们的浓度成正比(图2)。除了绿原酸,栀子黄显示出所有样品中的最强活性(EC50= 0.130mg/mL),而西红花苷-1的活性相对较低(EC50= 0.180mg/mL),栀子粗提物显示最弱还原能力(EC50= 0.390mg/mL)。将绿原酸EC50与每个样品的EC50进行换算,即得各个样品以绿原酸表示的活性强度(相当于绿原酸,mg/mg),将这些数据与多酚和西红花总苷的浓度分别进行统计回归,结果显示,栀子粗提物和栀子黄还原能力与多酚浓度具有高相关性(图3),相关系数为R=0.997,而两份样品的还原能力与西红花苷浓度没有显示任何相关性(图4)。实验数据提示,栀子黄色素中起还原能力的主要化学成分是多酚类,而不是西红花苷。我们前期研究也显示[10],在抗红细胞溶血实验、肝脏脂肪氧化抑制实验以及钼酸铵抗氧化活性实验中,栀子黄都表现出较栀子粗提物显著明显的抗氧化活性,而这些活性都显示出与其中西红花苷浓度的低相关性,因此我们推测,栀子黄在这些模型中表现出的抗氧化活性也可能与其中的多酚浓度有相关性。

图3 还原能力与多酚含量的相关性

图4 还原能力与西红花总苷的相关性
2.3 DPPH自由基清除活性的测定
DPPH自由基广泛用来测试各种天然产物的抗自由基活性,当氢原子或者电子转移到DPPH自由基时,样品在517nm处褪色,颜色消褪的程度正比于自由基清除能力的大小。在这种模型中,具有高自由基清除能力的成分一般被认为具有高抗氧化活性。由于DPPH实验操作简单,重现性好,因此,该方法广泛应用于从植物中寻找新的抗氧化成分[15]。

图5 DPPH自由基清除实验测定结果
在本课题清除DPPH自由基活性实验中,所有的样品都表现出量效关系(图5)。绿原酸再一次显示出最强活性(EC50=0.035mg/mL),显著高于其它样品。而栀子黄(EC50=0.170mg/mL)的活性也明显强于西红花苷-1(EC50=0.480mg/mL),栀子粗提物显示最弱活性(EC50=0.620mg/mL)。同样,将绿原酸EC50与每个样品的EC50进行换算,即得各个样品以绿原酸表示的活性强度(相当于绿原酸,mg/mg),将这些数据与多酚和西红花总苷的浓度分别进行统计回归,结果显示,栀子粗提物和栀子黄还原能力与多酚浓度具有很高相关性(图6),相关系数为R=1.0000,而两份样品的还原能力与西红花苷浓度没有显示任何相关性(图7)。实验数据又一次显示,栀子黄色素中起还原能力的主要化学成分是多酚类,而不是西红花苷。

图6 DPPH自由基清除能力与多酚的相关性

图7 DPPH自由基清除能力与西红花总苷的相关性
2.4 亚铁离子螯合实验
抗氧化活性的一个重要机制是螯合(钝化)某些金属离子,而后者可以催化氢过氧化物的降解以及Fenton类反应,从而达到抑制氧化的作用。因此,亚铁离子螯合能力测定在天然产物抗氧化活性评价中具有非常重要的意义[16]。
本课题亚铁离子螯合实验见图8,西红花苷-1显示很强活性(EC50=1.51mg/mL),而栀子黄(EC50=5.10mg/ mL)的活性较前者弱很多,但仍然强于栀子粗提物(EC50=41.34mg/mL)。在这个模型中,经过富集的栀子黄表现出较栀子粗提物明显更强的活性。同样,将绿原酸EC50与每个样品的EC50进行换算,即得各个样品以绿原酸表示的活性强度(相当于绿原酸,mg/mg),将这些数据与多酚和西红花总苷的浓度分别进行统计回归,结果显示,栀子粗提物和栀子黄螯合能力与多酚浓度和西红花苷都具有高相关性(图9、图10),相关系数分别为0.996和0.982。实验数据显示,与前两个模型不同,西红花苷和多酚类成分都具有明显的螯合活性,栀子黄中具有螯合活性的主要化学成分同时包括西红花苷和多酚类。
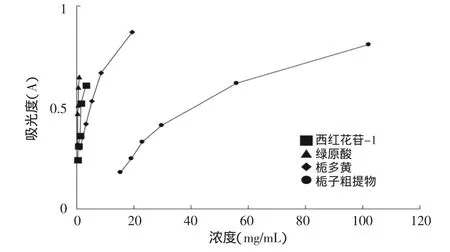
图8 螯合实验测定结果
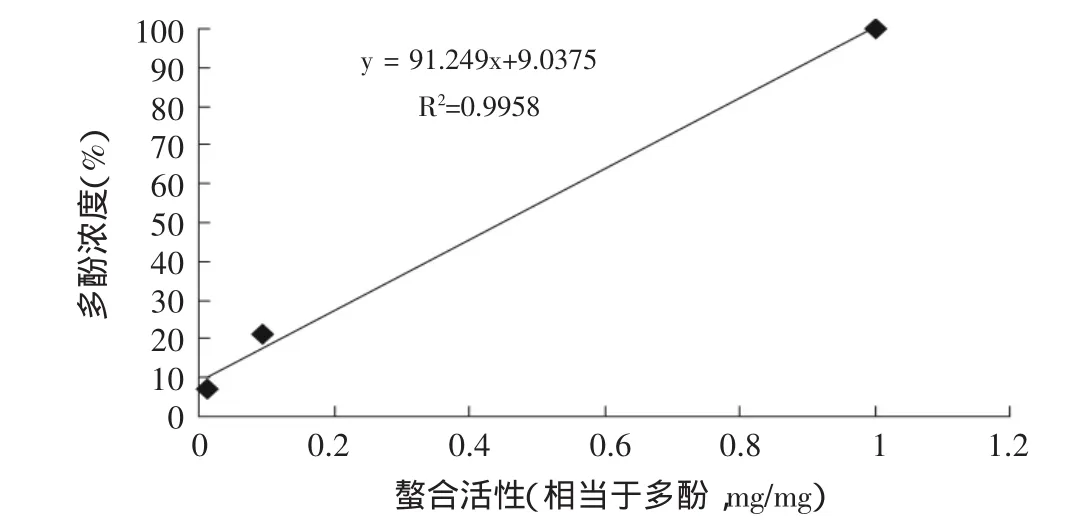
图9 螯合能力与多酚的相关性
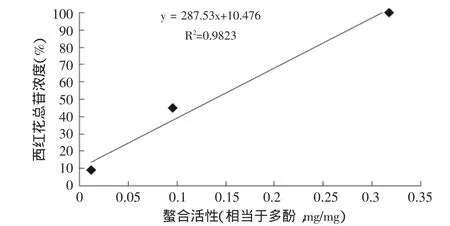
图10 螯合能力与西红花总苷的相关性
3 结论
我们前期的研究发现,栀子黄强抗氧化活性与西红花苷含量没有相关性。而本课题的研究数据显示,在还原能力和DPPH自由基清除活性模型中,栀子黄色素中起抗氧化作用的主要化学成分是多酚类,而不是西红花苷;另一方面,与前两个模型不同,西红花苷和多酚类成分都具有明显的亚铁离子螯合活性,栀子黄中具有螯合活性的主要化学成分同时包括西红花苷和多酚类。结合前期研究结果推测,栀子黄抗氧化作用的主要化学成分是多酚类,而西红花苷具有明显的亚铁离子螯合活性。
[1]HeSYQianZY,TangFT,etal.Effectofcrocinonexperimental atherosclerosis in quails and its mechanisms[J].Life Sci,2005,77:907-921.
[2]Shen X C,Qian Z Y.Effects of crocetin on antioxidant enzymatic activities in cardiac hypertrophy induced by norepinephrine in rats [J].Pharmazie,2006,61:348-352.
[3]Xiang M,Qian Z Y,Zhou C H,et al.Crocetin inhibits leukocyte adherence to vascular endothelial cells induced by AGEs[J].J Ethnopharmacol,2006,107:25-31.
[4]Venkatraman M,Jayapal P V S,Karupaya S,et al.Antitumour activity of crocetin in accordance to tumor incidence,antioxidant status,drug metabolizing enzymes and histopathological studies [J].Mol Cell Biochem,2006,287:127-135.
[5]Takashi O,Shigekazu O,Shinji S,et al.Crocin prevents the death of rat pheochromyctoma(PC-12)cells by its antioxidant effects stronger than those of α-tocopherol[J].Neurosci Lett,2004,362:61-64.
[6]Takashi O,Shinji S,Shigekazu O,et al.Crocin prevents the death of PC-12 cells through sphingomyelinase-ceramide signaling by increasing glutathione synthesis[J].Neurochem Int,2004,44:321-330.
[7]AbdullahSA,MubeenAA,MuzamilA,etal.Neuroprotection by crocetin in a hemi-parkinsonian rat model[J].Pharmacol Biochem Be,2005,81:805-813.
[8]Wang C J,Shiow S J,Lin J K.Effects of crocetin on the hepatotoxicity and hepatic DNA binding of aflatoxin B1 in rats [J].Carcinogenesis,1991,12:459-462.
[9]Tseng T H,Chu C Y,Huang J M,et al.Crocetin protects against oxidative damage in rat primary hepatocytes[J].Cancer Lett,1995, 97:61-67.
[10]Yang C,Hao Z,Xi T,et al.Antioxidant potential of crocins and ethanol extracts of Gardenia jasminoides ELLIS and Crocus sativus L.:A relationship investigation between antioxidant activity and crocin contents[J].Food Chemistry,2008,109(3):484-492.
[11]Yang C,Le C,Can Z,et al.Spectroscopic,stability and antioxidant properties of a novel pigment from Gardenia[J].Food Chemistry,2008,109:269-277.
[12]Robert Yawadio Nsimba,Hiroe Kikuzaki,Yotaro Konishi. Antioxidantactivity ofvarious extracts and fractions of Chenopodium quinoa and Amaranthus spp.Seeds[J].Food Chemistry,2008,106:760-766.
[13]Leong L P,Shui G.An investigation of antioxidant capacity of fruits in Singapore markets[J].J Agr Food Chem,2002,76:69-75.
[14]Haiyan Wang,Mouming Zhao,Bao Yang,et al.Identification ofpolyphenolsintobaccoleafandtheirantioxidantandantimicrobial activities[J].Food Chemistry,2008,107:1399-1406.
[15]Lee J M,Chung H,Chang P S,et al.Development of a method predicting the oxidative stability of edible oils using 2,2-diphenyl-1-picrylhydrazyl(DPPH)[J].J Agr Food Chem,2007, 103:662-669.
[16]Rajesh Manian,Nagarajan Anusuya,Perumal Siddhuraju,et al.The antioxidant activity and free radical scavenging potential of two different solvent extracts of Camellia sinensis (L.)O. Kuntz,Ficus bengalensis L.and Ficus racemosa L [J].Food Chemistry,2008,107:1000-1007.
Study on relationship between polyphenols content and antioxidant effect of gardenia yellow
CHEN Yang1,ZHANG Hao2,WANG Wen-jun1,XIANG Can-hui1,HE Xiao-tong1,CAI Le3,*
(1.Department of Chemistry,Zunyi Medical College Zhuhai Campus,Zhuhai 519041,China;2.West China School of Pharmacy,Sichuan University,Chengdu 610041,China;3.Key Laboratory of Medicinal Chemistry for Nature Resource,Ministry of Education,School of Chemical Science and Technology,Yunnan University,Kunming 650091,China)
Objective:In order to investigate the relationship between polyphenols content and antioxidant effect of gardenia yellow.Methods:Reducing power assay,DPPH radical scavenging effect and chelating ability on ferrous ions were determined.Then,with the aid of HPLC and UV,crocins and polyphenols content were measured.Results:In terms of reducing power assay and DPPH radical scavenging assay,only polyphenols content showed relationship with antioxidant effect of gardenia yellow.In addition,crocins and polyphenols contents can significantly chelate ferrous ions,and therefore,were responsible for the chelating power of gardenia yellow.Conclusion:Current data,as well as those obtained previously,indicate chemicals which feature considerabe antioxidant effect in gardenia yellow were polyphenols.However,in all models,crocins show significant antioxidant only in chelating ability on ferrous ions.
gardenia yellow;crocins;polyphenols;antioxidant;UV;HPLC
TS201.2
A
1002-0306(2011)10-0125-04
2010-07-29 *通讯联系人
陈阳(1977-),男,博士,副教授,研究方向:中药有效成分的提取、分离及分析。
贵州省高层次人才特助基金(2010);贵州省国际合作项目基金(2009GZ52794)。
