山药糖蛋白纯化条件及其理化方法鉴定
2011-11-14孙宇婧李丽萍
孙宇婧 韩 涛 卞 科 李丽萍
(北京农学院食品科学系1,北京 102206)
(陕西省榆林市农产品质量安全检验检测中心2,榆林 719000)
(河南工业大学3,郑州 450002)
(北京工商大学植物资源研究开发北京市重点实验室4,北京 100037)
山药糖蛋白纯化条件及其理化方法鉴定
孙宇婧1,2韩 涛1卞 科3李丽萍4
(北京农学院食品科学系1,北京 102206)
(陕西省榆林市农产品质量安全检验检测中心2,榆林 719000)
(河南工业大学3,郑州 450002)
(北京工商大学植物资源研究开发北京市重点实验室4,北京 100037)
采用热水浸提法得到山药糖蛋白粗提物,经过不同洗脱液进行DEAE-52柱层析纯化和SephadexG-75柱层析纯化,得到山药糖蛋白组分CYG-1和CYG-2。其中,DEAE-52柱层析中以NaHCO3作为洗脱液时,只能得到1个CYG组分。I2-KI显色反应、茚三酮反应、斐林试剂反应、硫酸-咔唑反应、以及与FeCl3反应和与CTAB反应、糖肽键特征等理化方法鉴定的结果表明,得到的CYG-1和CYG-2为纯品,属酸性糖蛋白,糖肽键为O-糖肽键。CYG-1和CYG-2分子中蛋白和多糖质量分数分别为20.62%、15.16%和68.56%、72.31%。
山药 糖蛋白 纯化 糖肽键
糖蛋白是一类由较短往往具有分支的寡糖链与蛋白质(多肽链)共价相连而构成的糖复合物[1-3]。对糖蛋白的药理作用及保健功能研究已取得一些重要成果[4-5],显示了在新型药物及功能性食品开发方面具有广阔的应用前景。
山药又名白苕、土薯、大薯、薯药,为薯蓣科(Dioscoreae opposite Thumb)多年生宿根蔓性草本植物的地下块茎,多分布在热带和亚热带地区[6],其性平味甘,健脾益肺,是我国传统的药食同源类植物。山药主要含蛋白质和淀粉,还含有比较丰富的维生素和多种矿物质元素及黏液质等活性成分,黏蛋白的氨基酸组成全面,人体必需氨基酸的含量比较高。有报道称山药糖蛋白具有增强人体免疫力、降低血糖、抗衰老、抗肿瘤、抗突变等功效,是山药活性成份之一[7]。国外对山药的研究较集中在山药质地结构及加工性质方面[8-9],鲜见山药糖蛋白研究,国内关于山药糖蛋白研究的全面报道也较少。
本试验采取热水浸提法抽提山药糖蛋白,Sevag法除游离蛋白,再经过DEAE-52和SephadexG-75柱层析进行纯化,并通过其理化性质的分析,对所得到的山药糖蛋白进行鉴定,为今后开发山药糖蛋白产品或进行功能性质研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验原料
新鲜山药:北京回龙观镇城北交易市场。
1.1.2 试剂与仪器
DEAE-52:Whatman公司;SephadexG-75:Pharmacia公司;透析袋(MwCo8000D):Sigma公司;乙醇、无水乙醚、丙酮等试剂均为分析纯,北京化工厂。
RE52CS-1旋转蒸发器:上海亚荣生化仪器厂;HL-24恒流泵:上海沪西分析仪器厂;TH-1000梯度混合器:上海楚柏实验室设备有限公司;BSZ-100自动部分收集器:上海沪西分析仪器厂;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;TDL-40B离心机:上海安亭科学仪器厂。
1.2 方法
1.2.1 山药糖蛋白的提取
山药经破碎匀浆,65℃热水浸提,离心收集上清液,减压浓缩,用4倍体积的95%乙醇沉淀,收集沉淀复溶,淀粉酶除淀粉,Sevag法除游离蛋白,再用无水乙醇沉淀,依次用无水乙醚、丙酮洗涤2~3次,最后经低温干燥得糖蛋白粗提物。
1.2.2 DEAE -52柱层析纯化
DEAE-52纤维素50 g于25℃环境中,用10倍体积的蒸馏水浸泡24 h。充分溶胀后,用蒸馏水反复洗涤,倾去悬浮颗粒;抽滤后再用0.5 mol/L NaOH溶液浸泡,搅拌片刻,自然沉降后,用蒸馏水洗涤至中性;然后用0.5 mol/L HCl浸泡,搅拌片刻,自然沉降后,用蒸馏水洗涤至中性;最后用0.5 mol/L NaOH溶液浸泡,搅拌片刻,自然沉降后,用蒸馏水洗涤至中性。经过“碱、酸、碱”处理后的纤维素将结合OH-,可与带负电荷的糖蛋白阴离子进行交换。处理后的DEAE-52纤维素湿法装柱(离子交换柱规格:1.6 cm ×40 cm),再用蒸馏水平衡 3 d[10]。
将山药糖蛋白粗提物配制成质量浓度为5.0 mg/mL的样液,上样量5mL,分别采用 NaHCO3和NaCl进行梯度洗脱,洗脱速度为 0.5 mL/min,3 mL/管。采用苯酚-浓硫酸法分别检测280 nm和490 nm处的吸收峰,收集并合并两波长处同时具有吸收峰的组分,透析后干燥并收集,得到糖蛋白纯品(CYG)。
1.2.3 SephadexG -75 柱层析
SephadexG-75层析柱的制备:将SephadexG-75干粉浸泡在10倍体积的0.02 mol/L pH 7.2的Tris-HCl缓冲溶液,沸水浴中逐渐加热使之充分溶胀,约需8~12 h,然后用自然沉降法装柱,0.02 mol/L pH 7.2 Tris-HCl缓冲溶液平衡 3 d。
1.0 cm×70 cm的层析柱,湿法装柱,用蒸馏水平衡2 d。将经过DEAE-52层析得到的山药糖蛋白纯品配成1.0 mg/mL,样液上样量为5 mL。用蒸馏水作洗脱液,洗脱速度为1 mL/min,3 mL/管。同1.2.2中方法,采用苯酚-浓硫酸法在280 nm和490 nm波长下追踪,将两波长处同时具有吸收峰的相应组分收集合并,浓缩、透析,干燥后备用。
1.2.4 山药糖蛋白的理化方法鉴定
1.2.4.1 化学方法鉴定
碘-碘化钾反应[11]:分别把结晶碘5 g,碘化钾10 g,定容至500 mL,贮于棕色瓶内。配制10 mg/mL的山药糖蛋白分别等量置于两管,加入I2-KI溶液,并观察颜色变化。
茚三酮反应[12]:称取5 g茚三酮,用125 mL沸蒸馏水溶解,冷却后备用。配制10 mg/mL的山药糖蛋白,加入茚三酮溶液,混匀,观察颜色变化。
斐林试剂反应[12]:在10 mg/mL的山药糖蛋白溶液中加入由0.1 g/mL NaOH溶液和0.05 g/mL硫酸铜溶液配制而成的斐林试剂,观察颜色变化。
硫酸 -咔唑反应[13]:配制 0.1%咔唑试液(50 mg咔唑溶于50 mL 95%乙醇中),取0.2 mL山药糖蛋白样品液,补水至1 mL,在冰水浴中加入6 mL浓H2SO4,摇匀后,在85℃水浴中保持20 min,取出后冷至室温,加0.2 mL咔唑液,在室温下保持2 h,观察颜色变化。
三氯化铁反应[14]:称取 4.5 g 三氯化铁,用 32%盐酸溶液与水(1∶39)的混合液溶解,定容至100 mL,加入山药糖蛋白样品液,观察颜色变化。
十六烷基三甲基溴化铵(CTAB)络合反应[14]:称取CTAB 5 g,加到已标定好的0.125 mol/L H2SO4溶液250 mL中,混匀,加入山药糖蛋白样品液,煮沸2 h,观察颜色变化。
1.2.4.2 糖蛋白糖肽键特征
3.1 以供给侧改革为导向,优化资源配置 随着越来越多的社会企业积极参与特色小镇的建设,从顶层设计、金融支持、开发建设和运营管理等多个方面暴露出了当前我国特色小镇建设地产化、文化流失、布局不合理等诸多问题[10]。针对这些问题,在以供给侧结构性改革为导向下优化资源配置就显得尤为重要。
紫外光谱法[7,15]:称取5 mg 糖蛋白溶于3 mL 蒸馏水中,分成两等份,其中一份加入1.5 mL蒸馏水,另一份加入1.5 mL 0.4 mol/L NaOH溶液,测反应开始和结束时(2 h)的紫外光谱,并记录开始与结束时240 nm处的吸光值。
1.2.5 糖蛋白中多糖含量与蛋白质含量的测定
苯酚-硫酸法[16],以葡萄糖为标准品;Folin-酚法[17],以牛血清白蛋白为标准品。
以上所有试验和测定均为3次重复。
2 结果与分析
2.1 山药糖蛋白粗提物DEAE-52柱层析结果
2.1.1 不同浓度NaHCO3溶液洗脱结果
用收集洗脱液的时间作为横坐标,分别以每一管洗脱液的OD280nm(紫外分光法测定蛋白质)和OD490nm(苯酚-硫酸法测定多糖)吸光值为纵坐标,绘制出DEAE-52层析柱洗脱曲线图,见图1。
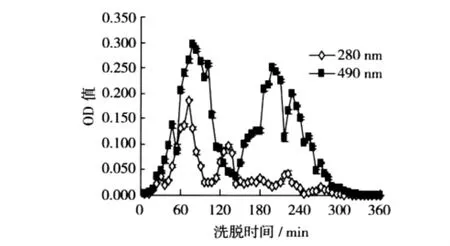
图1 山药糖蛋白DEAE-52NaHCO3溶液洗脱曲线
用DEAE-52纤维素柱层析纯化糖蛋白可选用的洗脱液有蒸馏水、不同浓度的 NaHCO3溶液及NaCl溶液。用蒸馏水洗脱时,由于蒸馏水与DEAE-52纤维素之间不存在离子交换,因此可洗脱出不被吸附的糖蛋白,即不带电荷的中性糖蛋白。用NaHCO3溶液洗脱时可置换出被纤维素上阳离子基团吸附的带负电荷的糖蛋白,即酸性糖蛋白;随着溶液浓度的升高,HCO3-浓度及溶液的pH都升高,这对洗脱酸性糖蛋白更为有利[19]。因此先用 0.05、0.10、0.50 mol/L的NaHCO3溶液进行阶段洗脱试验(图1)。在 OD280nm下时间段为36~96 min、108~144 min出现明显洗脱峰,而在OD490nm下时间段为54~132 min、180~216 min、216~246 min出现洗脱峰,其中第1个洗脱峰在280 nm和490 nm处的吸收峰重叠,为糖蛋白的特征吸收,表明该洗脱组分可能为糖蛋白;其余吸收峰则无此特征,可能为未除尽的游离蛋白质。
从图2可看出,洗脱液在OD490nm处有3个吸收峰,在OD280nm出有2个吸收峰,其中24~36 min时出现的吸收峰只在OD490nm处有吸收峰,在OD280nm处没有吸收峰。而在48~78 min时洗脱液在OD280nm和OD490nm处都有吸收峰,在138~186 min时洗脱液中也有一个二者共同出现的吸收峰。在相同组分中既含有多糖又含有蛋白质,可以认定该组分为糖蛋白。因此山药糖蛋白经过DEAE-52纤维素阴离子交换柱层析后,分离出2个糖蛋白峰,暂分别称为CYG-1和CYG-2。
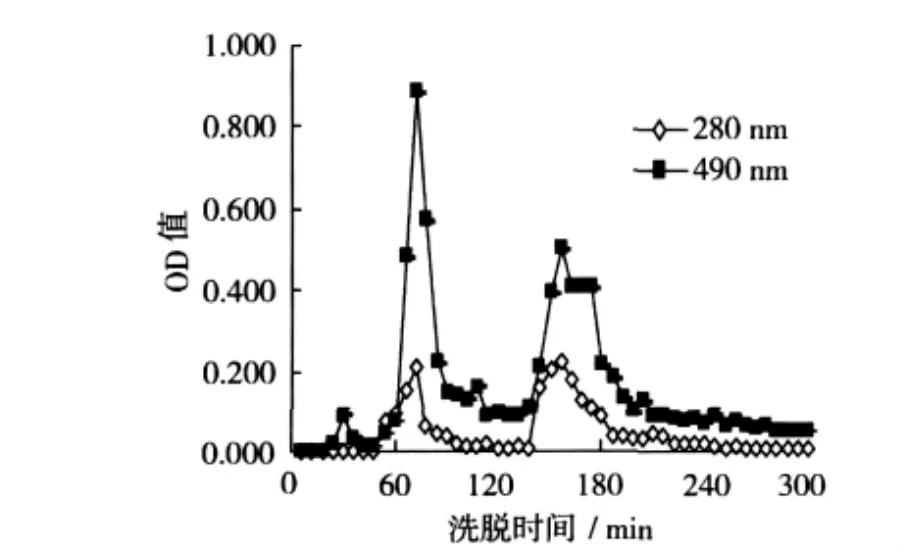
图2 山药糖蛋白DEAE-52NaCl溶液洗脱曲线
2.2 山药糖蛋白粗品SephadexG-75柱层析结果
经DEAE-52柱层析纯化得到的2个山药糖蛋白组分(CYG-1和CYG-2),再分别用SephadexG-75葡聚糖凝胶层析柱进一步纯化。
2.2.1 CYG -1的 SephadexG -75柱层析结果
山药糖蛋白1(CYG-1)经SephadexG-75层析柱纯化后,在第24~45 min时OD280nm和OD490nm的洗脱液中同时出现了多糖和蛋白质的吸收峰,且吸收峰单一,峰形基本对称,表明组分均一(图3)。
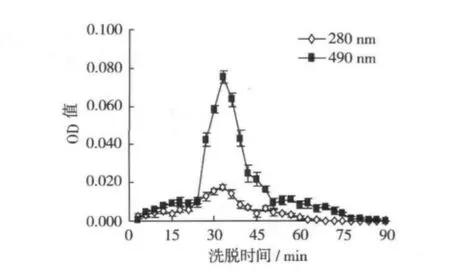
图3 山药糖蛋白(CYG-1)SephadexG-75蒸馏水洗脱曲线
2.2.2 CYG -2的 SephadexG -75柱层析结果
山药糖蛋白2(CYG-2)经过SephadexG-75层析柱纯化时,在33~57 min时OD280nm和OD490nm同时出现了多糖和蛋白质的吸收峰,吸收峰单一且峰形对应,无拖尾现象(图4)。
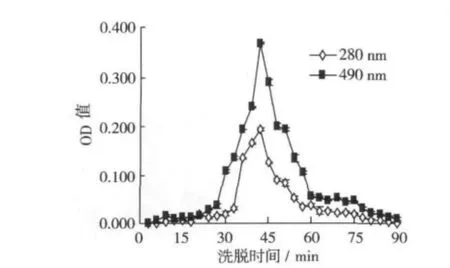
图4 山药糖蛋白(CYG-2)SephadexG-75蒸馏水洗脱曲线
2.3 山药糖蛋白理化方法鉴定结果
2.3.1 定性试验
山药糖蛋白溶液与I2-KI不显色,表明其是非淀粉类多糖;山药糖蛋白溶液与茚三酮反应呈蓝紫色,表明其有蛋白质存在;山药糖蛋白溶液与斐林试剂反应,没有银镜产生,表明其不含游离单糖;硫酸-咔唑反应没有呈现绿色,表明山药糖蛋白不含糖醛酸;山药糖蛋白溶液与FeCl3反应未呈现蓝色沉淀,表明其不含多酚类物质;山药糖蛋白与CTAB反应呈黄色,表明其是酸性糖蛋白。
2.3.2 糖肽键特征
碱性β-消除反应被广泛应用于阐明糖蛋白的结构,当糖蛋白受温和的碱处理时,由于糖与蛋白质的丝氨酸和苏氨酸的β-位羟基之间形成的O-糖肽键对碱不稳定,而N-糖肽键是稳定的,因此可以通过碱处理后糖蛋白中丝氨酸和苏氨酸残基数的减少来确定O-糖肽键的存在[10]。
等量的山药糖蛋白中分别加入蒸馏水与0.4 mol/L NaOH,其反应开始和2.0 h后的紫外光谱见图5,处理开始和结束时在240 nm处的吸光度值变化见表1。

图5 山药糖蛋白CYG-1和CYG-2的β-消除反应前后紫外图谱

表1 山药糖蛋白CYG-X经蒸馏水和NaOH处理始末的紫外(240 nm)吸收值变化
由图5及表1可知,反应开始时山药糖蛋白2组分在280 nm处均有吸收峰,这表明了糖蛋白的特征吸收峰。反应结束时,2个经水处理的山药糖蛋白在240 nm处没有吸收峰,但经碱处理过的山药糖蛋白均在240 nm处产生明显吸收,表明这2个山药糖蛋白组分中均具有O-糖肽键。综合试验结果,表明得到的2个山药糖蛋白为纯度较高的酸性糖蛋白。
2.4 山药糖蛋白中多糖与蛋白质的含量
由图6可知,CYG-1和CYG-2分子中蛋白质量分数分别为20.62%、15.16%,多糖质量分数分别为68.56%、72.31%。山药糖蛋白分子中多糖与蛋白质组成的差异可能与其功能性质有关。2个山药糖蛋白分子中均含有除蛋白质和多糖以外的部分,分别占10.82%和12.55%,它们的组成和对糖蛋白的功能性质的影响尚不清楚。

图6 山药糖蛋白中多糖与蛋白质组成
3 讨论与结论
本研究采用了DEAE-52和SephadexG-75两种柱层析法对山药糖蛋白粗品进行纯化,其中在DEAE-52柱层析时,选取NaHCO3和NaCl两种洗脱液分别对山药糖蛋白进行洗脱,NaHCO3洗脱只得到1个组分,而NaCl洗脱得到的是2个重叠峰,可确定为CYG-1和CYG-2,这与丁青芝等[18]在山药糖蛋白分离纯化与鉴定中的结果基本相近。进而通过一系列试验进一步鉴定了纯化得到的山药糖蛋白为纯品,且糖肽键特征分析结果表明山药糖蛋白的糖肽键是O-糖肽键,这与曾麒燕等[15]研究红桂木凝集素糖蛋白特征及其糖肽键性质的分析结果相似。
在DEAE-52柱层析纯化中分别使用NaHCO3和NaCl对山药糖蛋白粗提物进行洗脱,前者为碱性洗脱剂,酸性山药糖蛋白可能被中和,与填充物的吸附作用减弱,CYG-1和CYG-2一同被洗脱下来,故只得到1个组分;后者为中性洗脱剂,CYG-1和CYG-2与填充物之间吸附作用能力的差异导致它们分别被洗脱下来,故得到2个组分。在随后的SephadexG-75柱层析中,进一步证明了它们是单一的组分。
[1]Montreuil J,Vliegenthart J F G.Glyeoproteins[M].Amsterdam:Elsevier Science Publishing Company,Inc,1995
[2]朱科学,周惠明,郭晓娜.植物来源糖蛋白的结构与功能[J].食品与发酵工业,2002,28(12):57 -61
[3]Cyrille Grandjean,Alain Boutonnier,Bruno Dassy,et al.Investigation towards bivalent chemically defined glycoconjugate immunogens prepared from acid-detoxified lipopolysaccharide of Vibrio cholerae O1,serotype Inaba[J].Glycoconj Journal,2009,26:41 -55
[4]张兵,谢九皋.山药营养成分的研究[J].湖北农业科学,1996,11(6):56 -58
[5]赵彦青,王爱凤.山药的药理研究进展[J].中医研究,2000,13(5):49 -50
[6]费玉亭,乔建卫,蒋立勤.纤维素法提取山药多糖的工艺研究[J].农产品加工:学刊,2008,6:31 -34
[7]李金忠.山药糖蛋白的超声辅助提取及免疫功能调节作用[D].南京:江苏大学,2005
[8]Afoakwa E O,Sefa - Dedeh S.Textural and microstructural changes associated with the post-harvest hardening of trifoliate yam Dioscorea dumetorum tubers.Food Chemistry,2002,77(3),1 -6
[9]Gabriel Nama Medoua T Agbor - Egbe,C M F Mbofung.Study of the hard-to-cook property of stored yam tubers(Dioscorea dumetorum)and some determining biochemical factors[J].Food Research International,2005,38:143 - 149
[10]阚建全.甘薯糖蛋白的糖链结构与保健功能的研究[D].重庆:西南农业大学,2003
[11]江培翃,陆红,何正平,等.淀粉与碘的颜色反应与还原糖含量的关系[J].实验室研究与探索,2005(3):31-32
[12]李环,韦萍,欧阳平凯.嗜盐隐杆藻胞外多糖的分离、纯化及理化特性[J].天然产物研究与开发,2000,12(2):52-55
[13]傅应华.咔唑法测定鲨鱼硫酸软骨素含量的方法学研究[J].中国生化药物杂志,2007,28(1):54 -55
[14]陈彦,李一琨,包森林,等.白头翁糖蛋白的分离纯化及其性质[J].中国生化药物杂志,1997,18(4):180-183
[15]曾麒燕,周德义,吴耀生,等.红桂木凝集素糖蛋白的特征及其糖肽键性质的分析[J].广西医科大学学报,1999,15(3):293 -295
[16]胡明方,王光慈.食品分析(四)[M].重庆:西南师范大学出版社,1992
[17]罗芳.Folin-酚试剂法蛋白质定量测定[J].黔南民族师范学院学报,2005,3:46 -47
[18]丁青芝,马海乐,骆琳,等.山药糖蛋白的分离纯化与鉴定[J].食品科学,2008,29(7):217-220.
Purification Conditions and Physical and Chemical Identification of Chinese Yam Glycoprotein
Sun Yujing1,2Han Tao1Bian Ke3Li Liping4
(Department of Food Science,Beijing University of Agriculture1,Beijing 102206)
(Agri- Food Quality & Safety Testing Center,Yulin,Shaanxi2,Yulin 719000)
(Henan University of Industry3,Zhengzhou 450002)
(Beijing Plant Resources Research and Development Major Laboratory,Beijing Technology & Business University4,Beijing 100037)
Extracted crude glycoprotein from Chinese yam tuber was exposed for purification with DEAE-52 and Sephadex G -75 column chromatography.2 pieces of Chinese yam glycoprotein were obtained by the elution with NaCl solution,i.e.CYG -1 and CYG -2,but only one with NaHCO3solution.A couple of physical and chemical tests for identification were conducted on CYG -1 and CYG -2.The results showed that both of them were pure and acidic glycoprotein.The bonds connecting peptide and polysaccharides in CYG -1 and CYG -2 were O -type.The contents of protein or polysaccharide in them were 20.62%and 15.16%or 68.56%and 72.31%,respectively.
Chinese yam,glycoprotein,purification
TS209
A
1003-0174(2011)03-0081-05
农产品加工及贮藏工程北京市重点建设学科(PXM 2009-014207-078172)
2010-01-29
孙宇婧,女,1986年出生,农产品加工及贮藏工程
韩涛,男,1963年出生,教授,农产品加工及贮藏工程
