热应激蛋白用于诊断和评价过度训练的研究进展
2011-11-13马国东
徐 飞 马国东
(1.浙江工业大学体育科学研究所,浙江杭州 310023;2.吉林体育学院运动人体科学系,吉林长春 130022)
热应激蛋白用于诊断和评价过度训练的研究进展
徐 飞1马国东2
(1.浙江工业大学体育科学研究所,浙江杭州 310023;2.吉林体育学院运动人体科学系,吉林长春 130022)
运动应激可通过内外感受器、传入神经通路或内分泌系统支配、调节身体的适应性恢复过程。当运动员承受不了运动应激引起的各种非特异性变化的总和时就可能出现过度训练。研究发现,应激时引起应激蛋白(heat shock proteins,Hsps)的变化与机体运动疲劳和细胞损伤及修复程度有关,且热应激蛋白与机体内细胞内稳态密切相关,提示热应激蛋白和过度训练存在一定的联系。过度训练导致的热应激蛋白的变化可能是机体的内源性保护机制。故本文在综述运动应激、过度训练和热应激蛋白变化间联系的基础上,探讨并分析了骨骼肌Hsps对运动应激和过度训练的表达及其相关机制。
运动应激;热休克蛋白;细胞损伤;运动疲劳;过度训练
运动应激对身体的适应性恢复进行调节主要是通过刺激感受器、传入神经通路或内分泌系统而实现[1,2]。研究已证实应激蛋白对运动应激会出现反应性应答:运动疲劳、细胞损伤与肌细胞内稳态与应激蛋白都有密切联系,众多学者认为这很可能是机体内源性保护机制[3-6],有人甚至根据应激蛋白的变化能反应机体疲劳积累和细胞损伤修复的程度而认为应激蛋白和过度训练有关,但目前相关机制仍不明确,故本文在现有相关研究结果基础上综述了热应激蛋在诊断和评价过度训练方面的研究进展及机制,以期为一线的教练员、运动员和相关科研人员提供参考。
1 运动应激与过度训练的关系
应激(Stress)是指功能活动或损伤作引起的所有非特异性变化的总和。包括应激作用终止(恢复)或继续作用(适应)的复原[1,7]。对运动员而言,应激反应在日常训练、比赛中反复出现,其机体处于高度应激状态中[2,8]。而过度训练(Overtraining)一直是教练员和运动员高度重视但难以把握的一个问题,因为一旦造成过度训练,轻则仅影响运动成绩,重则可导致成运动员退役甚至对机体造成更多危害[8,9]。运动应激主要通过内外感受器、传入神经通路或内分泌系统调节机体的适应过程[10]。而当运动员承受不了运动应激引起的各种非特异性变化的总和时(疲劳积累、社会压力、人际关系、心理原因等),就可能造成过度训练或出现过度训练症状[7,8]。应激学说的研究重点是内分泌系统“垂体—肾上腺皮质—性腺轴”涉及到的众多激素[9],因为这些激素通过改变酶活性、细胞膜通透性而提高机体能源储备动员能力、提高能量供应和机体调节能力(包括酶和结构蛋白增加)以及提高免疫力和内环境的稳定等。
2 过度训练的成因及现有的诊断、评价指标
2.1 过度训练的成因
过度训练是指运动员长时间训练导致的身体疲劳和机能下降不能在短时间内恢复,使其疲劳症状不断加重且运动成绩下降[2,8,11];Lehman认为过度训练是训练和恢复、运动与运动能力、应激与应激耐受力间的失衡状态[12],过度训练是继发于运动训练的应激反应,其分为交感性和副交感型,生理机制尚不完全清楚[11]。当前的研究主要集中在过度训练与内分泌紊乱、免疫抑制和自主神经系统紊乱方面[1,11,13]。
2.2 过度训练现有的诊断和评价指标及不足
但过度训练是多种应激累积的结果,通常由生理和心理混合因素造成,所以目前尚无较为可靠的诊断指标。鉴于过度训练对运动成绩和健康的影响,预防和提前诊断是防治的重点[11,12],目前诊断和评价指标多采用内分泌激素和血清酶活性相关指标,如血清和尿中儿茶酚胺、血清睾酮、皮质醇及T/C比值、血清CK、LDH等的变化情况[11,13];但单一血液指标几乎不能真实反应运动员综合疲劳积累的情况,而全面测试血液激素和血清酶活性共需20-30ml血液且反馈结果较为滞后[13],给教练员和医务监督人员造成不便。但从运动系统角度考虑,训练主要由骨骼肌执行[14],若能从肌肉相关指标寻找比现有指标更敏感和有效的指标,对预防、诊断过度训练就有更为积极的作用。近年来运动应激导致应激蛋白的变化成为研究热点,有研究人员也认为应激蛋白的变化可用于诊断过度训练[15,16]。
3 热休克蛋白作为诊断和评价过度训练指标
3.1 热休克蛋白的的生物学功能及其调控机制
热应激蛋白(Heat Shock Proteins,Hsps)是一组结构高度保守的多肽,也称热休克蛋白。据分子量的大小(10-170KDa)可分为许多家族 ,如小 Hsps(Hsp20、泛素等)、Hsp40、Hsp60、Hsp70(Hsp72、Hsp73、Hsp75)等 ,其中 Hsp72 因其 N- 末端酶催化位点的ATPase活性,故其易被应激诱导而合成[17]。晚近科研人员尝试从分子水平、蛋白水平将其用于评价肌肉损伤和诊断早期过度训练[18]。
当机体受到缺血、高温和低氧等应激时,Hsp72在细胞内迅速合成[17,19],其合成量能占应激蛋白总量的20%[20]。因为细胞受到应激时新合成的Hsp72先转位到核内,随后聚集在核糖体前体颗粒区域附近[21],研究证实细胞核基质蛋白中含有Hsp72,提示Hsp72可能支撑并保护细胞核骨架[17],而胞浆中的Hsp72与其他蛋白结合,最终通过某种途径防御并修复各种应激对细胞的损伤[18,21]。在应激后的恢复期,细胞核内的Hsp72重新回到胞浆与中心体、微管蛋白重新装配,最终重新分配胞浆中的核糖体[22]。应激恢复后细胞生长过程中,Hsp72主要呈现为前体肽链的未折叠状态,以确保跨膜转运或蛋白转位,或解聚Hsp72结合折叠的错误目标蛋白,最终转位至过氧化酶体和溶酶体而实现其功能[17]。
3.2 热休克蛋白和运动疲劳、损伤的关系
运动应激导致的肌细胞功能紊乱或损伤加剧Hsp72合成(见表1),而大运动量、大强度训练时不同类型的运动方式(耐力训练或抗阻训练)对Hsp72的影响目前仍无定论。Thompson等[23]发现普通健康受试者肘关节极限强度离心收缩后,肱二头肌细胞Hsp72含量增加1064%。原有观点认为肌肉离心收缩后24-48h损伤最为严重,实验证实离心运动诱导骨骼肌细胞内Hsp72大量合成,提示运动应激诱导的Hsp72合成量可能与肌肉疲劳、损伤程度有关。从另一个角度而言,运动应激诱导的肌肉Hsp72合成对是否有助于防止运动损伤?McArdle等初步证实Hsp72可能对肌肉起保护作用[24]。Smolka等[25]对比训练8周的大鼠和对照组在跑台上跑至力竭,发现实验组大鼠比目鱼肌抗氧化酶浓度较高,Hsp72浓度没有变化;而对照组大鼠Hsp72合成大幅度增加、蛋白氧化损伤程度显著高于实验组,其比目鱼肌中的抗氧化酶浓度无显著变化,提示Hsp72与运动损伤后肌细胞的修复有关,也证实了McArdle的观点。更有意义的是发现长时间大强度运动诱导的Hsp72升高能防止细胞损伤,Liu等[26]发现CK(骨骼肌细胞损伤指标)在运动初始就升高,但随着细胞内Hsp72合成增加的量成反比,提示Hsp72的持续合成可能与长时间大强度训练加剧的疲劳损伤程度有关。Banfi等[16]发现优秀足球运动员血浆Hsp70水平与抗氧化指标变化趋势一直,都显著高于普通人,其认为Hsp70能反应出机体的疲劳状态。综上,Hsp与过度训练可能有内在联系,因为其参与了运动损伤的清除和修复过程,可考虑用于评价高水平运动员训练。
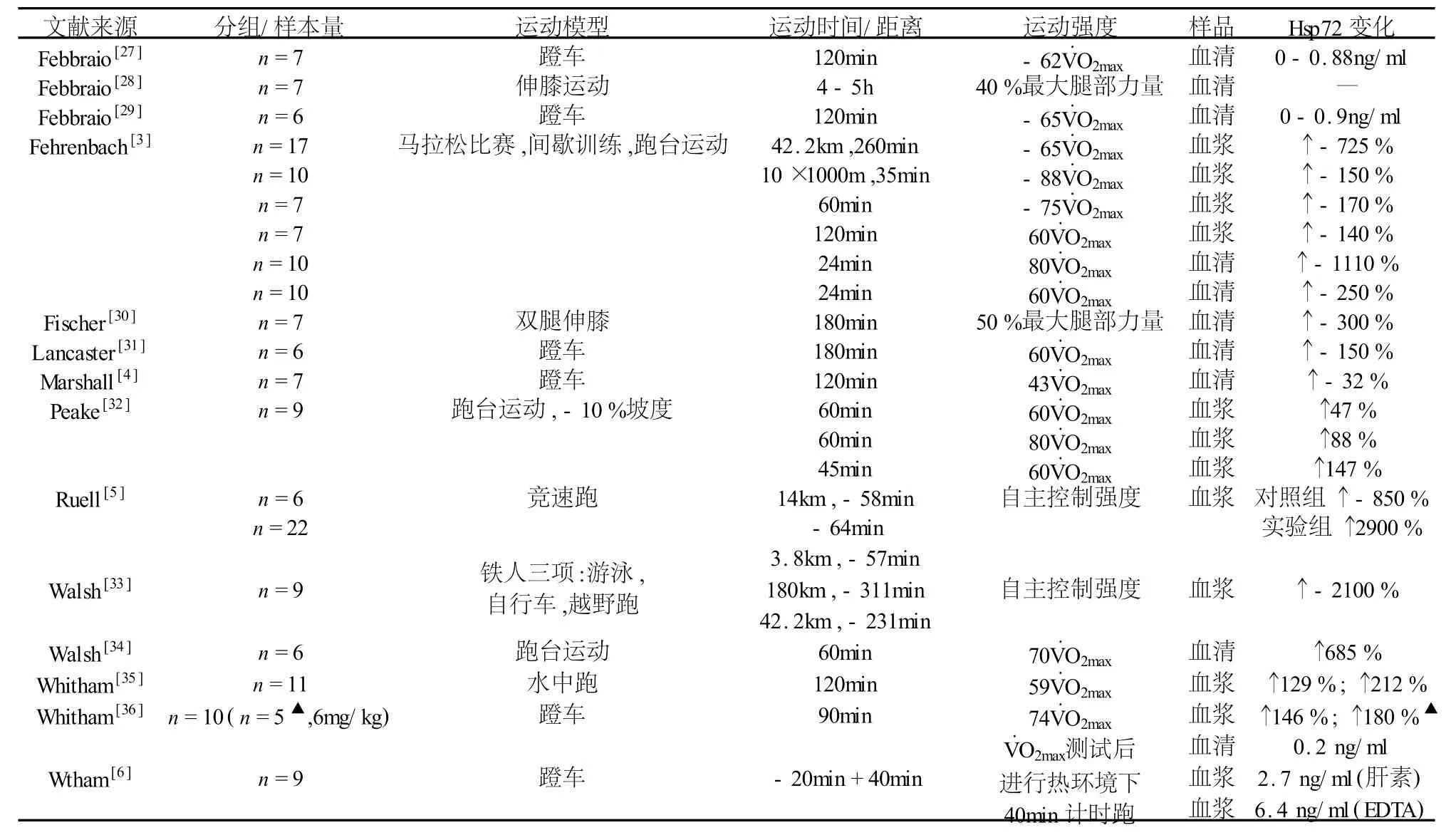
表1 运动后人体外周血中热休克蛋白(Hsp72)的变化情况
3.3 热休克蛋白作为诊断和评价过度训练指标的思考
3.3.1 骨骼肌 Hsps对运动应激和过度训练的表达
诸多研究都证实人体骨骼肌Hsps和运动应激、疲劳积累的关系密切,有人认为大强度运动才能诱导人骨骼肌Hsp72表达[37],Liu等研究发现,10名优秀划船运动员以4 mmol/L乳酸的无氧阈训练4周,股侧肌 Hsp70分别增加了181%、405%、456%、363%[38],提示骨骼肌 Hsp70表达量取决于运动强度[38]。但总的来看,骨骼肌内Hsp72表达呈现负荷依赖性而非强度依赖性(表1)。一次性大度离心运动后48 h肱二头肌活检发现,运动肌HSC/Hsp70显著高于对照肌,无训练经历者肱二头肌大强度离心收缩,48 h后活检发现Hsp70增加227%,Hsp70 mRNA水平增加128%[39]。Khassaf等[37]让受试者作 70%V·O2max单腿踏车 45 min 后 ,分别在 1、2、3、6天作股侧肌活检,到第6天Hsp70才显著增加。提示运动应激诱导骨骼肌细胞中Hsp70表达与肌肉损伤的修复和肌肉损伤修复后骨骼肌细胞的重塑有关。
Naito等[40]认为,运动导致的肌组织 Hsp72高表达弥补了低表达 Hsp72的不足,保护了肌组织免受有害应激的损伤。研究报道[19]SD大鼠以24 m/min速度运动后,其心肌、腓肠肌红肌Hsp70显著增高,但腓肠肌白肌Hsp70在跑速达27m/min才升高,而比目鱼肌Hsp70在15m/min时就升高,到最大速度33m/min时反而下降。大鼠长期大负荷训练后腓肠肌白肌Hsp72表达最高,腓肠肌红肌次之,比目鱼肌表达最低,与其基础值呈反比。以上各部位肌肉的肌纤维类型和募集方式都不同,推测骨骼肌Hsps的表达与肌肉募集方式、运动强度以及肌纤维类型有关[41]。Zoppi(2008)[15]通过大鼠8周Overreaching(训练过度)模型发现,比目鱼肌、趾长伸肌和半腱肌Hsp72显著升高,但随后的3周大强度耐力训练后只有比目鱼肌Hsp72升高,从而证实了以上理论假设和初步结论。此项研究初步将Hsp72用于诊断过度训练,虽然还有诸多问题,但是做出了非常有价值的尝试。
3.3.2 骨骼肌Hsps对疲劳积累和过度训练表达的可能机制
Hsps是骨骼肌细胞的组成部分,其能抵御多种应激攻击机体组织细胞、增强机体适应能力。当机体适应应激能力增强时Hsps也作出相应应答。所以当机体细胞在应激时为保护细胞免受损伤,组织只有下调细胞Hsps基础值(Hsps受合成量和基础值的限制)才能大量合成;而疲劳积累和过度训练时引起的损伤超出Hsp保护范围时,意味着细胞损伤与修复失衡,此假说在诊断和评价过度训练时有重要价值[15]。
理论推测,Hsp72在损伤、修复失衡的细胞中的表达极可能有别于正常细胞。Liu等[18]发现缺血性肌病患者安静状态下腓肠肌细胞中 Hsp72大量合成;另一种肌病患者肌细胞Hsp72合成量随病情的减轻而递减[17],这也提示过度训练可能导致细胞Hsp72异常表达,这不仅反映出细胞的应激程度,也提示Hsp72作为评价应激程度的可行性。综上,细胞中Hsps高表达一方面可能起保护作用,另一方面其表达异常也指示细胞的机能紊乱。而研究表明细胞内稳态失衡是过度训练的成因之一[42],提示其可能作为诊断和评价过度训练的指标。但目前尚缺乏足够的直接证据支持,因为尚没有广泛认可的关于多元、多因素应激造成的过度训练等效模型,而因人体实验受人道主义和其他客观条件的限制,也不能真正造成运动员过度,这也是过度训练受到质疑、诊断评价指标难以有效确立的重要原因之一。
在细胞水平,转录和翻译步骤决定机体应激时Hsps的合成水平,目前认为转录步骤是制约其合成的关键[43]。Hsp72转录主要受热休克转录因子1(HSF1)的调节,它能识别热休克反应元件(HSE)的靶序列。HSE是高度保守的顺式反应元件,位于 Hsp基因的编码区上游,由重复的 5’-nGAAn-3’核心序列组成,此序列是与 HSF1的结合域[17]。细胞安静状态Hsp72与HSF1结合成的单体无活性,其含量很低;蛋白正常的三维结构被应激造成的细胞蛋白损伤时所改变,暴露出与Hsp72有高度亲和性的疏水性位点,使Hsp72脱离无活性单体并与损伤蛋白结合,使HSF1成为游离单体;游离HSF1单体随即转化成有活性的三倍体,随后转位到细胞核内与HSE结合进行Hsp72基因转录[44],从而造成骨骼肌细胞内Hsps表达量增高。
4 结论
普遍认为过度训练是各种应激导致的疲劳积累与恢复失衡造成的,运动应激诱导骨骼肌细胞中Hsp合成,关联损伤的修复和肌肉重塑过程。而Hsps能抵御有害应激损伤细胞,并维持细胞稳态,这可能是机体的内源性保护机制。也提示Hsps和过度训练存在一定的联系。但这方面的研究才起步,将Hsps用于诊断、评价过度训练及其有效性尚需更多的研究证实。此外,Milne(2008)[45]发现运动应激后肌细胞Hsps的表达可能存在性别差异,这种差异是否存在还需进一步证实;若Hsps表达存在性别差异,将 Hsps用于诊断、评价过度训练时如何定量分型是后续研究必需考虑的问题。
研究还发现Hsps是分子伴侣且与MAPK形成信号竞争机制而拮抗MAPK信号转导[19],这提示Hsps在内源性保护细胞的同时也可能阻碍细胞的生长,而且其也可能在肌细胞信号转导方面有特殊作用。
[1]White LJ,Castellano V.Exercise and Brain Health-Implications for Multiple Sclerosis:Part II-Immune Factors and Stress Hormones[J].SportsMed,2008,38(3).
[2]王耀光,徐飞,贺业恒.女运动员三重综合征与过度训练研究综述[J].北京体育大学学报,2007,30(3).
[3]Fehrenbach E,Niess AM,Voelker K,etal.Exercise intensity and duration affect blood soluble HSP72[J].Int JSportsMed,2005,26(7).
[4]Marshall HC,Ferguson RA,Nimmo MA.Human resting extracellular heat shock protein 72 concentration decreases during the initial adaptation to exercise in a hot,humid environment[J].Cell Stress Chaperones,2006,11(2).
[5]Ruell PA,Thompson MW,Hoffman KM,et al.Plasma Hsp72 is higher in runners with more serious symptoms of exertional heat illness[J].Eur J Appl Physiol,2006,97(6).
[6]Powers SK,M LA,Demirel HA.Exercise,heat shock proteins,and myocardial protection from I-R injury[J].Med Sci Sports Exerc,2001,33(3).
[7]徐飞.用血氨作为监控短时大强度运动有效指标的实验研究[D].大连:辽宁师范大学硕士学位论文,2007.
[8]徐飞,夏志.过度训练与女运动员膳食紊乱、月经不调和骨质疏松间的关系与机制探讨[J].首度体育学院学报,2006,18(5).
[9]Meeusen R,Watson P,Hasegawa H,et al.Brain neurotransmitters in fatigue and overtraining[J].Appl Physiol Nutr Metab,2007,32(5).
[10]徐飞.对Plymetrics问题的再探究[J].天津体育学院学报,2007,22(1).
[11]Halson SL,Jeukendrup AE.Does overtraining exist?An analysis of overreaching and overtraining research[J].SportsMed,2004,34(14).
[12]Lehmann M,Foster C,Keul J.Overtraining in endurance athletes:a brief review[J].Med Sci Sports Exerc,1993,25(7).
[13]Petibois C,Cazorla G,Poortmans JR,et al.Biochemical aspects of overtraining in endurance sports:the metabolism alteration process syndrome[J].SportsMed,2003,33(2).
[14]徐飞,赵恒,吴健.力竭性“拉长—缩短周期”运动中离心收缩和相信收缩阶段肌肉疲劳和损伤及下肢主要关节用力特征研究[J].北京体育大学学报,2008,31(10).
[15]Zoppi CC,Macedo DV.Overreaching-induced oxidative stress,enhanced HSP72 expression,antioxidant and oxidative enzymes downregulation[J].Scand JMed Sci Sports,2008,18(1).
[16]Banfi G,Malavazos A,Iorio E,et al.Plasma oxidative stress biomarkers,nitric oxide and heat shock protein 70 in trained elite soccer players[J].Eur JAppl Physiol,2006,96(5).
[17]Snoeckx LH,Cornelussen RN,Van Nieuwenhoven FA,et al.Heat shock proteins and cardiovascular pathophysiology[J].Physiol Rev,2001,81(4).
[18]Liu Y,Steinacker JM.Changes in skeletal muscle heat shock proteins:pathological significance[J].Front Biosci,2001,6(2).
[19]Smith LL.Cytokine hypothesis of overt raining:a physiological adaptation to excessive stress?[J].Med Sci Sports Exerc,2000,32(2).
[20]Donati YR,Slosman DO,Polla BS.Oxidative injury and the heat shock response[J].Biochem Pharmacol,1990,40(12).
[21]Welch WJ,Feramisco JR.Nuclear and nucleolar localization of the 72,000-dalton heat shock protein in heat-shocked mammalian cells[J].JBiol Chem,1984,259(7).
[22]Welch WJ,Suhan JP.Cellular and biochemical events in mammalian cells during and after recovery from physiological stress[J].JCell Biol,1986,103(5).
[23]Thompson HS,Scordilis SP,Clarkson PM,et al.A single bout of eccentric exercise increases HSP27 and HSC/HSP70 in human skeletal muscle[J].Acta Physiol Scand,2001,171(2).
[24]McArdle F,Spiers S,Aldemir H,etal.Preconditioning of skeletal muscle against contraction-induced damage:the role of adaptations to oxidants inmice[J].J Physiol,2004,561(1).
[25]SmolkaMB,Zoppi CC,Alves AA,et al.HSP72 as a complementary protection against oxidative stress induced by exercise in the soleusmuscle of rats[J].Am J Physiol Regul Integr Comp Physiol,2000,279(5).
[26]Liu Y,Mayr S,Opitz-Gress A,et al.Human skeletal muscle HSP70 response to training in highly trained rowers[J].JAppl Physiol,1999,86(1).
[27]Febbraio MA,Ott P,Nielsen HB,et al.Exercise induces hepatosplanch-nic release of heat shock protein 72 in humans[J].J Physiol,2002,544(3).
[28]Febbraio MA,Steensberg A,Walsh R,etal.Reduced glycogen availability is associated with an elevation in HSP72 in contracting human skeletal muscle[J].J Physiol,2002,538(3).
[29]Febbraio MA,Mesa JL,Chung J,etal.Glucose ingestion attenuates the exer-cise-induced increase in circulating heat shock protein 72 and heat shock protein 60 in humans[J].Cell Stress Chaperones,2004,9(4).
[30]Fischer CP,Hiscock NJ,Basu S,etal.Vitamin E isoform-specific inhibition of the exercise-induced heat shock protein 72 expression in humans[J].JAppl Physiol,2006,100(5).
[31]Lancaster GI,Moller K,Nielsen B,et al.Exercise induces the release of heat shock protein 72 from the human brain in vivo[J].Cell Stress Chaperones,2004,9(3).
[32]Peake JM,Suzuki K,Hordern M,et al.Plasma cytokine changes in relation to exercise intensity and muscle damage[J].Eur J Appl Physiol,2005,95(56).
[33]Walsh RC,Koukoulas I,Garnham A,et al.Exercise increases serum Hsp72 in humans[J].Cell Stress Chaperones,2001,6(4).
[34]Whitham M,Laing S,Jackson A,et al.Effects of Prolonged Exercise with and without a Thermal Clamp on Extracellular Hsp72 Concentration[J].Med Sci Sports Exerc,2006,38(1).
[35]Whitham M,Walker GJ,Bishop NC.Effect of caffeine supplementation on the extracellular heat shock protein 72 response to exercise[J].JAppl Physiol,2006,101(4).
[36]Whitham M,FortesMB.Effect of blood handling on extracellular Hsp72 concentration after high-intensity exercise in humans[J].Cell Stress Chaperones,2006,11(4).
[37]Khassaf M,Child RB,McArdle A,et al.Time course of responses of human skeletal muscle to oxidative stress induced by nondamaging exercise[J].J Appl Physiol,2001,90(3).
[38]Liu Y,LormesW,Baur C,et al.Human skeletal muscle HSP70 response to physical training depends on exercise intensity[J].Int J Sports Med,2000,21(5).
[39]Milne KJ,Noble EG.Exercise-induced elevation of HSP70 is intensity dependent[J].J Appl Physiol,2002,93(2).
[40]Naito H,Powers SK,Demirel HA,et al.Exercise training increases heat shock protein in skeletal muscles of old rats[J].Med Sci Sports Exerc,2001,33(5).
[41]Lehmann M,Foster C,Dickhuth HH,et al.Autonomic imbalance hypothesis and over training syndrome[J].Med Sci Sports Exerc,1998,30(7).
[42]Liu Y,Lormes W,Wang L,et al.Different skeletal muscle HSP70 responses to high-intensity strength training and low-intensity endurance training[J].Eur JAppl Physiol,2004,91(23).
[43]Morimoto RI,Sarge KD,Abravaya K.Transcriptional regulation of heat shock genes.A paradigm for inducible genomic responses[J].J Biol Chem,1992,267(31).
[44]Thompson HS,Clarkson PM,Scordilis SP.The repeated bout effect and heat shock proteins:intramuscular HSP27 and HSP70 expression following two bouts of eccentric exercise in humans[J].Acta Physiol Scand,2002,174(1).
[45]Milne KJ,Noble EG.Response of the myocardium to exercise:sex-specific regulation of hsp70[J].Med Sci Sports Exerc,2008,40(4).
The Research Development of Diagnosing and Evaluating the Overtraining by Heat Shock Proteins
Xu Fei1,Ma Guodong2
(1.Institute of Sports Science Research,Zhengjiang University of Technology,Hangzhou,310023,Zhejiang,China;2.Department of Human Morement Science,Institute of Jilin Physical Education,Changchun,130022,Jilin,China)
Exercise stress can regulate the body recovery process adaptability by both inside and outside receptors ,afferent pathways or endocrine system control.When the athletes could not bear exercise stress caused by the sum of non - specific changes may lead to overtraining syndrome. The up - regulation of stress protein (heat shock proteins ,Hsps) changes caused by stress can reflect the fatigue accumulation and repair of cell damage indicate that there are certain links between Hsps and overtraining. The responses and adaptations of Hsps on the fatigue ,cell damage are closely related with muscle homeostasis and rehabilitation. And it is one of endogenous protection mechanisms. The authors review the relationship of exercise stress ,overtraining and heat shock proteins.Also ,analyze the expression of Hsps on exercise and overtraining and discuss the possible mechanisms.
exercise stress;heat shock proteins;cell damage;exercise fatigue;overtraining
G804.5
A
1672-1365(2011)04-0012-04
2011-02-13;
2011-04-20
徐飞(1981-),男,重庆人,博士,讲师,研究方向:运动机能评定。
