微直流电场对大肠杆菌生长代谢活性的作用*
2011-11-08周生学
周生学 马 洁
(1.宁夏师范学院化学与化学工程学院,固原,756000;2.首都师范大学化学系,北京,100048)
微直流电场对大肠杆菌生长代谢活性的作用*
周生学1**马 洁2
(1.宁夏师范学院化学与化学工程学院,固原,756000;2.首都师范大学化学系,北京,100048)
对大肠杆菌(Escherichia coli,DH5α)培养液在连续培养时分别通入不同强度的直流电场,研究了其在持续直流电刺激下的生长曲线、pH曲线、ATP酶活性、胞内总蛋白含量、细胞膜通透性以及细菌微观形态变化.结果表明,适宜的直流电能够促进大肠杆菌增殖;大肠杆菌的ATP酶活在25 mA电流作用下在对数生长前期、对数生长后期和稳定期分别比对照组同期提升1.68、1.57和1.31倍,表明适宜强度的电场增强了细菌细胞的代谢活性.细菌通透性也有不同程度提高,与通过透射电镜观察到细菌细胞通电后的形态变化具有一致性.
直流电场,生长代谢,大肠杆菌,酶活性.
用电化学方法刺激微生物改变正常生长代谢的技术在微生物发酵、微生物冶金[1]、细菌快速检测[2]、生物医药及微生物土壤修复[3]等领域越来越受到人们的关注.目前使用的通电培养方法是在微生物培养液中通入微小直流电流,筛选得到对微生物细胞有利的电流刺激条件[4].这种方法对酵母菌的发酵物产量及生物脱氮速率有明显提高[5];Matsumoto研究表明采用这种技术可以刺激细菌生长,并将微生物的生长期延长3倍,同时大幅增加细菌数量,减少能耗[6].清华大学刘铮等人研究了直流电场对细菌Enterobacter dissolvens生长代谢的影响,认为10 mA是该菌生长的适宜电流强度,而电流强度大于100 mA则会对细菌生长产生抑制作用[7].直流电场对微生物作用机制复杂,掌握这种机制,对调控电流以有效调节微生物生长代谢在微生物工业生产中的应用具有重要意义.
大肠杆菌(Escherichia coli,DH5α)具有遗传背景清楚,技术操作和培养条件简单,大规模发酵经济等优点[8],目前是在基因工程中应用最广泛、最成功的表达体系,常做高效表达的首选体系.因此对大肠杆菌的深入研究具有很重要的学术和应用意义.
本文通过控制直流电流强度对大肠杆菌DH5α进行电场刺激,探索了有利于提高大肠杆菌DH5α生长代谢的合适电流条件及其作用机理,并且探究了在不同电流条件下大肠杆菌DH5α生长代谢过程中菌体蛋白质和酶活性等代谢过程的变化情况,得到了较系统的实验结果,为进一步研究直流电场作用于大肠杆菌DH5α细胞的电场生物效应作用机制提供了实验参考.
1 实验部分
1.1 试剂与仪器
SONICS VC605超声细胞破碎仪;HITACHI H-700电子透射显微镜;3K15型德国西格玛台式高速冷冻离心机(Sigma公司);VMP3多通道电化学工作站(法国Bio-Logic公司);721B型分光光度计(上海第三分析仪器厂);Milli-Q超纯水处理器(美国Millipore公司);钛网对电极;ATP酶活测试盒(南京建成生物工程研究所);酵母浸粉、胰蛋白胨(北京双旋微生物培养基制品厂).
1.2 细菌的培养和活化
大肠杆菌(Escherichia coli,DH5α)由本校微生物实验室提供.使用LB液体培养基:酵母浸粉5 g·L-1,蛋白胨 10 g·L-1,氯化钠 10 g·L-1,pH 7.0.
从斜面菌体接种1环到盛有200 mL已灭菌(在0.11 MPa,121℃条件下灭菌20 min)液体培养基的锥形瓶中,于37℃在恒温摇床(150 r·min-1)中培养约10 h,此时获得的细菌细胞处于对数生长期初期.
1.3 微直流电刺激实验
微直流电刺激实验在三口玻璃电解瓶中进行.加电阴、阳两极均为钛网电极(表观面积3 cm ×3 cm,间距2 cm,通过测定电容值估算实际面积约为220 cm2[9]).从经1.3活化培养的200 mL纯菌液中取振荡均匀的细菌培养液3 mL,接种到盛有300 mL已灭菌LB液体培养基的电解瓶中加直流电处理,摇床恒温培养 (温度37℃,转速150 r·min-1),以不加电培养作为空白对照.为了保证不同生长期细胞处理结果的可比性,以上所有操作,包括细胞的培养,均保持实验条件的完全平行,且图1中数据均为3次重复测定的平均值.
1.4 分析方法
细菌浓度检测 采用平板计数法或测量660 nm波长处的吸光度值以反映细菌浓度.
细胞ATP酶活检测 取待测菌悬液在细菌生长对数前期,对数后期和稳定期的细菌进行处理后,用总ATP酶测定试剂盒测定ATP酶活性.其活性单位为:每mg蛋白中,ATP酶每小时分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位,单位为μmol·mg-1·h-1.
细胞显微观察 将细菌样品溶液数滴滴在硫酸纸上,用带膜铜网面向下放在液滴上,吸附3—5 min,取出后用滤纸吸干;用3%磷钨酸染色1—2 min,用滤纸吸干残液,用透射电子显微镜(HITACHI H-700 TEM)观察细菌的显微形态.
大肠杆菌总蛋白含量的测定:采用考马斯亮蓝法检测细菌内总蛋白含量.
大肠杆菌在直流电场刺激下的通透性测定 测定大肠杆菌DH5α培养液离心处理后上清液中蛋白质的浓度来反映细菌通透性变化.方法为:取5 mL待测菌液,5000 r·min-1离心20 min,取上清液稀释后用考马斯亮蓝蛋白测定试剂盒测定.
电化学循环伏安曲线测定 以钛盘电极(电极面积为0.927 cm2)为工作电极,铂网电极为对电极,饱和甘汞电极(SCE)为参比电极构成三电极体系,采用VMP多通道电化学工作站对灭菌后的新鲜培养基进行循环伏安实验,以表征培养基的电化学特性.
2 结果与讨论
2.1 微直流电场对大肠杆菌DH5α生长和pH值的影响
微直流电场对大肠杆菌DH5α生长的影响见图1.在不通入电流条件下测定了加入钛电极和不加电极时菌株的生长曲线,结果表明,所用钛电极对细菌的生长无明显干扰(数据略).
由图1可见,当外加直流电10 mA,培养30 h时,菌液的A660达到最大,与不加电场时菌液A660的最大差值为0.500,大肠杆菌DH5α生长较好;当电流强度为25 mA时,细菌在培养过程中生长曲线均高于对照组和加电10 mA菌株,当培养26 h时,菌液的A660达到最大,与对照组相比最大差值为0.524,大肠杆菌DH5α与其它电流条件处理的菌液相比生长最好;当电流强度增至35 mA,菌液的A660与对照组相比逐渐靠近.而当电流强度增至100 mA,菌液的A660开始低于对照组菌液的A660,说明电流强度增大到100 mA对大肠杆菌DH5α正常增殖具有抑制作用.由此可见,当电流强度为10—25 mA时可以促进大肠杆菌DH5α的生长,其中最佳电流强度为25 mA.
pH值影响到微生物对营养物的吸收程度[10]以及细菌胞内和胞外酶的活性.微直流电场对菌液pH的影响见图2.由图2可见,细菌在0—2 h,pH均有所下降;到4 h后开始上升,10 h后变化趋于平缓,通电菌样与不通电菌样的pH相比差距较小,维持在0.1—0.4之间;且通电组与对照组相比随着电流强度的不同,pH在4 h后上升速度也不同[11-12].本课题组对此现象的原因也进行了分析[13].
2.2 微直流电场对大肠杆菌DH5α总蛋白含量的影响
微直流电场对大肠杆菌DH5α总蛋白含量的影响见图3.为了保证实验的准确性及不同生长期细菌的可比性,实验中的实验条件是平行的,图中数据都是3次测定取平均值.如图3所示,在对数生长前期(earlier log phase),加电流25 mA大肠杆菌DH5α胞内总蛋白含量低于对照组菌液和加电10 mA菌液,说明25 mA电流强度在对数生长前期对细菌生长略有抑制,与其生长曲线吻合;在对数生长后期(later log phase),25 mA电流的胞内总蛋白含量为0.264 g·L-1,是0 mA对照组菌液在同一生长时期的1.11倍,并高于同期的10 mA加电菌液;在稳定期(stable phase),25mA电流的胞内总蛋白含量为0.286 g·L-1,是0 mA对照组菌液在同一生长时期的1.13倍,并高于同期的10 mA加电菌液.由此可见,10—25 mA电流强度可以适当提高大肠杆菌DH5α胞内总蛋白含量,促进菌体生长.
2.3 微直流电场对大肠杆菌DH5α ATP酶活性的影响
细胞生长过程中伴随有ATP等能量物质的生成,而细胞ATP酶在细胞内外物质传送,能量转换以及信息传递方面具有重要作用,是维持细胞营养物质浓度稳定的重要酶类[8],常用于表征细胞的代谢活力.为研究电极反应对DH5α代谢活力的影响,监测了细胞ATP酶活性的变化.结果如图4所示,加电流25 mA的大肠杆菌DH5α在对数生长前期的ATP酶活性为5.21 μmol·mg-1·h-1,是0mA对照组菌液同期ATP酶活性的1.68倍;而其在对数生长后期的ATP酶活性为7.88 μmol·mg-1·h-1,是对照组菌液同期的1.57倍;在稳定期,加25 mA电流的ATP酶活性则为0 mA对照组菌同期的1.31倍.由此可见,10—25 mA的电流强度可以增强DH5α的ATP酶活性,提高细菌的生长活性,其中对DH5α ATP酶活性提升效果最好的电流强度为25 mA.大肠杆菌DH5α在加入适宜的直流电时ATP酶活性增加的原因,可能是由于电场处理导致ATP酶的构象发生改变.Tsong等报道了生物膜ATP酶能够从规则的交变电场中吸收自由能并做功[14].这表明ATP酶能够从外加电场吸收能量,补充生理活动中作为生物膜离子泵功能所需的能量,促进代谢水平.
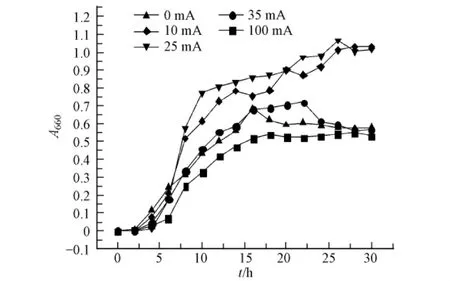
图1 大肠杆菌DH5α在不同电流下的生长曲线Fig.1 Growth curves of DH5α under different current magnitude

图2 大肠杆菌DH5α在不同电流下的pH曲线Fig.2 pH curves of DH5α under different current magnitude
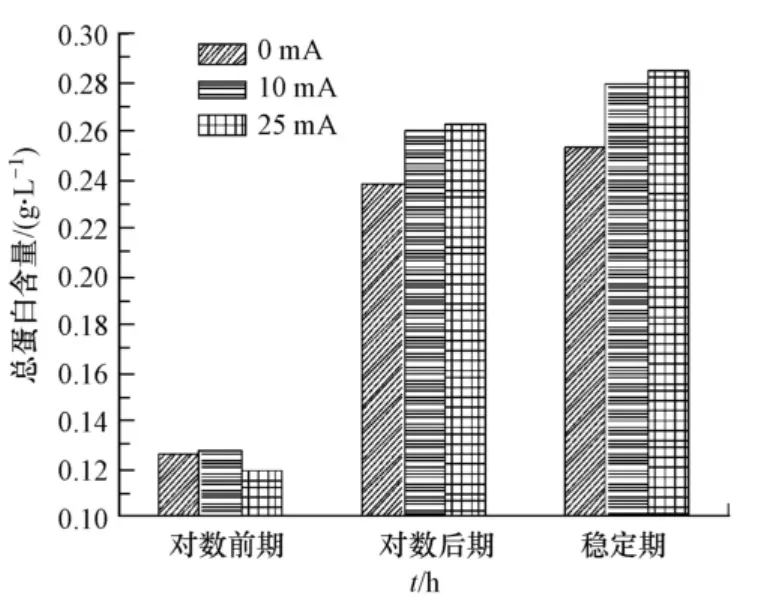
图3 微直流电场对大肠杆菌DH5α总蛋白含量的影响Fig.3 Protein concentration of DH5α in different DC electric fields

图4 微直流电场对大肠杆菌DH5α ATP酶活性的影响Fig.4 ATPase Activity of DH5α in different DC electric fields
2.4 微直流电场对大肠杆菌DH5α生长形态的影响
进一步监测细菌生长形态的变化过程,于20 h分别取出电解瓶和参照瓶中的细胞样品,经染色后,用透射电子显微镜(TEM)进行显微观察.如图5所示,在25 mA微直流电场作用下的大肠杆菌DH5α培养液,其菌体细胞表面形貌与对照组相比,形态结构仍然完整,且细菌形状略有胀大(图5A、B);在对细胞个体的TEM图中也发现了同样的现象(图5C、D).这有可能是电场使得ATP酶活性增强,而一些ATP酶具有细胞膜上营养物质运输通道的功能,从而促进细胞膜上的营养物质通道一定程度开放,胞外营养物质输入增多.

图5 透射电镜下受微直流电场作用细胞及参比样细胞的表面形貌(A)大肠杆菌DH5α不加电(放大7000倍);(B)大肠杆菌DH5α加电25 mA(放大7000倍);(C)大肠杆菌DH5α不加电(放大30000倍);(D)大肠杆菌DH5α加电25 mA(放大30000倍)Fig.5 TEM micrograph of cells coped with and without DC electric field
2.5 大肠杆菌DH5α在直流电场刺激下的通透性
通过测定菌悬液离心后上清液中蛋白质浓度的变化反映细菌通透性的变化.对液体培养基中蛋白含量的检测表明,液体培养基本身含有的蛋白含量很少,对样品中的蛋白质检测无明显干扰.如图6所示,加电10 mA和25mA菌液离心后上清液中蛋白质浓度与对照组相比明显升高,说明细菌分泌或运输到体外蛋白含量增多.
结合图5可以看出,在所加入直流电场下,细菌形态完好,这说明外加适宜强度的直流电流可以在不损伤细菌细胞的情况下增强细胞膜通透性,提高细胞向胞外运输物的量.这对于菌体内外物质交换及与此有关的细菌生长代谢过程具有积极意义.
有研究表明这些运输物有可能是细菌代谢过程中分泌到细菌体外的胞外糖蛋白和酶类[15-16].
2.6 大肠杆菌电化学循环伏安曲线测定
为了表征培养基的电化学特性,考察了LB培养基的循环伏安曲线.以钛盘状电极为工作电极,铂网电极为对电极,饱和甘汞电极(SCE)为参比电极构成三电极体系,采用VMP多通道电化学工作站对灭菌后的新鲜培养基进行循环伏安实验,扫速为200 mV·s-1,扫描范围为-2 V到2 V.在此范围内主要存在3个电极反应,阳极主要为析氧反应(2H2O=O2+4H++4e-),阴极主要为析氢反应(2H2O+2e-=H2+2OH-),此反应分为两步,第一步为水分子得电子形成吸附氢(H2O+M+e-=MH+OH-),第二步为吸附氢脱附形成氢气;以及析氢反应所产生氢的氧化反应.
由图7可以看出,大肠杆菌直流电刺激培养过程中,电极反应主要为水电解的析氢反应,电极反应产物主要为H2、O2和吸附在电极上的活性H原子.活性H原子是一种很好的电子供体,能被附着在电极表面的微生物充分利用进行各种生理活动,能够作为供氢体供细菌更好地生长.同时生成的氧气对好氧菌的生长也有一定影响.
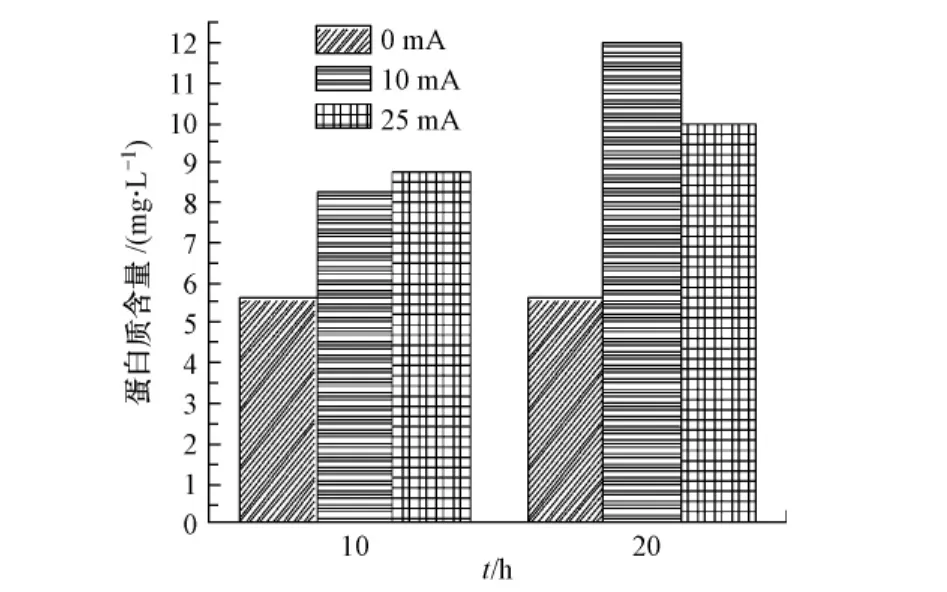
图6 大肠杆菌DH5α培养液上清液蛋白含量Fig.6 The protein concentration of DH5α solution supernant with different DC currents

图7 大肠杆菌LB培养基用钛电极扫描的循环伏安图Fig.7 The CV curve of LB liquid medium on Ti electrode
3 结论
(1)在菌液中加适宜强度的电场,能促进大肠杆菌DH5α生长,增加DH5α细菌胞内总蛋白含量,增强细菌ATP酶活性,提高菌株的代谢水平.
(2)外加适宜强度的直流电场可以在一定范围内不损伤细菌的情况下增强细胞膜通透性,提升细胞代谢活力,提高菌向胞外分泌物的量.
(3)对大肠杆菌DH5α直流电刺激培养过程中的循环伏安法分析表明,电极反应主要为水电解反应.电解水产物为菌的有氧反应和还原反应提供更充足的O2、吸附氢和H2.电极反应产物中的H2和原子态氢(H)能够作为供氢体供细菌更好地生长.
[1]禾志强,刘进荣,刘启旺.微生物在过渡金属脱硫中的应用[J].环境化学,2009,28(1):31-34
[2]Perez F,Tryland I,Masnini M J.Electrochemical detection of coliforms in drinking water using a tyrosinase composite biosensor[J].Anal Chim Acta,2001,427:49-55
[3]许友泽,杨志辉,向仁军.铬污染土壤的微生物修复[J].环境化学,2011,30(2):555-560
[4]Valle A,Zanardini E,Abbruscato P,et al.Effects of low electric current(LEC)treatment on pure bacterial cultures[J].Journal of Applied Microbiology,2007,103(5):1376-1385
[5]Olszanowski A,Piechowiak K.The use of an electric field to enhance bacterial movement and hydrocarbon biodegradation in soils[J].Pol J Environ Stud,2006,15(2):303-309
[6]Matsumoto N,Nakasono S,Ohmura N.Extension of logarithmic growth of Thiobacillus ferrooxidans by potential controlled electrochemical reduction of Fe(Ⅲ)[J].Biotechnol Bioeng,1999,63:79-85
[7]She P,Song B,Xing X H,et al.Electrolytic stimulation of bacteria Enterobacter dissolvens by a direct current[J].Biochemical Engineering Journal,2006,28:23-29
[8]李民,陈常庆.重组大肠杆菌高密度发酵研究进展[J].生物工程进展,2000,20(2):26-31
[9]巴德A J,福克纳L R.电化学方法[M].北京:化学工业出版社,1984
[10]Riklin A,Katz E,Willner I,et al.Improving enzyme electrode contacts by redox modification of cofactors[J].Nature,1995,376:672-678
[11]刘镔,马洁等.直流电场对脱硫菌红串红球菌NCC-生长及脱硫性能的影响[J].石油化工,2010,39(6):669-675
[12]杨苏声,周俊初.微生物学[M].北京:科学出版社,2005:403-434
[13]孙西同,马洁,孙晓彦,等.大肠杆菌的直流电场刺激过程[J].微生物学通报,2010,37(10):1440-1446
[14]Tong T Y.Electric activation of membrane enzymes//First East Asian Symposium on Biophysics[C].Japan:The Biophysical Society of Japan,1994:39-40
[15]张光先,张济龙.高压静电场对过氧化氢酶的稳定作用及机理研究[J].激光生物学报,2001,10(1):44-47
[16]宋素琴.新疆胀果甘草内生细菌枯草芽胞杆菌产甘草酸类代谢产物的初步研究[J].微生物学通报,2008,35(9),1439-1443
EFFECT OF DIRECT CURRENT ELECTRIC FIELD ON THE GROWTH AND METABOLISM OF ESCHERICHIA COLI
ZHOU Shengxue1MA Jie2
(1.College of Chemistry& Chemical Engineering,Ningxia Teachers'University,Guyuan,756000,China;2.Department of Chemistry,Capital Normal University,Beijing,100048,China)
Different direct currents were provided for Escherichia coli DH5α in liquid medium during the bacteria's continuous culture.The growth curve,pH value,ATPase activity and TEM micrograph of the bacterial cells were investigated.The results indicate that direct currents accelerated the multiplication of the bacteria,and 25 mA current promoted the ATPase activity of Escherichia coli DH5α,which is consistent with its TEM micrograph.
direct current electric field,metabolism,Escherichia coli,ATPase activity
2011年3月8日收稿.
*宁夏回族自治区自然科学基金(No.NZ10227)资助;宁夏师范学院科学研究基金(YB2010010)资助.
**通讯联系人,Tel:15825341361;E-mail:shengxuezhou@yahoo.com.cn
