蒽酮-硫酸法测定枸杞多糖含量的研究
2011-11-06张盛贵
魏 苑,张盛贵
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
蒽酮-硫酸法测定枸杞多糖含量的研究
魏 苑,张盛贵*
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
采用蒽酮-硫酸法测定枸杞多糖含量并对其测定条件进行研究。结果表明:样液与蒽酮-硫酸试剂加入量的体积比为1∶2,加热煮沸5min,冷却后放置8min,625nm比色。精密度实验RSD值为1.27%,平均回收率为99.78%,RSD为2.26%,测得样品中枸杞多糖含量为1.14%。
枸杞多糖,蒽酮-硫酸法,测定
1 材料与方法
1.1 材料与仪器
鲜枸杞 产自甘肃省景泰县;无水乙醇、硫酸、蒽酮、葡萄糖 均为分析纯;2g/L蒽酮-硫酸溶液称取0.2g蒽酮,溶解于100mL浓硫酸中,当天配制。
7202B可见分光光度计 尤尼柯(上海)仪器有限公司;HH-S24型数显恒温水浴锅 金坛市大地自动仪器厂;AL104型电子天平 梅特勒-托利多仪器(上海)有限公司;UV-2550紫外-可见分光光度计岛津国际贸易(上海)有限公司。
1.2 实验方法
1.2.1 枸杞多糖样液的制备[15]准确称取经捣碎的鲜枸杞1~2g(精确到0.0001),置于圆底烧瓶中,加入80%乙醇溶液200mL,于水浴中回流提取1h。趁热过滤,残渣用热乙醇溶液洗涤(约10mL×10),残渣连同滤纸置于烧瓶中,加蒸馏水100mL,于水浴中回流提取1h,趁热过滤,残渣用热蒸馏水洗涤(约10mL ×10),洗液并入滤液,冷却后移入250mL容量瓶中,用蒸馏水定容,待测。
1.2.2 最大吸收波长和蒽酮试剂用量的确定 分别吸取2.0mL葡萄糖标准溶液和枸杞多糖样液于25mL具塞试管中,在冰水浴中依次加入蒽酮溶液3、4、5、6、7、8mL,置于沸水中加热煮沸10min,取出后用流动水冷却,室温放置10min,同时以蒸馏水代替样液作空白,于430~800nm范围内扫描,分别确定最大吸收波长和蒽酮试剂用量。
1.2.3 加热时间的确定 分别吸取2.0mL葡萄糖标准溶液和枸杞多糖样液于25mL具塞试管中,在冰水浴中加入4mL蒽酮溶液,置于沸水中加热煮沸3、5、8、10、12、15、18、20min,取出后用流动水冷却,室温放置10min,在最大吸收波长下测定吸光度,确定最佳的加热时间。
1.2.4 显色时间的确定 分别吸取2.0mL葡萄糖标准溶液和枸杞多糖样液于25mL具塞试管中,在冰水浴中加入4mL蒽酮溶液,置于沸水中加热煮沸一定时间,取出后用流动水冷却至室温,立刻倒入比色皿中,在最大吸收波长下,每隔2min读取吸光度,确定最佳的显色时间。
1.2.5 标准曲线的绘制 精密称取经105℃干燥恒重的标准葡萄糖0.05g(精确到0.0001g),加水溶解并定容至1000mL,即得50μg/mL葡萄糖标准溶液。精密吸取此标准溶液0、0.4、0.6、0.8、1.0、1.2、1.4、1.6mL分别置于25mL具塞试管中,各加蒸馏水使体积为2.0mL,在冰水浴中加入一定量的2g/L蒽酮-硫酸溶液,摇匀,置沸水浴中加热煮沸一定时间,取出后用流动水冷却,并放至室温,以零管为空白,于625nm处测定吸光度,绘制标准曲线。
1.2.6 精密度实验 取6份2.0mL葡萄糖标准溶液和枸杞多糖样液于25mL具塞试管中,按1.2.5方法先后6次测定其吸光度,考察该方法的精密度。
1.2.7 回收率实验 做3组,每组做3份平行样,均吸取2.0mL枸杞多糖液于25mL具塞试管中,按1.2.5方法测定其吸光度,再分别加入0.5、1.0、1.5mL枸杞多糖样液于25mL具塞试管中,按1.2.5方法测定其吸光度,计算平均回收率。
2 结果与分析
2.1 测定条件分析
2.1.1 最大吸收波长和蒽酮试剂用量的确定 通过对扫描图1结果研究发现,当蒽酮-硫酸溶液加入量为4mL时,其最大吸收波长为625nm,且此时的吸光度达到最大值;同时由扫描图2结果可知,当蒽酮-硫酸溶液加入量为4mL时,其最大吸收波长为624~627nm,且此时的吸光度达到最大值。而蒽酮-硫酸溶液加入量为3、5、6、7、8mL时,最大吸收波长分别为627、624~633、622、632、664~671nm。

图1 蒽酮-硫酸溶液用量对葡萄糖吸收波长的影响注:1-蒽酮-硫酸溶液加入量为3mL; 2-蒽酮-硫酸溶液加入量为4mL; 3-蒽酮-硫酸溶液加入量为5mL; 4-蒽酮-硫酸溶液加入量为6mL; 5-蒽酮-硫酸溶液加入量为7mL; 6-蒽酮-硫酸溶液加入量为8mL;图2同。
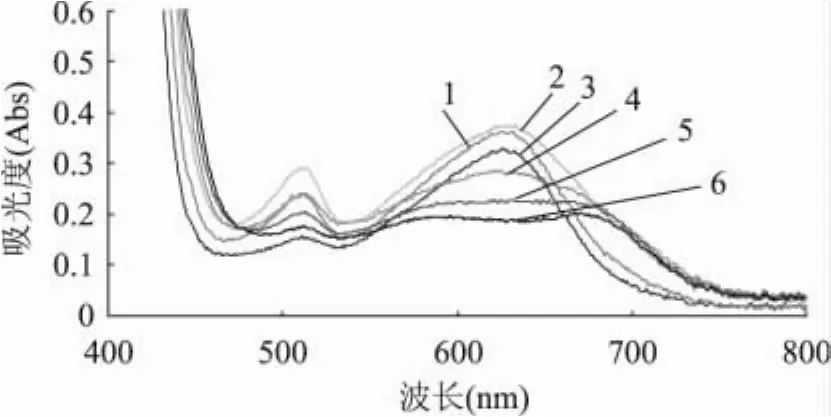
图2 蒽酮-硫酸溶液用量对枸杞多糖吸收波长的影响
根据上述结果分析可知,蒽酮-硫酸溶液加入量不同对其最大吸收波长及吸光度的影响很大,葡萄糖标准溶液与枸杞多糖样液的最大吸收波长均在625nm处有最大吸收峰,综合考虑,选择625nm作为测定波长,蒽酮-硫酸溶液加入量为4mL,即样液与蒽酮-硫酸溶液加入量的体积比为1∶2。
2.1.2 加热时间的确定 由图3可知,对于葡萄糖标准溶液加热5min后吸光度达到最大值,到10min后下降的趋势明显;对于枸杞多糖样液,在5min时达到最大吸光度,随着加热时间的延长,吸光度出现下降的趋势。这是由于浓硫酸对多糖的水解反应需要一定的时间,时间过短,反应不完全,吸光度则偏小。时间过长,则由于浓硫酸的强氧化作用,破环了反应产物的结构,造成吸光度减小。所以煮沸5min是较为合适的枸杞多糖测定条件。
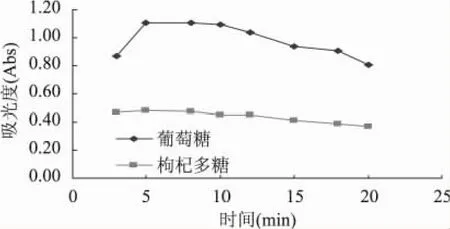
图3 不同加热时间对测定结果的影响
2.1.3 显色时间的确定 葡萄糖标准溶液和枸杞多糖样液反应冷却放置30min内显色基本稳定(图4);在4~10min内枸杞多糖样液吸光度稍微增大,其中8min时达到最大值,且相对稳定,12min后有所下降。综合考虑,比色时间不超过12min为宜,实验中选择在冷却后放置8min后比色。
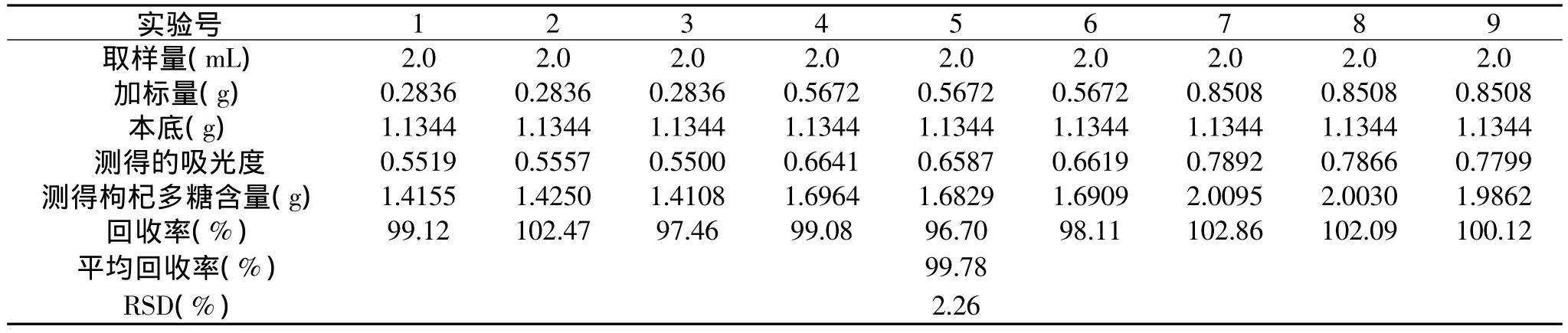
表2 回收率实验结果
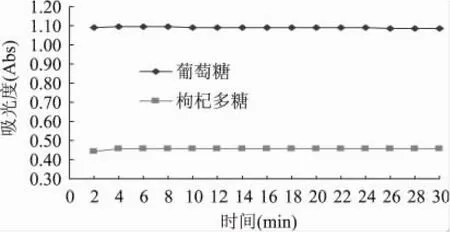
图4 不同显色时间对测定结果的影响
2.2 条件验证
2.2.1 标准曲线的绘制 综合上述确定的最佳条件,按1.2.5方法测定吸光度,绘制标准曲线,结果见图5。由图5可知,在葡萄糖含量为0~100μg/L范围内有良好线性关系。得标准曲线回归方程为:y= 0.0075x-0.0136,回归系数R2=0.9990。
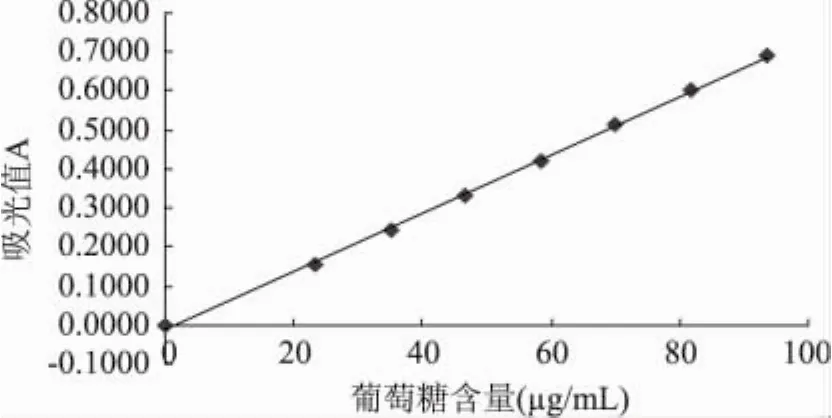
图5 葡萄糖标准曲线
2.2.2 精密度实验 由表1精密度实验结果可知,标准偏差为0.0056,RSD值为1.27%,表明蒽酮-硫酸法测定枸杞多糖精密度良好。
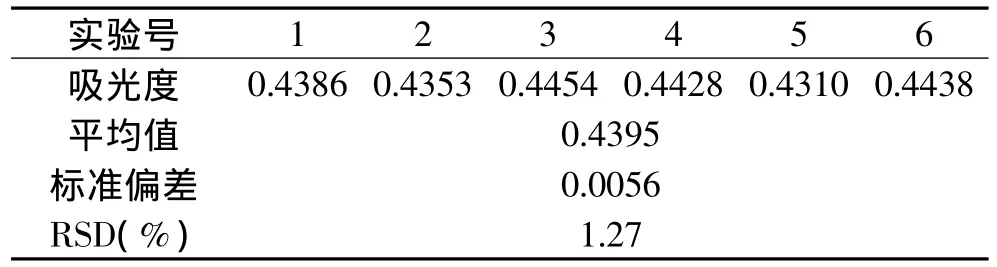
表1 精密度实验结果
2.2.3 回收率实验 由表2回收率实验结果可知,平均回收率为99.78%,RSD为2.26%。
2.3 样品测定
精密吸取按上述1.2.1方法提取得出的枸杞多糖样液,按1.2.5方法测定吸光度并计算得到枸杞鲜果多糖含量为1.14%(见表3)。
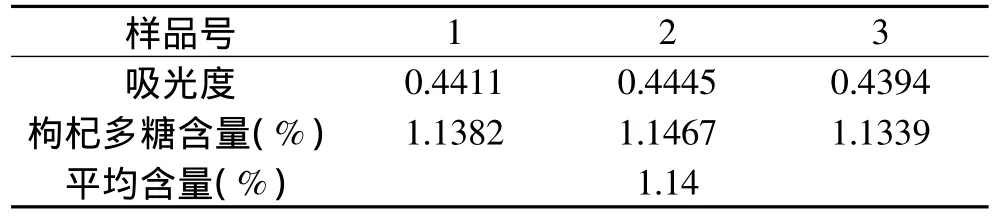
表3 枸杞多糖含量测定结果
3 结论
3.1 采用蒽酮-硫酸法测定枸杞多糖时,于冰水浴中加入2g/L蒽酮-硫酸溶液,样液与蒽酮-硫酸溶液的体积比为1∶2,置沸水浴中加热煮沸5min,冷却后放置8min,于波长625nm范围内测定吸光值,可提高样品中枸杞多糖测定的准确度。
3.2 在最佳操作条件下,利用蒽酮-硫酸法测定枸杞多糖含量的精密度实验RSD值为1.27%;平均回收率为99.78%,RSD为2.26%,测得样品中枸杞多糖含量为1.14%。
3.3 蒽酮-硫酸法测定枸杞多糖稳定、准确、重复性好,是一种快速、简便测定枸杞多糖的方法。
[1]张惠玲.枸杞的功效和综合利用[M].宁夏:宁夏人民出版社,2007:3.
[2]郑国琦,胡正海.宁夏枸杞的生物学和化学成分的研究进展[J].中草药,2008,39(5):796.
[3]李红英,彭励,王林.不同产地枸杞子中微量元素和黄酮含量的比较[J].微量元素与健康研究,2007,24(5):14-16.
[4]于宏.枸杞子的化学成分与生物活性[J].国外医药·植物药分册,2007,22(2):51-54.
[5]张云霞,王萍,刘敦华.枸杞活性成分的研究进展[J].农业科学研究,2008,29(2):79-83.
[6]李艳,孙萍,鲁建疆,等.疆黑枸杞多糖的提取及含量测定[J].数理医药学杂志,2001,14(2):164-165.
[7]朱彩平,张声华.枸杞子水提物中多糖含量的测定[J].食品与发酵工业,2005,31(2):111-113.
[8]易剑平,毕雅静,宋秀荣,等.蒽酮-硫酸法测定枸杞多糖质量分数的研究[J].北京工业大学学报,2005,31(6): 641-646.
[9]黄伟坤.食品检验与分析[M].北京:中国轻工业出版社,1989:32-34.
[10]袁振林.枸杞多糖的提取及含量和分子量分布的测定[J].广东化工,2003(3):43-45.
[11]高春燕.枸杞多糖的提取分离技术及其特性研究[D].陕西师范大学,2006.
[12]阿依姑丽·艾合麦提,王颖,杨晓君.枸杞多糖提取方法及两种不同产地枸杞中多糖含量的比较研究[J].新疆农业科学,2007,44(5):724-728.
[13]熊俐,黄治国,罗惠波,等.枸杞多糖提取工艺优化研究[J].四川食品与发酵,2008,44(1):58-60.
[14]王战勇,闫松,商丽颖,等.枸杞多糖的提取纯化及组成分析[J].氨基酸和生物资源,2008,30(1):22-24.
[15]宁夏农林科学院农副产品贮藏加工研究所,等.GB/T 18672-2002枸杞(枸杞子)[S].北京:中国标准出版社,2002.
Determination of content of Lycium barbarum polysaccharide by anthrone-sulfuric acid method
WEI Yuan,ZHANG Sheng-gui*
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
Anthrone-sulfuric acid method was used to determine the content of Lycium barbarum polysaccharide and determination conditions were studied.The results showed that when Lycium barbarum polysaccharide sample solution was added with anthrone-sulfuric acid reagent at half of its volume,heated at 100℃ for 5min and the absorbance was measured at 625nm after cooling for 8min.The RSD in precision experiments was 1.27%,and the average recovery rate was 99.78%with RSD=2.26%,the content of Lycium barbarum was 1.14%.
Lycium barbarum polysaccharide;anthrone-sulfuric acid method;determination
TS207.3
A
1002-0306(2011)03-0399-03
枸杞系茄科(Solanaceae),枸杞属(Lycium L),多年生落叶灌木,约有80种。我国有7个品种和3个变种,多数分布在西北和华北[1]。现代医学研究证实,枸杞具有补肾养肝、润肺明目、增强免疫力、防衰老、抗肿瘤、抗氧化、抗疲劳及协同防癌等多方面的药理作用[2]。在枸杞的化学成分中,有药理作用的主要有枸杞多糖、维生素、氨基酸、黄酮及环肽类等有机成分,还有人体必需的微量元素锰、锌、铁和硒等,它们含量的高低是评价枸杞质量优劣的重要方面[3]。枸杞多糖属于糖缀合物,为多聚糖与多肽或蛋白质形成的聚合物,是枸杞子中的主要活性组分[4]。临床医学研究表明,枸杞多糖不仅能增强人体的免疫能力,调节人体的免疫功能,还具有降血糖、降血脂、保护肝脏、抗衰老和抗肿瘤等作用[5]。目前测定枸杞多糖含量主要是采用苯酚-硫酸法和蒽酮-硫酸法。近年李艳[6]、朱彩平[7]等运用了苯酚-硫酸法对枸杞及其水提物中枸杞多糖含量进行了测定,而易剑平[8]等运用了蒽酮-硫酸法对枸杞多糖进行测定及对其质量分数进行研究。蒽酮-硫酸法具有快速方便,价格便宜,且不需要特殊的仪器等优点,其原理是糖与硫酸起反应,脱水生成羧甲基呋喃甲醛(羧甲基糠醛)再与蒽酮缩合成蓝色化合物,其呈色强度与溶液中糖的浓度成正比,在一定波长下测定糖含量[9]。测定枸杞干果多糖的研究较多[10-14],而对鲜果多糖测定方法的报道较少,本文以枸杞鲜果为原料,探讨了其多糖的测定方法。
2010-01-11 *通讯联系人
魏苑(1983-),女,硕士研究生,主要从事农产品加工与贮藏研究。
国家科技部支撑计划项目(2007BAD52B07)。
