酵母菌和乳酸菌发酵老面团过程中对可溶性糖的代谢
2011-11-06苏东海胡丽花苏东民辛秀兰
苏东海,胡丽花,苏东民,*,辛秀兰
(1.北京电子科技职业学院生物技术系,北京100029;2.河南工业大学粮油食品学院,河南郑州450052)
酵母菌和乳酸菌发酵老面团过程中对可溶性糖的代谢
苏东海1,胡丽花2,苏东民2,*,辛秀兰1
(1.北京电子科技职业学院生物技术系,北京100029;2.河南工业大学粮油食品学院,河南郑州450052)
采用Saccharomyces cerevisiae CGMCC 2.0562和/或Lactobacillus brevis CGMCC 1.0579纯菌接种发酵老面团,研究老面团发酵过程中微生物对可溶性糖的代谢作用。本实验确定了高效液相色谱(HPLC)-蒸发光散射检测器(ELSD)检测老面团中可溶性糖(麦芽糖、蔗糖、葡萄糖和果糖)的方法为流动相乙腈/水(70∶30,V/V),流速1.0mL/min,柱温25℃;ELSD漂移管温度83.5℃,载气空气流速2.2L/min。结果显示,S.cerevisiae 2.0562能快速消耗麦芽糖、蔗糖和葡萄糖,对果糖的消耗较慢;接种单一L.brevis 1.0579时,麦芽糖、葡萄糖的浓度增大,总体而言蔗糖浓度呈下降趋势,果糖呈上升趋势;接种S.cerevisiae 2.0562和L.brevis 1.0579时,麦芽糖、葡萄糖和果糖的浓度前几个小时降低,随后开始增加,而乳酸菌的存在减慢了酵母菌对蔗糖的消耗。由此看出接种不同菌种对可溶性糖的消耗不同,所以对老面团特性及代谢物的产生会有不同的影响,最终将影响馒头的品质。
老面团,酵母菌,乳酸菌,高效液相色谱-蒸发光散射检测器,可溶性糖
我国主食馒头传统制作方法是采用老面或酵子等自然发酵剂发酵,发挥了多菌种混合发酵的优势,蒸制的馒头风味独特,香甜可口[1]。目前,国外对传统面包发酵剂进行了多年研究,包括微生物尤其是乳酸菌的筛选和鉴定,微生物代谢(碳水化合物、蛋白质及脂代谢)[2-3]及酸面包风味挥发性物质的产生[4-5]等。还研究添加接种纯菌发酵的酸面团对面包品质的影响,发现添加酸面团能够改善面包质构和风味,延迟老化,从而增长面包货架期等[5-6]。众所周知,微生物利用面粉中的营养成分生长、繁殖,同时进行代谢作用,代谢作用表现为可溶性糖的消耗和代谢物质的产生。酵母菌的代谢产物除CO2外主要为醇类等,乳酸菌和非乳酸菌等细菌的代谢产物为酸类,它们的代谢产物及相互作用形成的新物质是构成风味的重要成分,会直接影响终产品的风味。通过pH和TTA值反映细菌的产酸情况,酸化作用可能会影响面团的结构,酵母菌和腐败菌如霉菌等的生长,最终会影响馒头的质构、老化特性及货架期等。但老面团发酵过程中不同菌种对可溶性糖的利用情况如何,还未见相关方面的报道。所以本文采用酵母菌和/或乳酸菌接种老面团,研究发酵过程中微生物生长对可溶性糖的代谢作用,将为馒头传统发酵方法的现代化提供基础资料。
1 材料与方法
1.1 材料与仪器
小麦粉 北京大磨坊面粉有限公司;乙腈 色谱级;水 去离子水;三氯乙酸 分析纯;蔗糖标准品 北京化工厂;葡萄糖 北京益利精细化学品有限公司;D(-)果糖 北京欣经科生物技术有限公司;D(+)麦芽糖 Sigma;Saccharomyces cerevisiae (CGMCC 2.0562),Lactobacillusbrevis(CGMCC 1.0579)。
Agilent-1100高效液相色谱仪 美国安捷伦公司;蒸发光散射检测器(ELSD)2000 美国奥泰科技(中国)有限公司;LDZX-40BI型立式自动电热压力蒸汽灭菌锅 上海申安医疗器械厂;超净工作台北京昌平长城空气净化工程公司;3K15高速离心机Sigma;HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;醒发箱 珠海三麦机械有限公司;电子分析天平 奥豪斯国际贸易(上海)有限公司;超声波清洗器(KQ2100DE型、40kHz) 昆山市超声仪器有限公司;0.22μm微孔滤膜。
1.2 实验方法
1.2.1 菌悬液的制备 取新鲜培养酵母菌和乳酸菌的斜面菌种一环,分别接种到装有20mL无菌麦芽汁和MRS液体培养基,28、30℃培养24h。然后接种到装有100mL上述培养基的三角瓶,同上培养24h,5000×g,20min,4℃,除去上清液,用无菌水同以上条件清洗2次,获得微生物的细胞溶于无菌水的菌悬液,酵母菌和乳酸菌的活菌数分别为106~107cfu/mL。
1.2.2 酸面团的制备 200g面粉,300mL水其中包括酵母菌和/或乳酸菌菌悬液50mL,老面团分别接种单一酵母菌 S.cerevisiae 2.0562和乳酸菌 L.brevis 1.0579;接种二者混合菌种;对照未接任何菌种。混合均匀后于24℃发酵24h[6],分别于发酵的0、4、8、12、16、20、24h取样测定。
1.2.3 微生物计数及理化特性测定
1.2.3.1 微生物计数 菌悬液用无菌移液管准确吸取1mL,加无菌水9mL进行稀释。10g酸面团与90mL无菌水用超声波振荡仪混合2min,进行10倍等梯度系列稀释。取适当浓度梯度稀释液各0.1mL,分别接种到MRS(0.1g/L放线菌酮)[3-4,7]和麦芽汁琼脂培养基平板上,每个梯度做2个平行,于温度30℃和28℃倒置培养3d进行微生物计数[8]。
1.2.3.2 pH和滴定酸(TTA)的测定 10g样品与90mL无菌水用超声波振荡仪混匀,用pH计测定[4]。用0.1mol/L NaOH滴定至 pH8.5,记录所消耗的0.1mol/L NaOH的体积即为TTA值[3]。
1.2.4 可溶性糖的测定
1.2.4.1 色谱条件 色谱柱:Prevail Carbohydrate ES Columns(250mm×4.6mm,5μm);流动相:乙腈/水(70∶30,V/V,使用前经0.45μm滤膜过滤),流速: 1.0mL/min,柱温:25℃;ELSD参数:漂移管温度83.5℃,空气流速为2.2L/min;进样量:10μL。
1.2.4.2 标准曲线的制作 准确称取(精确至0.0001g)干燥至恒重的麦芽糖 0.2g(浓度约为4mg/mL),果糖、葡萄糖、蔗糖各0.05g(浓度约为1mg/mL),分别用纯净水定容于50mL容量瓶中。用自动进样器分别注入1、3、5、7、10μL各糖的标准溶液,以样品含量为X轴,峰面积为Y轴,分别绘制标准溶液曲线,计算线性回归方程。同时配制四种糖的混标溶液,使各糖的浓度均约为1mg/mL,进样量10μL,作标准品色谱图[9]。
1.2.4.3 样品测定 准确称取样品25g(精确至0.0001g),置于100mL容量瓶中,加水约50mL,超声提取20min,慢慢加入50%(质量浓度)三氯乙酸溶液5mL,用蒸馏水定容至刻度,混匀,静置30min,用干燥滤纸过滤,弃去初滤液数毫升,滤液离心(8000×g,20min,4℃),经0.22μm微孔滤膜过滤,待上机[9]。
制备好的样液10μL注入高效液相色谱,在前述测定条件下记录果糖、葡萄糖、蔗糖、麦芽糖的峰面积,依保留时间分别用外标法计算样品中的各组分含量,再计算各组分的浓度。
2 结果与讨论
2.1 微生物的生长
老面团发酵过程中酵母菌数量的变化如图1(a)所示,接种酵母菌和乳酸菌的样品中酵母菌的接种量高于接种单一酵母菌的,随着发酵时间的增长菌种数量增加,10多个小时后酵母菌的数量基本相等且达到稳定,可能是受原料中菌株生长及繁殖所需营养成分的限制。而对照中,酵母菌的数量逐渐增加,到后期趋势线渐趋平缓。
细菌数量的变化如图1(b),接种单一乳酸菌的样品中细菌接种量高于接种酵母菌和乳酸菌的样品,但约12h时接种混合菌种的样品中细菌数量超过接种单一菌种的样品,其后二者都基本保持稳定。很可能是接种混合菌种的样品中,酵母菌发酵过程中产生了一些可供乳酸菌生长繁殖利用的成分而促进了乳酸菌的繁殖。目前原理不明,但可以推断酵母菌和乳酸菌之间可能会相互影响。对照中主要是非乳酸菌细菌,其主要是面粉中原有或外界带入的,面粉原料中原有的养分及淀粉酶对破损淀粉作用产生的营养成分供细菌生长、繁殖,所以数量快速增加。

图1 S.cerevisiae(CGMCC 2.0562)和/或L.brevis(CGMCC 1.0579)发酵老面团过程中微生物数量的变化
2.2 pH和可滴定酸(TTA)值的变化
如图2(a)所示,接种有乳酸菌的样品pH较低且下降较快,尤其是接种单一乳酸菌的样品pH最低。接种单一酵母菌的样品混合后的前几个小时内pH下降相对较快,然后平缓下降,可能是由于刚形成老面团时面粉中酶及酵母菌的作用所致。对照的pH较高,前20h无明显变化但最后pH下降较快,这可能是由于细菌作用,由图1(b)可以看到,随着发酵时间的增长对照中细菌大量繁殖,也可能是由于长时间水解作用或原料中的成分变质,使得最后pH迅速下降。
如图2(b)可知,只接种乳酸菌的样品滴定酸值在前5h迅速增加,其后缓慢增加,第18h滴定酸值最高。前8h接种单一酵母菌和混合菌种的样品滴定酸值基本相等且都逐渐增加,但8h后接种混合菌种的样品TTA值快速增加,逐渐高于接种单一酵母菌的样品,约18h超过接种单一乳酸菌的样品。对照的TTA值最低,同样20h后迅速升高,与pH的变化相一致。
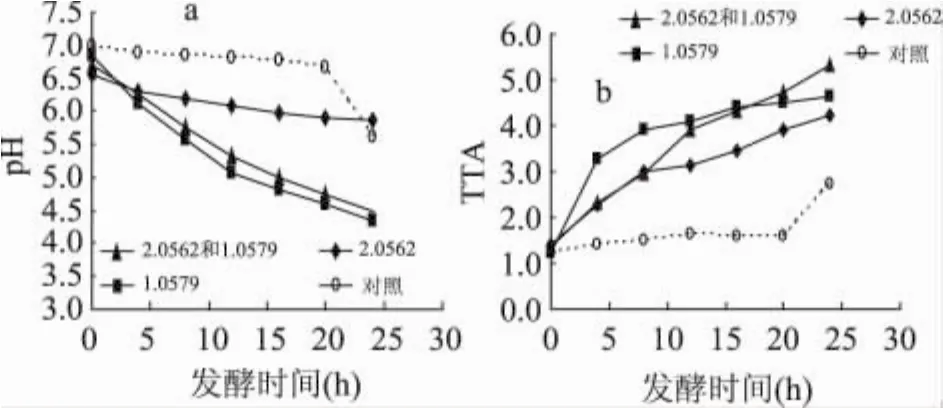
图2 酸面团发酵过程中pH和TTA变化
2.3 可溶性糖浓度的变化
2.3.1 实验条件的确定 根据糖分子都含有极性基团的特点,采用乙睛和水的混合溶剂作流动相,乙腈含量的多少直接影响分离效果。比较了乙腈/水分别为65∶35、70∶30、75∶25、80∶20(V/V),不同流速及柱温条件下的实验结果,综合考虑分离效果、峰信号的强弱、分析时间等因素,最终确定色谱条件为:流动相乙腈/水70∶30(V/V),流速1.0mL/min,柱温25℃。
蒸发光散射检测器(ELSD)在测量半挥发或不挥发样品的光散射之前把流动相蒸发掉,所以检测器的响应不受溶剂和样品特殊性质的影响,因此对糖类的灵敏度大大高于常用的示差折光检测器(RID),所以采用ELSD检测信号[9],根据乙腈与水的比例,ELSD自动设定参数为:漂移管温度83.5℃,空气流速为2.2mL/min。
2.3.2 标准回归方程 见表1。
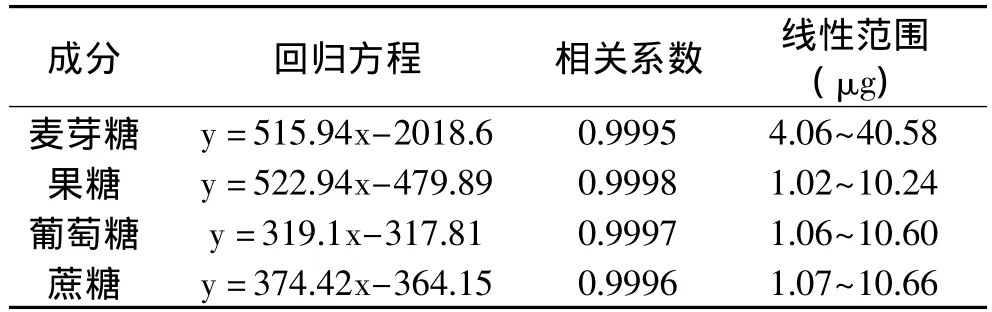
表1 回归方程、相关系数和线性范围
2.3.3 样品分析 发酵过程中各糖浓度变化见图3。24h样品的色谱图见图4。如图3(a)所示,前4h主要由于淀粉酶活性即作用于面粉中破损淀粉,四个样品中麦芽糖浓度都增加,随后各样品中麦芽糖的变化趋势不同。对照样品,麦芽糖浓度平缓增加,16h后麦芽糖含量基本稳定,可能由于微生物消耗和面粉中酶的淀粉水解之间达到平衡[10];对接种酵母菌的样品,由于酵母菌对麦芽糖的快速消耗,十几小时后浓度即降为零;对接种乳酸菌的样品,麦芽糖的浓度逐渐增加且最高,可能乳酸菌的酸化作用影响原料成分变化和酶的活性;对接种混合菌种的样品,4~8h麦芽糖浓度有所降低,然后麦芽糖的浓度开始逐渐上升,可能前期酵母菌为主导菌,由于细菌繁殖比较快后期乳酸菌则成为主导菌,因为由接种单一菌种的样品可知酵母菌使麦芽糖浓度降低,乳酸菌使其浓度上升。
如图3(b)所示,接种单一酵母菌的样品,蔗糖的浓度4h时即降为零;接种酵母菌和乳酸菌的样品蔗糖的浓度降低也较快约9h被消耗殆尽,但慢于接种单一酵母菌的样品,由此看出,乳酸菌影响酵母菌对蔗糖的代谢。接种单一乳酸菌的样品蔗糖的浓度最高,虽然某些时间段略有上升,但总体来看呈下降趋势,可能由于多种原因所致。对照中,前4h内蔗糖的浓度上升,随后缓慢下降。酵母转化酶能把蔗糖水解为葡萄糖和果糖,从而增加乳酸菌的代谢作用[4],可以通过这种快速的蔗糖水解作用解释老面团混合后碳水化合物初始量的显著不同[10]。

图3 老面团发酵过程中可溶性糖浓度的变化
由图3(c)可知,刚形成老面团时葡萄糖的浓度很低,甚至对照和接种混合菌种的样品中未检测到葡萄糖,这可能与面粉原料中糖分布的不均匀及样品处理过程中菌种或酶的作用相关。接种单一酵母菌的样品葡萄糖的浓度约8h降为零;接种单一乳酸菌的样品,葡萄糖浓度增加最快,20h前已高于其他样品;接种混合菌种的样品,葡萄糖浓度8h后快速增加,约20h已高于对照。由此看出,酵母菌快速消耗葡萄糖,而乳酸菌的作用使葡萄糖浓度增加,二者混合时前期葡萄糖浓度有所降低,随后逐渐增加,与麦芽糖的变化趋势基本相同。由于面粉中淀粉酶对破损淀粉的作用,对照中葡萄糖浓度逐渐增加,但20h后开始下降,可能是长时间发酵由于杂菌生长及繁殖导致对糖的消耗。接种不同菌种发酵老面团过程中,葡萄糖浓度变化不同,这与菌种的代谢密切相关[10]。
果糖以果葡聚糖形式存在面粉中,在所有谷物中的含量约为1%~4%,能够水解果聚糖β-果糖苷连接键的酵母酶(转化酶和菊糖酶)受pH影响,在老面团中活性可能被增强。如图3(d)所示,对照中果糖的浓度逐渐增大;接种单一酵母菌的样品,前几个小时果糖的浓度有所增加,但随后浓度缓慢降低,约8h已低于其他样品;接种单一乳酸菌的样品,果糖浓度的变化波动较大,前4h增加随后的4h内降低,然后快速增加但12h后又有一次迅速下降最后开始增加;接种混合菌种的样品,前4h内果糖浓度有所增加,随后浓度开始下降,但从约8h浓度开始上升。
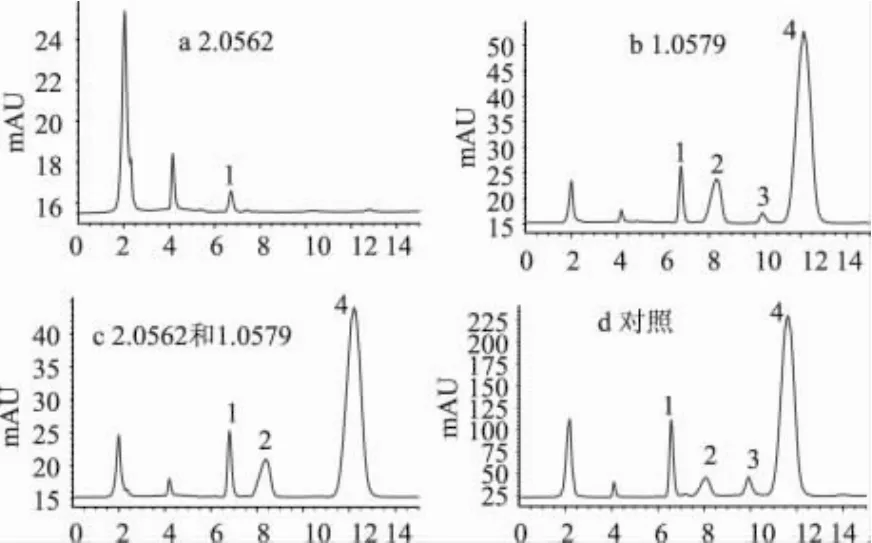
图4 24h样品高效液相色谱图
3 结论
综上所述,不同菌种的代谢方式存在差异,接种不同菌种发酵老面团时,各菌种对可溶性糖的消耗不同,所以其生长状况及代谢产酸存在差异。微生物的代谢作用不仅影响面团结构及特性,还会产生一些代谢产物,由此推断接种不同菌种发酵势必会对成品馒头的品质包括质构、风味、老化特性及货架期产生不同的影响。接种单一乳酸菌的样品中细菌接种量高于接种酵母菌和乳酸菌样品中的,约12h时后者中细菌数量超过前者。发酵过程中样品的酸度为接种单一乳酸菌>接种混合菌种>接种单一酵母菌>对照。高效液相色谱-蒸发光散射检测器法可溶性糖的方法为Agilent-1100高效液相色谱仪,Prevail Carbohydrate ES Columns(250mm×4.6mm, 5μm);流动相:乙腈/水70∶30(V/V),流速: 1.0mL/min,柱温 25℃;ELSD参数:漂移管温度83.5℃,空气流速为 2.2mL/min。S.cerevisiae 2.0562能快速消耗麦芽糖、蔗糖和葡萄糖,对果糖的消耗较慢;接种单一L.brevis 1.0579时,麦芽糖、葡萄糖的浓度增加,总体而言蔗糖浓度呈下降趋势,果糖呈上升趋势,虽然二者浓度变化波动较大;接种S.cerevisiae 2.0562和L.brevis 1.0579时,麦芽糖、葡萄糖和果糖的浓度前几个小时降低,随后开始增加,乳酸菌的存在减慢了酵母菌对蔗糖的消耗。
若酵母菌和乳酸菌之间存在明确的共生关系,就能够增加微生物改善终产品功能和感官特性的潜能。从以上分析来看,本实验采用的酵母菌为消耗麦芽糖菌种,而麦芽糖消极型酵母能够水解面粉中的果聚糖,提供内源果糖供乳酸菌代谢,所以麦芽糖消极型酵母的筛选是以后研究老面团微生物之间关联性的基础。
[1]杨敬雨,刘长虹.中国传统酵子的工业化[J].食品研究与开发,2007,28(2):164-166.
[2] Aldo Corsetti,Luca Settanni.Lactobacilli in sourdough fermentation[J].Food Research International,2007(40): 539-558.
[3]Spiros Paramithiotis,Spiros Gioulatos,Effie Tsakalidou,et al. Interactions between Saccharomyces cerevisiae and lactic acid bacteria in sourdough[J].Process Biochemistry,2006,41: 2429-2433.
[4]Salimur Rehman,Alistair Paterson,John R Piggott.Flavour in sourdough breads:a review[J].Trends in Food Science&Technology,2006(17):557-566.
[5]S Plessas,A Bekatorou,J Gallanagh,et al.Evolution of aroma volatiles during storage of sourdough breads made by mixed cultures of Kluyveromyces marxianus and Lactobacillus delbrueckii ssp.Bulgaricus or Lactobacillus helveticus[J].Food Chemistry,2008,107:883-889.
[6]K Katina,R L Heinio,K Autio,et al.Optimization of sourdough process for improved sensory profile and texture of wheat bread[J].LWT,2006,39:1189-1202.
[7]Hulya Gul,Sami Qzcelik,Osman Saodic,et al.Sourdough bread production with lactobacilli and S.cerevisiae isolated from sourdoughs[J].Process Biochemistry,2005(40):691-697.
[8]苏东海.馒头酵母的分离与筛选[J].农产品加工,2008 (7):82-84.
[9]刘玉峰,李黎,李东,等.高效液相色谱法测定食品中的单糖、双糖[J].食品科学,2007,28(3):293-296.
[10]Herve Robert,Valerie Gabriel,Dominique Lefebvre,et al. Study of the behaviour of Lactobacillus plantarum and Leuconostoc starters during a complete wheat sourdough breadmaking process[J].LWT,2006(39):256-265.
Metabolism of soluble sugars in old dough fermented by yeast and lactic acid bacteria
SU Dong-hai1,HU Li-hua2,SU Dong-min2,*,XIN Xiu-lan1
(1.Department of Beiology,Beijing Vocational College of Electronic Science,Bijing 100029,China; 2.College of Grain and Food,Henan University of Technology,Zhengzhou 450052,China)
The old dough were prepared using Saccharomyces cerevisiae(CGMCC 2.0562)and/or Lactobacillus brevis(CGMCC 1.0579).The microbial metabolism of soluble sugars was studied during old dough fermentation. The method for detecting soluble sugars,which include maltose,sucrose,glucose,and fructose,was established by high efficiency liquid chromatography-evaporative light scattering.The chromatographic condition:mobile phase was acetonitrile/water which was 70∶30(v/v),flow rate was 1.0mL/min,column temperature was 25℃.ELSD condition:The temperature of drift tube was 83.5℃,flow rate of carrier gas was 2.2L/min.The results showed that maltose,sucrose and glucose were fast consumed by S.cerevisiae 2.0562,but the consumption of fructose was slower;when old dough fermented by single L.brevis 1.0579,the concentration of maltose,glucose and fructose increase,in general the concentration of sucrose decreased;when old dough fermented by S.cerevisiae 2.0562 and L.brevis 1.0579,the concentration of maltose,glucose and fructose decreased in the initial hours,then increased,however the consumption of sucrose by yeast was slower with existence of L.brevis 1.0579.Thus the consumption of soluble sugars was different when old dough were inoculated by different strains,so they would have different affection on the characteristic of old dough and production of metabolites.This will finally affect the quality of steamed bread.
old dough;yeast;lactic acid bacteria;high efficiency liquid chromatography-evaporative light scattering;the soluble sugars
TS213.2
A
1002-0306(2011)03-0211-04
2010-01-08 *通讯联系人
苏东海(1965-),男,博士,教授,研究方向:生物技术在农产品加工中的应用。
北京市属高等学校人才强教深化计划资助项目(PHR201107151);北京市自然科学基金资助项目(5093026);河南省重点科技攻关项目(0523011000)。
