不同产地大枣中多糖的含量测定△
2011-11-06刘晓芳刘养清韩雪焦建华陈元元
刘晓芳,刘养清,韩雪,焦建华,陈元元
(山西中医学院,山西 太原 030024)
质量
不同产地大枣中多糖的含量测定
△
刘晓芳,刘养清*,韩雪,焦建华,陈元元
(山西中医学院,山西 太原 030024)
目的:建立大枣中多糖的提取和含量测定方法。方法:采用苯酚-硫酸显色-分光光度法测定不同产地大枣中多糖的含量,对不同的提取方法和影响显色反应的主要因素进行了考察。结果:测定了不同产地大枣中多糖的含量,其差异很大。结论:该方法测定多糖含量具有操作简单、精密度高、准确可靠、重复性好的优点,可用于大枣的质量控制。
大枣;多糖;分光光度法;苯酚-硫酸显色法;质量控制
大枣为鼠李科植物枣ZizyphusjujubaMill.的干燥成熟果实[1],具有补中益气,养血安神的功能[1]。大枣营养丰富,既可食用又可入药,富含糖类、粗纤维、维生素、氨基酸、矿物质等多种营养成分[2-3]。研究表明,大枣多糖是大枣中具有重要生物功能的有效成分,营养保健价值很高[4-6]。建立大枣中多糖含量的测定方法,不仅可作为评价指标的参考,还能更好地进行质量控制。作者通过大量实验确定了大枣中多糖的提取方法,并采用苯酚-硫酸显色法[7]测定了不同产地大枣中多糖的含量。
1 仪器与试药
1.1 仪器
VIS-723G型可见光分光光度计;HC-2518型离心机;KQ5200V型超声波清洗器。
1.2 试药
葡萄糖对照品[8],105℃干燥恒重,其他试剂均为分析纯。乙醇溶液(80%):20 mL蒸馏水中加入无水乙醇80 mL,混匀。氢氧化钠溶液(100 g·L-1):称取100 g氢氧化钠,加蒸馏水溶解并稀释至1 L,加入固体无水硫酸钠至饱和,备用。铜储备液:取0.3 g硫酸铜 (含5个结晶水),3 g柠檬酸钠,加水溶解并稀释至100 mL,混匀。铜试剂溶液:精密吸取铜储备液50 mL,精密加入蒸馏水50 mL,混匀后加入固体无水硫酸钠12.5 g并使其溶解,临用时新配。洗涤剂:移取蒸馏水50 mL,加入10 mL氢氧化钠溶液,混匀。硫酸溶液(10%):取100 mL浓硫酸加入到800 mL蒸馏水中,混匀,冷却后稀释至1 L。苯酚溶液(50 g·L-1):取苯酚100 g,蒸馏,收集180~182℃馏分。称取精制苯酚5.0 g,加水溶解并稀释至100 mL,混匀,溶液置冰箱中可保存1个月。
大枣样品共收集了8种,分别为忻州大枣、吕梁玉喜大枣、吕梁滩枣、吕梁临县大枣、吕梁小枣、柳林大枣、保德贡枣、永和大枣。
2 方法与结果
2.1 标准溶液的配制
2.1.1 标准溶液的配制 葡萄糖标准储备溶液:精密称取无水葡萄糖对照品0.500 4 g,加水溶解,并定容至50 mL,混匀,置冰箱中保存。此溶液每1 mL含10.0 mg葡萄糖。
葡萄糖标准使用液:吸取葡萄糖标准储备液1.00 mL,置于100 mL容量瓶中,加蒸馏水至刻度,混匀,置冰箱中保存。此溶液每1 mL含葡萄糖0.1 mg。
2.1.2 加热时间的确定 精密移取5份配制好的葡萄糖标准使用液0.6mL和5份蒸馏水1.4 mL,分别混合,各加入配好的苯酚溶液1 mL,混匀,再各加浓硫酸10 mL,摇匀后静置5 min,然后置沸水中分别加热2,5,8,10,15 min,取出后放置10 min,根据扫描的吸收曲线,选择在490 nm测定吸光度,分别为0.197,0.305,0.213,0.247,0.196,结果表明当加热5 min时吸光度最大,故确定加热时间为5 min。
2.1.3 浓硫酸用量的确定 精密移取3份配制好的葡萄糖标准使用液0.6 mL和3份蒸馏水1.4mL,分别混合,各加入配好的苯酚溶液1 mL,混匀,分别加浓硫酸5,8,10 mL,摇匀后静置5 min,然后置沸水浴中加热5 min,取出后放置10 min,根据扫描的吸收曲线,选择在490 nm测定吸光度,分别为0.309,0.387,0.306,结果表明当加入浓硫酸8 mL时吸光度值最大,故确定浓硫酸用量为8 mL。
2.1.4 最大吸收波长的确定 精密吸取配制好的葡萄糖标准使用液0.6 mL和蒸馏水1.4 mL,混合,加入配好的苯酚溶液1 mL,混匀,精密加入浓硫酸8 mL,充分混匀后静置5 min,然后置沸水中加热5 min,取出后放置10 min,用分光光度计在400~650 nm波长处以试剂空白溶液为参比,1 cm玻璃比色皿测定吸光度值。根据扫描的光吸收曲线显示其最大吸收波长为488.5 nm。
2.2 样品溶液的制备
2.2.1 样品的提取 称取大枣样品1.5 g,加溶剂(蒸馏水)10 mL,微波加热50 s,过滤后将样品提取液定容至10 mL,供沉淀粗多糖。
2.2.2 沉淀粗多糖 精密吸取样品提取液1.5 mL,置于50 mL离心管中,加入无水乙醇6 mL,混匀后,以3 000 r·min-1离心5 min,弃去上清液。残渣用80%乙醇溶液数毫升洗涤,离心后弃上清液,反复3~4次操作,残渣用蒸馏水溶解并定容至5.0 mL,混匀后,供沉淀葡萄糖。
2.2.3 沉淀葡聚糖 精密吸取上述溶液2 mL置于20 mL离心管中,加入100 g·L-1氢氧化钠 2.0 mL,铜试剂溶液2.0mL,沸水浴中煮沸2min,冷却后以3 000 r·min-1离心5 min,弃去上清液。残渣用洗涤液数毫升洗涤,离心后弃去上清液,反复3次操作后,残渣用10%硫酸溶液2.0 mL溶解并转移至25 mL容量瓶中,加蒸馏水稀释至刻度,混匀。此溶液为样品测定液。
2.3 方法学考察
2.3.1 葡萄糖标准曲线的绘制 精密吸取葡萄糖标准使 用 液:0,0.10,0.20,0.40,0.60,0.80,1.00,1.20 mL(相当于葡萄糖 0,0.010,0.020,0.040,0.060,0.080,0.100,0.120 mg)分别置于25 mL比色管中,准确补蒸馏水至2.0 mL,加入50 g·L-1苯酚溶液1.0 mL,混匀后,小心加入浓硫酸8 mL,混匀后,置沸水浴中煮沸5 min,放置10 min后用分光光度计在488.5 nm波长处,以试剂空白为参比,1 cm比色皿测定吸光度值。以葡萄糖浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。其回归方程为Y=5.143 4X-0.001 5,r=0.999 2,葡萄糖在0.010~0.120 mg线性关系良好。
2.3.2 重复性试验 按2.2项下方法,制备6份吕梁小枣的样品溶液,测定吸光度,计算RSD=2.62%。结果表明测定方法的重复性良好。
2.3.3 精密度试验 连续5次测定柳林大枣样品的吸光度,计算RSD=0.26%,结果表明方法精密度良好。
2.3.4 稳定性试验 分别在10,20,30,60,90,120 min测定柳林大枣样品的吸光度,计算RSD=0.67%,结果表明供试品溶液在2 h内稳定。
2.3.5 回收率试验 取已知含量的临县大枣约1.5g,精密称定6份,分别加入葡萄糖标准储备液 (10 mg·mL-1)1mL,按2.2项下方法操作,分别测定,计算回收率,结果见表1。
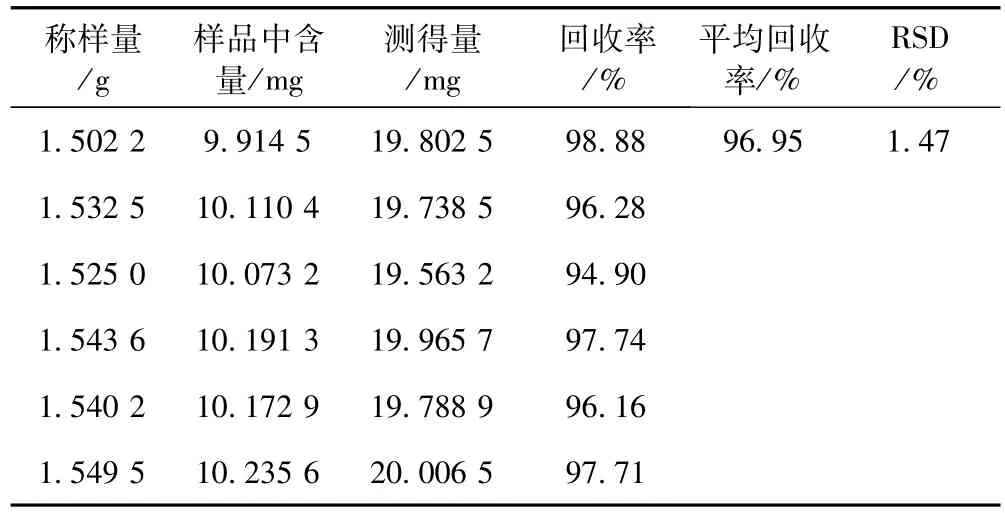
表1 葡萄糖加样回收率试验
2.4 不同产地大枣中多糖的含量测定
精密吸取不同产地大枣样品测定液2.0 mL置于25 mL比色皿中,加入50 g·L-1苯酚溶液 1.0 mL,混匀后,小心加入浓硫酸8 mL混匀,置沸水浴中煮沸5 min,放置10 min后用分光光度计在488.5 nm波长处,以试剂空白为参比,用1 cm比色皿测定吸光度值,从标准曲线上查出对应葡萄糖的浓度,而后计算出多糖含量。多糖含量结果计算公式为:
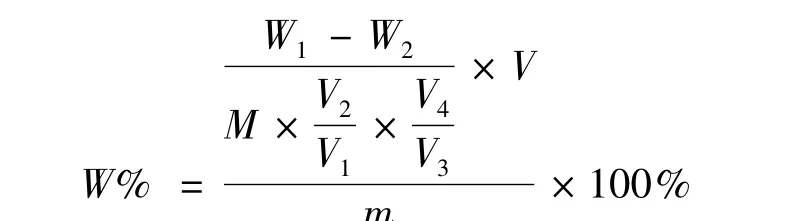
式中:W1—样品测定液中葡聚糖的质量(g)
W2—样品空白液中葡聚糖的质量(g)
V1—粗多糖溶液体积(mL)
V2—沉淀葡聚糖所用粗多糖溶液体积(mL)
V3—样品测定液总体积(mL)
V4—测定用样品测定溶液体积(mL)
V—样品提取液总体积(mL)
M—样品量(mL)
m—样品的质量(g)
不同产地大枣中的多糖含量测定结果见表2。

表2 不同产地大枣中的多糖含量
3 讨论
3.1 样品提取方法的选择
通过实验分别比较了超声提取和微波提取两种方法。超声提取分别考察了超声时间和次数,选择超声10,20,30,40 min,结果超声 20 min时,吸光度最大;分别超声1、2、3次,每次20 min,结果表明超声两次后基本能把多糖提取完全。微波提取考察了提取时间,分别加热 10,20,30,40,50,60 s,结果表明微波加热50 s时吸光度最大。通过超声提取及微波提取多糖的结果比较,样品的提取选择微波加热,加热时间为50 s。
3.2 不同样品多糖含量比较
实验结果显示,忻州大枣的多糖含量最高,为1.37%;吕梁临县大枣的多糖含量最低,为0.66%;表明不同产地的大枣中多糖含量差异较大。
上述实验确定的大枣中多糖的提取方法及苯酚-硫酸法测定大枣中多糖含量的方法操作简单、精密度高、结果准确可靠,可用于大枣中多糖含量的测定和大枣的质量控制。
[1]国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:21-22.
[2]曲泽洲,王永蕙.中国枣树志·枣卷[M].北京:中国林业出版社,1993:113-118.
[3]李进伟,丁霄霖.金丝小枣多糖的提取及脱色研究[J].食品科学,2005,27(4):150-154.
[4]林勤保,高大维.大枣多糖的分离和纯化[J].食品工业科技,1998,(4):20-21.
[5]张庆,林生,林勤保,等.大枣多糖体外抗补体活性促进小鼠脾细胞的增殖作用[J].中药药理与临床,1998,15(5):19.
[6]李雪华,龙盛京.大枣多糖的提取与抗活性氧研究[J].广西科学,2000,7(1):54-56,63.
[7]胡居吾,范青生,肖小年.粗多糖测定方法的研究[J].江西食品工业,2005,(1):16-18.
[8]梁惠花,刘晓河,王志宝,等.雷公藤多糖的提取和含量测定方法研究[J].中国现代应用药学,2004,21(1):8-10.
Determination of Polysaccharide in Ziziphus jujube Mill.from Different Places
LIU Xiao-fang,LIU Yang-qing,HAN Xue,JIAO Jian-hua,CHEN Yuan-yuan
(ShanxiCollegeofTraditionalChineseMedicine,Taiyuan030024,China)
Objective:To establiash the method for the extraction and determination of the content of polysaccharide inZiziphusjujubeMill..Methods:Phenol-sulfueic acid method and spectrophotometry were used to determine the content of polysaccharide inZiziphus jujubeMill..The different extracting methods and the main factors effecing color reaction were investigated.Results:The contentof polysaccharide inZiziphusjujubeMill.from different places was different.Conclusion:Themethod that the content of polysacchride determined was showed advantages of simplicity of operation,system accuracy,high precision and reproducibility and can be used for the quality control ofZiziphus jujubeMill..
ZiziphusjujubeMill.;Polysaccharide;Spectrophotometry;Phenol-sulfuric acidmethod;Quality control
山西省卫生厅科技攻关项目(200652)
*刘养清,教授,Tel:(0351)2272085,E-mail:soh2004@163.com
2011-01-24)
