防凤愈伤组织诱导研究△
2011-11-06毕博杨世海徐大卫刘春博
毕博,杨世海,徐大卫,刘春博
(1.吉林农业大学,吉林 长春 130118;2.吉林农业科技学院,吉林 吉林 132109;3.中国药材公司,北京 100195;4.吉林省经济管理干部学院,吉林 长春 130012)
防凤愈伤组织诱导研究△
毕博1,2,杨世海1*,徐大卫3,刘春博4
(1.吉林农业大学,吉林 长春 130118;2.吉林农业科技学院,吉林 吉林 132109;3.中国药材公司,北京 100195;4.吉林省经济管理干部学院,吉林 长春 130012)
目的:运用现代生物技术探讨防风愈伤组织的培养条件。方法:以防风叶片为外植体,对防风的愈伤组织进行不同浓度生长素和细胞分裂素诱导。结果:在2,4-D 1 mg·L-1诱导形成的愈伤组织长势好于其他不同浓度,具有显著差异。生长素与细胞分裂素配合使用时,愈伤组织的诱导率明显高于单个生长素的处理,生长情况也有差异。结论:诱导防风最佳外源激素的浓度配比2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1。
防风;愈伤组织;诱导;激素
防风Saposhnikovia divaricata(Turcz.)Schischk.为伞形科防风属多年生草本植物,俗称北防风、东防风、关防风、旁风、屏风、反风等[1]。药用部位是收获3年生未开花结实的防风根部,此时的防风根浆充足而丰满,有菊花心,质佳,干燥后入药称“防风”。防风的药用成分主要有挥发油、多糖、有机酸、无机元素、香豆素、色原酮、汉黄芩素、聚乙炔类、腺苷等,具有解热镇痛、抗菌、镇静、抗过敏作用,并具有抗肿瘤免疫促进作用及抗凝血作用[2]。防风药材以采挖野生防风为主,种源多采自野生种子,但防风种子发芽势低。赵敏[3]研究指出,防风种子中存在着活性较高的内源抑制物质,使种子播后出苗缓慢、出苗不齐,往往造成生产田缺苗甚至毁地重种。采用组织培养技术繁育防风时间短、速度快、成本低,对于保存防风的种质资源、合理开发利用中药资源、满足市场对防风的大量需求具有现实意义。
目前关于防风的研究主要在植物资源、化学成分、中药鉴定、药理作用和临床应用等方面[4-5],有关防风体外培养、诱导愈伤组织的研究很少见报道。本试验研究了不同浓度生长素和激素对防风叶片愈伤组织诱导的影响,为防风优良无性系的繁殖奠定理论基础。
1 材料
防风种子于2009年9月采自吉林农业大学药材基地,经吉林农业大学中药材学院杨世海教授鉴定为防风Saposhnikovia divaricata(Turcz.)Schischk.种子。
2 方法
选择健康饱满的防风种子,先在无菌水中浸泡10~12 h后,小心剥去种皮(避免损伤胚),置于超净工作台上,用75%乙醇中浸泡30 s后,倒去乙醇,置于0.1%氯化汞表面消毒10 min(其间要不停摇动),倒去氯化汞,用无菌水冲洗3~5次,接种到MS培养基上,获得无菌苗,待苗长至3~4 cm时备用。
取上述无菌苗,将叶片剪成0.5 cm×0.5 cm的小块,所有培养基中蔗糖的含量均为25 mg·L-1,琼脂的含量为0.7%,pH值为5.8~6.0。培养基在121℃下灭菌20 min,冷却后备用。
培养温度为(25±2)℃,在愈伤组织诱导阶段先采用暗培养,4 d后转入光下培养,以日光灯为光源,连续光照12 h·d-1,光强1 200~1 600 lx。培养过程中对其生长情况进行观察,30 d后统计诱导出愈伤组织数量并计算诱导率,同时记录愈伤组织的质地、颜色及生长情况。
诱导率=(形成愈伤组织的外植体数/接种外植体的块数)×100%
将防风外植体分别接种在含有2,4-D、NAA、6-BA的浓度分别为 0,0.3,0.5,1.0,1.2,1.5 mg·L-1的MS培养基上,进行外源激素对愈伤组织诱导效应的研究。外源激素6-BA 0.5 mg·L-1与NAA、2,4-D配比使用,设8个处理,浓度分别为0.3,0.5,1.0,1.2 mg·L-1。
以上每个处理培养5个培养皿,每个培养皿接种10块外植体,重复3次,待愈伤组织长出后观察生长情况,计算诱导率。
3 结果与分析
利用单独或配比使用2,4-D和6-BA,附加在MS基本培养基上,接种30 d后观察统计,研究不同种类及浓度的激素对防风愈伤组织的诱导情况。
3.1 不同浓度2,4-D对防风愈伤组织诱导和生长的影响
表1反映了不同浓度2,4-D对防风愈伤组织诱导和生长的影响,2,4-D对防风叶片的愈伤组织有较强的诱导作用,在不添加2,4-D的培养基上不能诱导出愈伤组织。愈伤组织的诱导率随2,4-D浓度的增加呈先上升后下降的趋势,以1.0 mg·L-1的诱导率最高,高浓度的2,4-D反而抑制了愈伤组织的诱导;从愈伤组织生长情况来看,在浓度为1.0 mg·L-1时,愈伤组织具有很好的光泽,且生长状况最好,颜色为乳白色。低浓度和高浓度的2,4-D均导致愈伤组织生长变差,当浓度达到1.2 mg·L-1时,大部分呈灰褐色,浓度为1.5 mg·L-1时,抑制了外植体产生愈伤组织,所产生的愈伤组织呈褐色,不能正常生长,可能是因为高浓度的2,4-D会诱导愈伤组织内多酚氧化酶活性升高,从而导致愈伤组织褐化。

表1 不同浓度2,4-D对愈伤组织诱导和生长的影响
3.2 不同浓度NAA对愈伤组织诱导及生长的影响
表2反映了不同浓度NAA对愈伤组织诱导及生长的影响,可以看出NAA对防风愈伤组织的诱导作用也较强。在不添加NAA的培养基上不能诱导出愈伤组织,添加不同浓度的NAA均能诱导出愈伤组织。以0.5 mg·L-1的NAA诱导率最高,愈伤组织生长好,呈乳白色,具光泽,转接后长势好。但当NAA浓度增加为1.0 mg·L-1以上时,愈伤组织生长缓慢。当NAA浓度达到1.5 mg·L-1时,愈伤组织生长状况变差,诱导率也逐渐降低。这是因为低浓度的生长素能促进生长,超过适宜浓度,由于生长素可诱导产生乙烯而干扰内部生理平衡,从而抑制生长[6-7]。
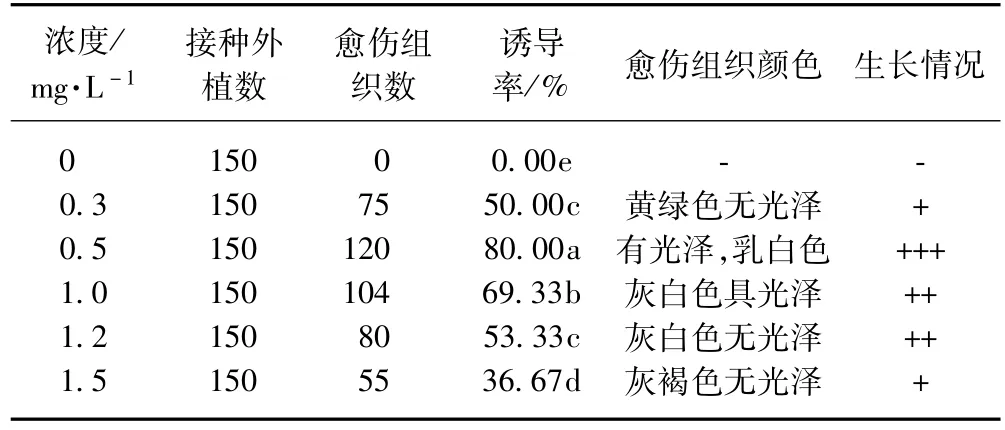
表2 NAA对愈伤组织诱导和生长的影响
3.3 不同浓度6-BA对防风愈伤组织生长的影响
表3反映了不同浓度6-BA对防风愈伤组织生长的影响,可以看出6-BA也是诱导防风叶片产生愈伤组织的关键因素。在不添加6-BA的培养基上不能诱导出愈伤组织,添加不同浓度的6-BA均能诱导出愈伤组织。当6-BA的浓度为0.5 mg·L-1时诱导率高,愈伤组织呈黄绿色,有光泽,生长好,是培养防风产生愈伤组织的适宜浓度。当6-BA的浓度小于0.5 mg·L-1时,诱导率低,诱导出的愈伤组织颜色较暗,生长差;当浓度在1.0 mg·L-1以上时,有少量愈伤组织产生,且生长缓慢。由于6-BA在适宜的浓度具有促进细胞分裂和伸长、促进细胞分化及物质的合成和运输、影响细胞中各种酶的活性等作用[8],如果浓度过低,容易形成多核体阻止细胞分化,加速细胞衰老,逐渐死亡;而高浓度的6-BA使细胞体积因强烈的分裂活动而急剧缩小,已形成的愈伤组织不能正常生长,逐渐变褐[9]。

表3 不同浓度6-BA对愈伤组织诱导和生长的影响
3.4 外源激素组合对防风愈伤组织的影响
表4反映了外源激素组合对防风愈伤组织的影响。从诱导率方面来看,适宜浓度的2,4-D与6-BA组合、NAA与6-BA组合的诱导率均较高。结合生长情况及愈伤组织诱导出后发育情况来看,2.4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1组合不仅生长好,愈伤组织呈浅黄色,具光泽,约20 d后,愈伤组织呈黄绿色,质地较紧密[10]。
比较了不同浓度的2,4-D、NAA、6-BA单独使用及组合使用的植物生长调节物质对防风愈伤组织的诱导效应。单独使用3种植物外源激素在一定浓度范围内均能诱导出愈伤组织;配合使用外源生长素和细胞分裂素能获得诱导率高、生长快、质量好的愈伤组织[11];较佳组合的培养基为 MS+2,4-D 1.0 mg·L-1+6-BA 0.5mg·L-1和 MS+NAA 0.5 mg·L-1+6-BA 0.5 mg·L-1;低浓度的2,4-D对防风愈伤组织的诱导有促进作用,但2,4-D浓度高时对愈伤组织的生长有抑制作用。

表4 外源激素组合对愈伤组织的影响
4 小结与讨论
一般来说,激素及其组合的不同,对愈伤组织的诱导也起着关键作用,其中生长素和细胞分裂素是两类主要的调控培养条件下细胞生长和分化的植物激素。已有研究证实,生长素和细胞分裂素对于细胞生长与分化具有协同作用,它们的量与比值的不同配合对细胞分化起着重要的调节作用[12-13]。在防风愈伤组织诱导过程中,通过调整培养基中2,4-D和NAA的浓度,结果发现,低浓度的激素对防风愈伤组织的诱导有促进作用,但激素浓度过高时对愈伤组织的生长有抑制作用。
比较愈伤组织的诱导率及生长情况发现,2,4-D对愈伤组织的诱导效果好,尤以1 mg·L-1的2,4-D诱导形成的愈伤组织长势好,呈颗粒状,疏松、乳白色,与其他浓度比较具有显著性。实验结果表明,生长素与细胞分裂素配合使用时,愈伤组织的诱导率明显高于单个生长素的处理,生长情况也有差异。诱导防风愈伤组织最佳外源激素的浓度配比为2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1。本研究结果未对防风愈伤组织有效成分进行比较,防风有效成分含量很多,这一方面的深入研究我们正在进行,将为防风的高效快速繁殖开拓新的领域。
[1]陈祥梅,贝丽霞.药用植物防风组织培养关键技术研究[J].中国农学通报,2007,23(5):83-87.
[2]高咏莉.生药防风的化学成分与药理作用研究进展[J].山西医科大学学报,2004,35(2):216-218.
[3]赵敏.防风种子中内源抑制物质活性的研究[J].中草药,2004,35(4):441-444.
[4]马红 .防风近年研究概述[J].中草药,1994,25(8):382-440.
[5]张贵军,张艳波,李影.我国生药防风近10年的研究概况[J].时珍国医国药,1997,8(1):73-75.
[6]张朝红,崔宏安.杜仲愈伤组织诱导的研究[J].西北农林科技大学学报(自然科学版),2003,(5):153-157.
[7]龚慕辛,朱甘培.香薷的本草考证[J].北京中医,1996,12(5):39-41.
[8]彭红云,杨肖娥.香薷植物修复铜污染土壤的研究进展[J].水土保持学报,2005,19(5):197-201.
[9]葛冰,卢向阳,易克,等.石香薷的研究概况[J].中药材,2004,26(4):302-305.
[10]吕金顺,张景琼,郑尚珍,等.香薷属植物药用成分研究进展[J].中国医学生物技术应用,2002,(4):15-19.
[11]郝近大,谢宗万.香薷药用品种的延续与变迁[J].1994,(6):26-29.
[12]Dominov JA,Stenzier L,Lee S,etal.Cytokinins and auxins control the expression of a gene inNicotiana Plubaginifoliacells by feed back regulation[J].The Plant Cell,1992,4:451-461.
[13]Ye ZH,Varner JE.Expression of an auxin and cytokinin-regulated gene in cambial region in Zinnia[J].Proc Natl Acad Sci,1994,91:6539-6565.
Study on Induction of Sapashnikovia divaricata Callus
BIBo1,2,YANG Shi-hai1,XU Da-wei3,LIU Chun-bo4
(1.JinlinAgriculturalUniversity,Changchun130118,China;2.JilinAgriculturalScienceandTechnologyCollege,Jilin132109,China;3.ChinaNationalCorp.ofTraditional&HerbalMedicine,Beijing100195,China;4.JilinProvinceEconomicsandManagementCadresCollege,Changchun130012,China)
Objective:To investigate the culture conditions for callus induction inSaposhnikoviadivaricata.Methods:With the blade ofSaposhnikoviadivaricataas explant,to induce the callus with different concentration of auxin and cytokinin.Results:The callus grew significantly better in conduction with 2,4-D 1 mg·L-1than in other conditions.When auxin andcytokinins were used together,callus induction rate was significantly higher than single auxin.Conclusion:The optimal culture condition for callus induction is 2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1.
Saposhnikoviadivaricata;Callus;Induction;Plant growth regulator
吉林省中医药管理局项目——防风多倍体种质资源创新技术研究
*杨世海,E-mail:jlyangs@163.com
2011-03-29)
