利用RT-PCR对病料中猪繁殖与呼吸综合征病毒的检测
2011-11-05许瑞利梁俊昌朱瑞良
许瑞利 梁俊昌 朱瑞良
利用RT-PCR对病料中猪繁殖与呼吸综合征病毒的检测
许瑞利①②梁俊昌②朱瑞良①
(①山东农业大学动物科技学院 泰安 271018 ②山东省枣庄市市中区畜牧兽医局)
本试验对枣庄市中区6个乡镇及周边地区的54个不同规模猪场及散户所采集的172份临床疑似“猪高热病”样品进行了检测,结果发现,枣庄地区检出高致病性PRRSV阳性占56.4%(97/172),CSFV阳性占31.4%(54/172)。PRRSV和CSFV的混合感染占12.2%(21/172),说明枣庄地区大部分猪场已经普遍存在PRRSV感染。
PRRSV 多重 RT-PCR CSFV 感染
近年来,随着枣庄地区生猪养殖量的不断增加,猪繁殖与呼吸综合征(porcine reproductive and respiratory synduome, PRRS)发生的越来越频繁,危害也越来越严重。
1 材料与方法
1.1 材料
1.1.1 病料 发病猪病料采集时间为2008~2010年,采集枣庄市畜牧兽医局兽医实验室化验门诊病历,分别来自枣庄市中区6个乡镇及周边地区的54个不同规模猪场及农村散养户“疑似猪高热病”病猪或血样,共172份病料,包括病猪心、肝、脾、肺、肾、淋巴结、胎儿组织、胎盘等脏器或血液样品。每一病例取部分病变组织3.0g左右,加少量灭菌PBS,用灭菌研磨器研磨至糊状,再加灭菌PBS释成乳剂,置-70℃冰箱反复冻融3次(血清样品无需研磨反复冻融),3000~4000rpm,4℃离心5min,取上清置-20℃冰箱保存。
1.1.2 主要试剂 TRIzol®Reagent 购自Invitrogen 公司,One Step RNA RT-PCR试剂盒(AMV)为宝生物工程(大连)有限公司产品;DL2000 Marker,购自济南辰飞生物工程公司;其他化学试剂如氯仿、异丙醇、无水乙醇等,均为国产分析纯产品。
1.1.3 主要仪器 ELX800型酶标仪(美国BioTek公司),TGL-16G型常温离心机(上海安亭科学仪器厂制造),PCR仪、Centrifuge 5417R台式冷冻离心机(德国Eppendorf公司),JA1003型电子天平(上海精科天平),DYYⅢ-31A/31B型电泳槽(北京六一仪器厂),Gdldoc EQ凝胶成像分析系统(美国BIO-RAD公司),SUB28型恒温水浴水槽(英国Grant公司),超净工作台(加拿大Canadian Cabinets公司)。
1.1.4 引物 根据GeneBank中已发表的猪繁殖与呼吸综合征病毒JXA1毒株,设计合成目的基因PRRSV Nsp2基因片段引物PN1、PN2和扩增ORF5基因的引物P51、P52,同时根据已发表的CSFV核酸序列,选择高度保守性5′端非编码区设计猪瘟引物C51、C52,引物由上海生工生物工程公司合成,使用前用灭菌超纯水配成浓度为25μmol/L,-20℃保存备用。经试验验证PN1、PN2、C51、C52 可以组合为多重RT-PCR同时检测高致病性PRRSV与CSFV(见表1)。

表1 引物设计 (bp)
1.1.5 RT-PCR相关溶液配制 按常规方法配制。
1.2 方法
1.2.1 核酸提取 用Trizol试剂盒提取病毒总RNA,操作方法按说明书进行。
1.2.2 一步法RT-PCR扩增 以病毒RNA核酸为模板进行RT-PCR扩增。反应体系为25μl。扩增程序为50℃反转录30min,94℃预变性2 min,然后进行30个循环(94℃变性50s,56℃退火30s,72℃延伸1min),最后72℃延伸10min,4℃保存。取10µl产物在1.0%的琼脂糖凝胶上电泳,EB染色,观察。
1.2.3 特异性试验 分别取实验室保存的PRRSV SX-1变异毒株与CSFV疫苗毒株作为阳性对照,使用表1中4对引物混合物,分别对阳性对照和阴性对照进行扩增试验,测试引物特异性。
1.2.4 敏感性试验 核酸蛋白检测仪测定PRRSV SX-1株和CSFV疫苗毒株的混合RNA以确定其基因组RNA的浓度,并将提取的RNA依次做10倍梯度稀释,每个稀释度取3μl作为模板,进行多重RT-PCR扩增以检测其敏感性。
1.2.5 临床病料的多重RT-PCR检测 利用建立的多重RT-PCR方法对枣庄地区的不同规模猪场及农村散养户“疑似猪高热病”病猪或血样进行检测,同时以PRRSV SX-1株和CSFV疫苗株为阳性对照,以灭菌水作为阴性对照。
2 结果与分析
2.1 特异性试验
分别提取PRRSV SX-1变异毒株与CSFV疫苗毒株,利用表1中4对引物的混合物,对上述模板进行扩增。结果在PRRSV的模板中,只扩增出了大小约为719bp的特异性片段;在含有CSFV的模板中,只扩增出了大小约为267bp的特异性片段。同时对临床“疑似高热病料”进行检测,结果见图1,反应特异性良好。

图1 引物特异性分析
1:DNA 分子质量标准;2:PRRSV阳性对照;3:CSFV阳性对照;4:永安病料;5:齐村病料
2.2 敏感性试验
用核酸蛋白检测仪测定得到PRRSV SX-1株与CSFV疫苗毒株的混合基因组RNA浓度为20 μg/ml。将提取的RNA依次做10倍梯度稀释,每个稀释度取10μl模板,用引物P1和P2进行RT-PCR扩增,结果显示其敏感性为20pg。
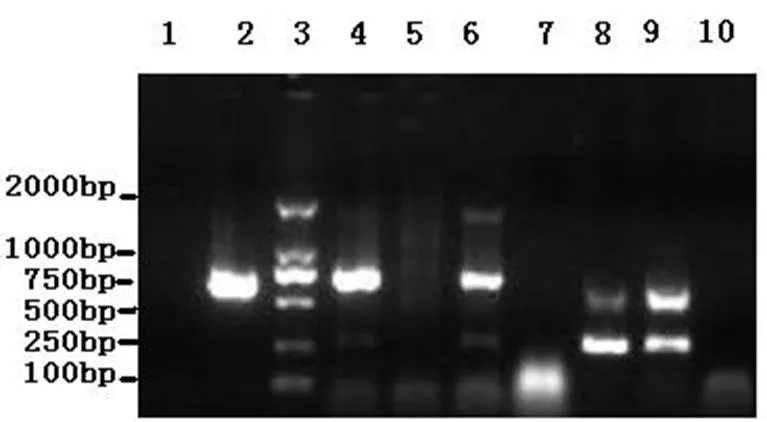
图2 7份临床病料的多重RT-PCR检测结果
1:税郭病料;2:西王庄病料;3 :DL2000 DNA Marker;4:齐村病料;5:孟庄病料;6:永安病料;7:光明病料8:其他病料;9:阳性对照;10:阴性对照
2.3 多重RT-PCR检测病料
RT-PCR扩增产物经1%琼脂糖凝胶电泳可见两条特异性扩增片段的条带,大小分别为750bp和260bp左右,与预期结果一致。多重RT-PCR 方法检测部分样品的电泳结果如图2所示。
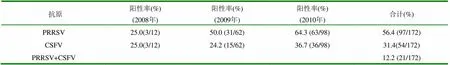
表2 枣庄地区病料多重RT-PCR检测结果(2008~2010年)
从表2结果显示,2008~2010年间枣庄地区采集的172份疑似“猪高热病”样品高致病性PRRSV阳性占56.4% (97/172),CSFV阳性占31.4%(54/172)。PRRSV和CSFV的多重混合感染,阳性占12.2%(21/172)。
3 讨论
2006年6月份以来,我国部分地区发生了“猪高热病”疫情,给养猪业造成了巨大的经济损失。其中高致病性PRRSV是导致猪“高热综合症”的主要病原之一,有些病例检测到CSFV。目前,很多猪场存在这两种传染病,并且CSFV和PRRSV常呈混合感染。本研究发现,枣庄地区PRRSV变异株阳性病料或猪瘟阳性病料,说明混合感染已十分普遍和严重,应当引起养殖场和管理部门的高度重视。枣庄地区采集的172份临床疑似“猪高热病”样品,高致病性PRRSV阳性占56.4%(97/172),CSFV阳性占31.4% (54/172)。这与王仕荣等在广西“猪高热综合征”主要病原调查中,检出率最高的为PRRSV 变异株毒株占59. 59 %(87/ 146)相似,与李维华(2008)等报道的CSFV感染的阳性率较低,仅为3.13%不完全一致。王义桂等(2007)曾报道近几年山东省养猪业存在CSFV和高致病性PRRSV及PRV等多种病毒的混合感染。本试验对采集的172份样品进行了多重RT-PCR检测,结果表明,枣庄地区也均存在PRRSV和CSFV的多重混合感染,阳性占12.2%(21/172),本试验进一步验证枣庄地区猪群中混合感染现象比较普遍。由于PRRSV能引起免疫抑制,促进CSFV等病毒的感染,造成细菌大量继发感染,可能加重猪发病并导致死亡。因此,在今后的疾病防控中,如何提高猪体的免疫力值得重视。此外,对2009年采集样品与1010年采集样品的检测结果进行数据统计时发现,2009年PRRSV阳性为50.0%(31/62),CSFV阳性为24.2%(15/62),而2010年PRRSV阳性率高达64.3%(63/98),CSFV阳性率达到36.7%(36/98),与近年来防疫力度有一定关系。
(2011–03–23)
S858.28
A
1007-1733(2011)04-0011-02
