一株新城疫病毒的分离鉴定及其F基因的克隆与序列分析
2011-11-05苏文政牛钟相张琳朱荣生韩红
苏文政 牛钟相 张琳 朱荣生 韩红
一株新城疫病毒的分离鉴定及其F基因的克隆与序列分析
苏文政①②牛钟相①张琳②朱荣生②韩红②
(①山东农业大学动物科技学院 泰安 271018 ②山东省农业科学院畜牧兽医研究所 济南)
本试验对山东某鸡场发生疑似新城疫感染的肉鸡分离得到的一株病毒,经鸡红细胞血凝、血抑试验和动物回归试验,结果表明,该分离株为新城疫病毒。对其毒力学指标进行测定,结果MDT为55.6h,ICPI为1.95,IVPI为2.85,表明该毒株为新城疫强毒株。PCR特异性扩增NDV-SD-02的F基因,大小为1662bp,编码553个氨基酸,F基因裂解位点氨基酸序列为112R-R-Q-K-R-F117,符合强毒株氨基酸序列的特点, 与生物学特性测定的结果完全相符。对分离株F基因的序列分析表明,与近年来国内外分离得到的Ⅶ型NDV同源性较高,为84.7%~98.9%,该毒株属基因Ⅶ型。
新城疫病毒 生物学特性 F基因 序列分析
新城疫(Newcastle Disease,ND)是由新城疫病毒(Newcastle Disease Virus,NDV)引起的禽类一种急性、败血性传染病,世界动物卫生组织(OIE)将其列为对畜禽危害最大的A类传染病之一[1],其病原—NDV属于副粘病毒科禽腮腺炎病毒属,为有囊膜的负链RNA病毒[2]。NDV基因组为单股不分节RNA,编码6种结构蛋白,其中融合蛋白(F)和血凝素-神经氨酸酶蛋白(HN)为NDV的功能性糖蛋白,F蛋白能够促进病毒囊膜和宿主细胞膜的融合,蛋白裂解位点处的氨基酸序列对病毒的毒力有着非常重要的影响,被看作判定NDV毒力的重要标准[3]。此外,根据F基因的高变区序列将NDV划分为不同的基因型[4]。一直以来,新城疫都危害禽类养殖,造成严重经济损失,所以本研究从山东某鸡场分离到新城疫病毒,对其生物学特性和致病性进行了分析,并对F基因进行了研究,旨从分子水平阐明各毒株间的异同,为该病的防控及分子流行病学研究奠定基础。
1 材料与方法
1.1 病料与实验动物 病料分离自山东某规模化肉鸡场发病鸡群。SPF鸡胚及SPF雏鸡由山东省农科院家禽研究所提供。
1.2 主要试剂 Trizol购于Invitrogen公司;M-MLV、Rnase Inhibitor、ExDNA聚合酶、pMD18-T Vector、限制性内切酶、DNA Marker DL2000均购于宝生物工程(大连)有限公司;DNA凝胶回收试剂盒、质粒快速提取试剂盒为Promega公司产品。新城疫La Sota株标准阳性血清(HI效价为为2-10),禽流感(H5和H9)标准阳性血清,EDS-76阳性血清均购于中国兽药监察所。1%鸡红细胞和灭菌生理盐水由本研究室按照常规方法制备。
1.3 引物设计与合成 根据GenBank中登陆的鸡源NDV F基因核苷酸序列,设计特异性引物,用于扩增F基因。引物由上海生工合成,序列U1:5’-ATGGGCTCCAAACC TTCTACCAG-3’ L2: 5’-TCGCCCT TTTGTAGTGGCTCTC ATC -3’。
1.4 病毒分离与鉴定 无菌采集发病鸡的气管、脾脏和肝脏等组织制成匀浆,按1:4加入灭菌生理盐水制成悬液,反复冻融3次(-70℃/37℃),8000r/min离心10min,取上清加青链霉素至2000IU/ml,置4℃冰箱过夜。后经尿囊腔接种10日龄SPF鸡胚10枚,0.2ml/胚,石蜡封口后置37℃孵化器中孵化,每日照蛋2次,收集24h~72h的死胚及72h的存活胚尿囊液,再用10日龄SPF鸡胚连续盲传2代收集鸡胚尿囊液保存于-70℃备用。
1.5 尿囊液血凝抑制试验 按照新城疫微量红细胞凝集抑制试验操作规程检测病毒分离株血凝特性。根据HA效价,配制成4IU病毒,分别与NDV、禽流感病毒(H5、H9)及EDS-76的标准阳性血清进行HI试验。
1.6 动物回归试验 将新鲜鸡胚尿囊液10倍稀释,经滴鼻、点眼途径攻毒10只30日龄左右的SPF鸡,0.5ml/只。观察鸡群变化。
1.7 病毒生物学特性测定 按照2001年版《中华人民共和国兽用生物制品质量标准》规定方法,进行最小致死量鸡胚平均死亡时间(MDT)、1日龄雏鸡脑内致病指数(ICPI)及6周龄SPF鸡静脉接种致病指数(IVPI)测定。
1.8 F基因的RT-PCR扩增与序列分析 (1)病毒RNA提取。参照Trizol试剂盒使用说明提取病毒RNA,最后用20ul RNase Free H2O溶解RNA,-80℃冻存备用。(2)F基因的RT-PCR扩增。反应体系中加入5×RT Buffer 2ml,dNTP 1ml,Rnase Inhibitor 0.25ml,M-MLV 0.5ml,RNA模板5ml,随机引物2ml,混匀后瞬时离心甩至管底,PCR仪中42℃反应90min,然后70℃ 15min。PCR反应体系为50ml:cDNA 8ml,10×PCR Buffer 5ul,dNTP 4ml,F1 1ml,F2 1ml,ddH2O 32ml,95℃ 5min后,冰浴2min,再加Ex酶1ml,混匀后按下列条件PCR扩增:94℃变性1min,55℃退火1min,,72℃延伸3min,30个循环;最后72℃延伸10min,4℃保存。取10ml PCR产物用1%琼脂糖凝胶电泳进行分析。(3)F基因PCR产物的克隆及序列测定将RT-PCR特异性产物F基因回收后与pMD18-T载体连接,并转化至大肠杆菌JM109中,筛选获得阳性克隆菌株并进行酶切及PCR鉴定后,送至大连宝生物工程有限公司进行序列测定。(4)F基因的序列分析:利用DNAMAN和Genetyx等软件,对测序结果进行拼接和序列分析,并将其与其它毒株进行同源性分析。
2 结果
2.1 病毒的分离与鉴定 将病料接种鸡胚后,所接鸡胚在72h内逐渐死亡,尿囊液清亮透明,死亡鸡胚水肿,全身出血,尤以头部和爪子明显。所测HA效价在2-6~2-8之间,将其尿囊液盲传2代后可稳定在2-9。将HA为2-9的尿囊液与ND阳性血清、AI-H5、AI-H9单因子血清、EDS-76标准阳性血清进行HI试验,发现该病毒能被ND阳性血清所抑制,而不能被其他3种血清所抑制。结果表明分离到的毒株为新城疫病毒,将其命名为NDV-SD-02。
2.2 动物回归试验 5只被攻毒的SPF鸡48后均食欲下降、精神萎靡,并有明显呼吸道症状,攻毒后4d内全部死亡,剖检可见喉头、气管黏膜充血,肠道出血,腺胃尤其严重,实质性器官肿大,皮肤出血溃疡,为典型新城疫症状。采集病料处理后接种鸡胚,培养后收取尿囊液,做HI试验,结果与自然病例相符,也具有血凝性且能被ND标准阳性血清中和。
2.3 MDT、ICPI、IVPI测定结果 按照毒力判定标准,表明该新城疫分离株为强毒型,详见表1。

表1 新城疫NDV-SD-02株的毒力指标
2.4 NDV-SD-02分离株F基因的RT-PCR扩增与序列分析 (1)F基因扩增与重组质粒的鉴定。PCR扩增结果显示产物大小为1662bp,与预期相符。随后采用pMD18-T载体与F基因连接,转化感受态JM109,用IPTG/X-gal琼脂平板蓝白斑筛选,随机挑取白色菌落,提取质粒后进行双酶切鉴定得到1662bp片段,表明成功获得了NDV-SD-02株 F基因的重组克隆质粒,命名为pMD18-T/NDV-F。(2)测序结果与序列分析。测序结果显示,F基因开放阅读框(ORF)全长为1662bp,编码553个氨基酸,含有12个半胱氨酸残基(分别位于25、76、199、338、347、362、370、394、399、401、424、523氨基酸残基处)和6个潜在的糖基化位点(Asn-x-Thr/Ser,NXT/S)(分别位于85、191、366、447、471、541氨基酸残基处,第1个位点在F2多肽上,其余均在F1多肽上),裂解位点处氨基酸组成为112Arg-Arg-Gln-Lys-Arg-Phe117,具有NDV强毒株的典型分子特征,这与生物学特性测定的结果完全相符。(3)同源性分析。将NDV-SD-02株与国内外近年来分离到的NDV强毒株和弱毒株进行F基因核苷酸及推导的氨基酸序列进行同源性比较,结果显示核苷酸同源性为84.7%~98.9%,氨基酸同源性为88.8%~98.9%,其中与传统的F48E9、La Sota毒株相比,核苷酸和氨基酸同源性分别为84.96%~87.1%和89.3%~91.7%,同源性较低,而与Ⅶ型NDV同源性较高。(4)系统发育进化树:根据NDV F基因有代表性的区域(1-347bp)对分离株进行基因分型,并应用DNAMAN和Mega3绘制遗传进化树,结果显示分离株处于Ⅶ型基因型分支,获得的分离株为基因Ⅶ型。
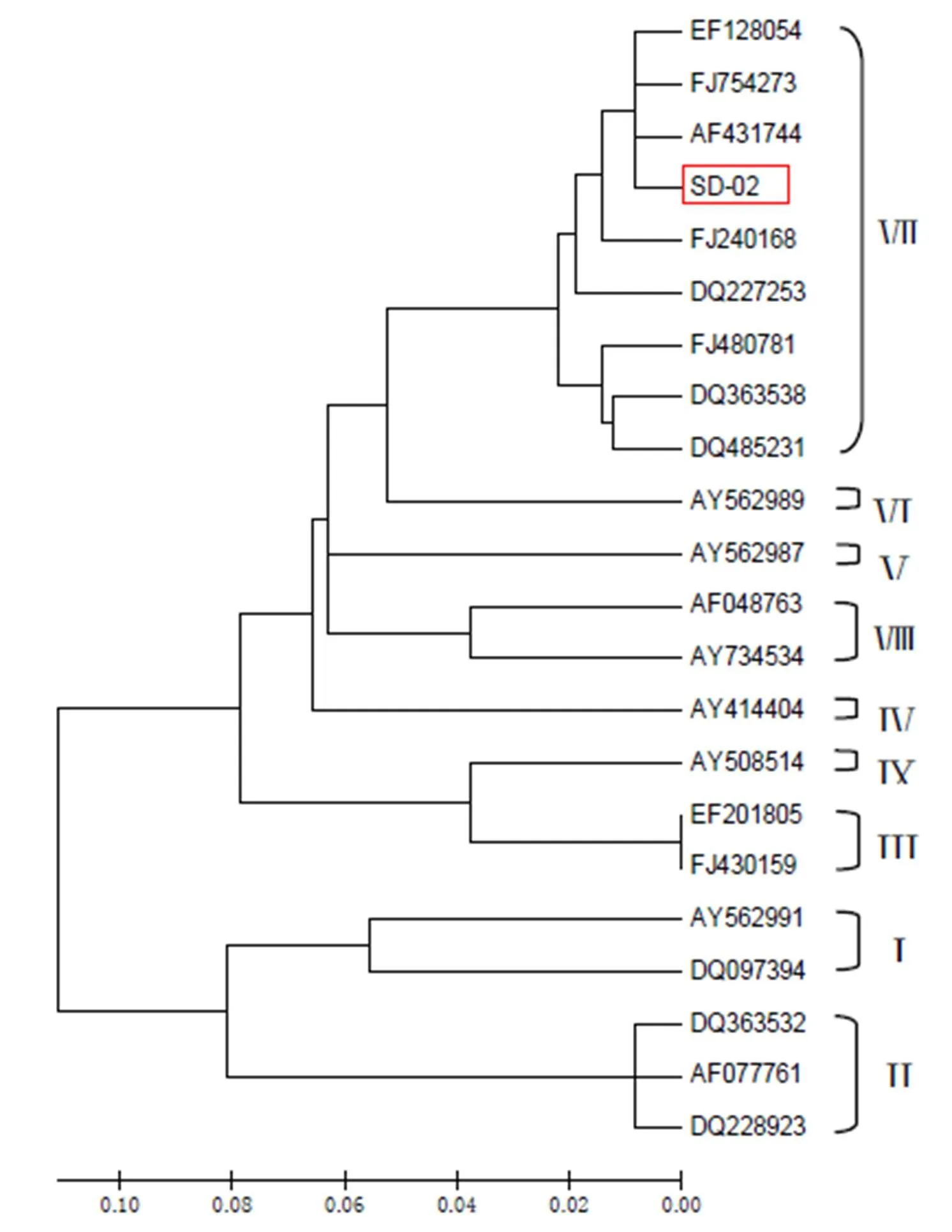
图1 根据F基因1-374bp核苷酸序列绘制的遗传进化树(方框为分离株NDV-SD-02)
3 讨论
NDV只有1个血清型,但不同毒株对鸡的致病性不同,一般分为3个类型:速发型病毒株(包括速发嗜内脏型、速发嗜神经型和速发嗜肺型)、中发型病毒株和缓发型病毒株[5]。判断1株NDV病毒属于哪一致病型常需测定3个指示,即最小致死量鸡胚平均死亡时间(MDT)、1日龄雏鸡脑内致病指数(ICPI)及6周龄SPF鸡静脉接种致病指数(IVPI)。其中以ICPI最为关键,IVPI可作为参考。本研究中MDT、ICPI、IVPI毒力检测分别为55.6h、1.95、2.85,表明分离株NDV-SD-02属强毒株。此外根据人工感染鸡临床症状,毒株为速发嗜内脏型。
F蛋白是NDV感染细胞所必需的,它能够促进病毒囊膜与细胞膜的融合。研究表明,NDV强毒株F蛋白裂解位点为112R-R-Q-R/K-R-F117,本研究分离得到的NDV-SD-02株F蛋白裂解位点序列为112R-R-Q-K-R-F117,属于NDV强毒,这一结果也与致病力测定结果(MDT、ICPI、IVPI)相符。
19世纪80年代以来在世界各地分离出NDV的基因Ⅶ型。我国近20年流行的NDV也主要为基因Ⅶ型,但也有较老的基因II型和Ⅲ、Ⅵ、Ⅸ等型[6]。本研究中分离的病毒株与近年来分离得到的NDV病毒株相比,核苷酸同源性为84.7%~98.9%,其中与F48E9、La Sota毒株相比核苷酸和氨基酸同源性分别为84.96%~87.1%和89.3%~91.7%,同源性低,而与与Ⅶ型NDV同源性较高,在进化树中也与Ⅶ型同处一分支。
目前,我国主要采用Maktesuar(I系)、LaSota(Ⅳ系)等疫苗对家禽进行免疫[7],但研究结果表明,分离株与疫苗株同源性较低,交叉免疫效果有限,这可能是造成免疫效果不佳的原因之一。所以需要筛选与流行株密切相关的病毒作为候选疫苗株,为家禽养殖提供更有效的防治措施,这也要求进一步做好新城疫病毒的流行病学调查,从而有效控制新城疫的发生。
[1] Mayo M A, A summary of taxonomic changes recently approved by ICTV [J]. Arch Virology, 2002,147:1655~1656.
[2] Chambers P, Millar N S, Bingham R W,. Molecular cloning of complentary DNA to Newcastle disease virus, and nucleotide sequence analysis of the junction between the genes encoding the haemagglutinin-neuraminidase and the large protein [J]. Journal of General Virology, 1986,67:475~486.
[3] Anthony,Hodder,Pawl w. Analysis of pathotype-specific structural features and clesvage activation of Newcastle disease virus membrane glycoprotein using antipeptide [J]. Journal of General Viro:74,1081-1091,1993.,
[4] Nagai Y, Klenk HD. Proteolytic cleage of the viral glycoproteins and its significance for the virulenc of Newcastle disease virus [J]. Virology 72:494-508,1976).
[5] 刘怀然, 孙敏华等. 不同宿主源NDV毒株对SPF鸡致病性研究[J]. 中国预防兽医学报. 2009(2).
[6] 吴艳涛, 倪雪霞, 万洪全等. 我国部分地区不同动物来源新城疫病毒的分子流行病学研究[J]. 病毒学报, 2002, 18(3): 264-269.
[7] 孙杰, 刁有祥等. 10株鸭源新城疫病毒的分离鉴定及F基因遗传进化分析[J]. 畜牧兽医学报, 2010, 41(8):1054-1060.
(2011–03–21)
S852.65+9
A
1007-1733(2011)04-0005-03
