4种方法检测表皮葡萄球菌生物膜形成能力的应用价值探讨
2011-11-05李冬冬陶传敏
李 燕,李冬冬,宋,陶传敏
(1.成都中医药大学医学技术学院;2.四川大学华西医院实验医学科,四川成都610041)
表皮葡萄球菌(staphylococcus epidermidis,SE)属于条件致病菌,其毒力较低,仅产生一种毒素-溶血性的δ毒素,故常引起亚急性感染;近年来随着生物材料如人工瓣膜、人工关节在临床的广泛应用,以及留置静脉导管等侵入性操作的增多,表皮葡萄球菌引起的临床感染日益增多,已成为医院感染中最重要的病原之一。虽然体外实验显示感染细菌对抗生素敏感,但在体内表皮葡萄球菌却难以被清除,表皮葡萄球菌在体内粘附材料表面形成生物膜是导致感染和耐药的重要原因,生物膜的形成是其致病的主要毒力因素。对实验室而言,评估表皮葡萄球菌临床分离菌株生物膜形成能力不仅为判断表皮葡萄球菌的毒力提供依据,而且对临床有效控制表皮葡萄球菌感染具有重要意义。
本文参考相关文献,采用4种方法检测了临床分离的45株表皮葡萄球菌体外生物膜形成能力,并对其临床应用价值进行评价。
1 材料与方法
1.1 材料
1.1.1 菌株 收集成都地区两家医院患者临床标本中分离的45株表皮葡萄球菌,删除同一患者相同感染部位分离的重复分离菌株。所有菌株均经过临床鉴定。以表皮葡萄球菌ATCC 12228株为生物膜形成的阴性对照株。
1.1.2 主要试剂及仪器 LB肉汤自配、葡萄糖、结晶紫、琼脂糖均为国产分析纯。细菌DNA提取试剂盒、PCR反应试剂盒购自四川天泽基因公司;PCR仪、电泳仪、凝胶成像系统为BIO-RAD公司产品、扫描电镜为日立1000B。
1.2 方法
1.2.1 刚果红实验 按文献[1]选择血平板分离的单个菌落接种于刚果红培养基(刚果红0.8 g/L,脑心浸液干粉37 g/L,蔗糖50 g/L,琼脂粉12 g/L),37℃培养24 h后再在室温放置24 h,观察结果。菌落黑色、干燥并出现结晶为生物膜阳性菌株,而红色、光滑菌落为不产生物膜菌株。
1.2.2 半定量粘附实验检测表皮葡萄球菌生物膜形成 按文献方法[2],略作改动。将LB肉汤培养18 h的表皮葡萄球菌用新鲜LB肉汤(0.25%葡萄糖)按1∶200比例稀释。将0.2 ml稀释后的菌液加人96孔平底组织培养盘,每株分别移入4个平行孔。37℃培养18 h后,吸干每孔菌液,然后用 PBS(pH7.2)缓冲液洗板3次,然后用BOUIN固定液固定,用结晶紫染色,洗去未粘附细菌,晾干,每孔加入200μl丙酮酒精,微振荡,酶标仪检测每孔的A570nm值。生物膜形成阳性株筛选条件为:阴性对照菌株平均A值±3倍标准差为界定值,以平均A值大于界定值为生物膜形成株。
1.2.3 扫描电镜观察表皮葡萄球菌生物膜形成将表皮葡萄球菌接种于无糖2ml LB%肉汤中,37℃培养过夜后,取15μl接种六孔组织培养板,每孔加入0.25%糖LB 3ml,每孔放入无菌盖片,37℃孵育,48 h后更换培养液(PBS洗三次后,加入含0.5%糖LB),第二次换夜后孵育24h,取出盖片,PBS洗三次。2.5%戊二醛4℃固定过夜后,无菌水冲洗干净。30%,50%,70%,80%,90%,100%乙醇,各4℃脱水10min,进行扫描电镜观察。
1.2.4 PCR检测icaA基因 模板DNA提取严格按基因组DNA提取试剂盒说明书进行。模板DNA经1%琼脂糖凝胶电泳鉴定。icaA基因引物根据GeneBank中icaA基因序列(staphylococcus epidermidis RP62A,CP000029),经NCBIPrimer-Blast设计并检测其特异性 ,序列为 :5’GAGGGAATCAAACAAGCA-3’,5’-AGGCACTAACATCCAGCA-3’,由上海生物工程公司合成;PCR扩增条件:94℃预变性4 min,94℃30 sec,47℃60 sec,72℃1 min,共30个循环,72℃延伸10 min。扩增后取5μl反应产物经2%琼脂糖凝胶电泳检测及成像。扩增产物为405 bp DNA片段。
1.2.5 统计学处理 采用SPSS13.0统计软件,结果采取行×列表χ2检验分析,α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 4种方法检出表皮葡萄球菌生物膜形成能力
半定量粘附实验中,以ATCC 12228株作为阴性对照测得界定值为0.110,以平均A值大于0.110的菌株为生物膜阳性株,平均A值小于或等于0.110的菌株为生物膜阴性株。刚果红实验、PCR扩增icaA基因、扫描电镜实验结果见图1、2、3。
45株临床分离的表皮葡萄球菌有13株4种方法检测均能形成生物膜,27株4种方法检测均不能形成生物膜,余5株检测结果不尽相同,见表1。刚果红实验、半定量粘附实验、扫描电镜实验、PCR扩增icaA检出的阳性率分别为31.1%、40.0%、40.0%、28.9%,无统计学差异(χ2=1.80,P >0.05)。
2.2 灵敏度(sensitivity,SE)和特异性(specificity,SP) 以扫描电镜结果为真阳性标准,其他3种方法检测表皮葡萄球菌生物膜形成的灵敏度和特异性见表2。

图1 刚果红实验结果
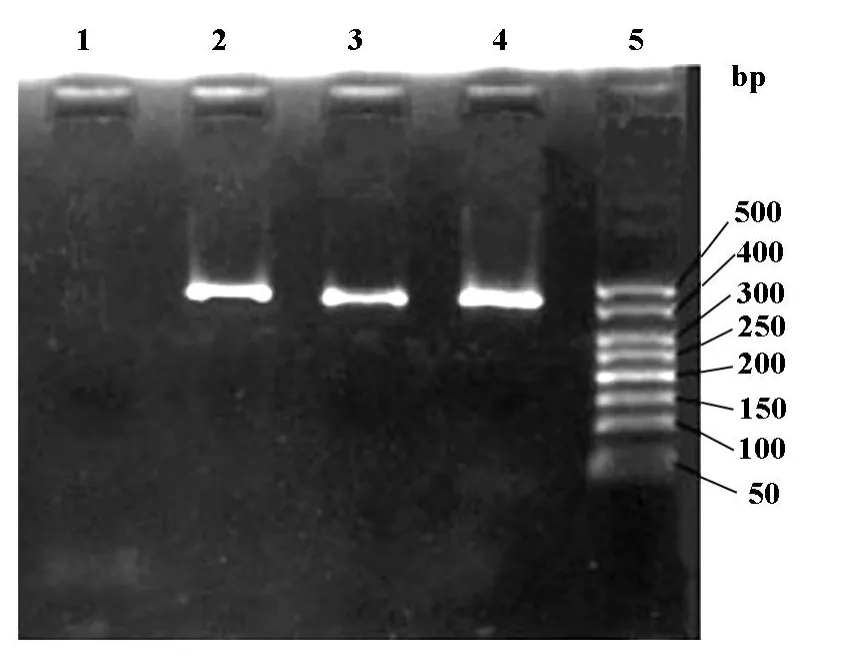
图2 表葡菌株ica基因PCR产物电泳图

图3 72 h生物膜扫描电镜图(1 000 kv 10 000×)
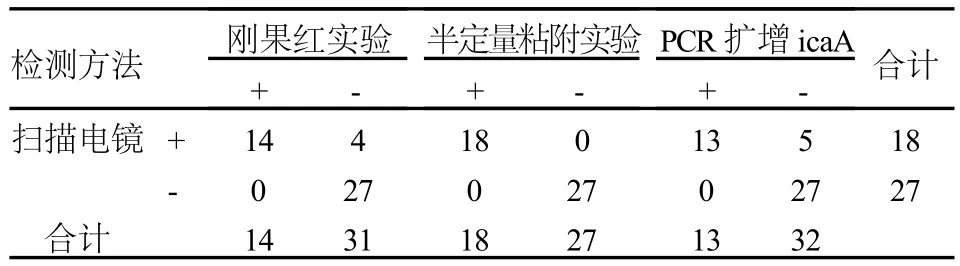
检测方法 刚果红实验 半定量粘附实验PCR扩增icaA 合计+ -+ -+ -扫描电镜 + 14 4 18 0 13 5 18- 0 27 0 27 0 27 27合计 14 31 18 27 13 32
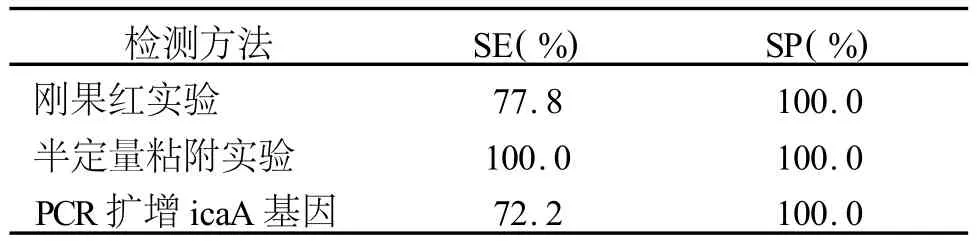
表2 3种方法检出表皮葡萄球菌生物膜形成能力的灵敏度和特异性
3 讨论
生物膜的形成是细菌为适应自然环境而采取的一种策略。生物膜保护细菌,对抗抗生素和机体免疫吞噬作用的特征是生物材料相关感染性疾病的重要原因之一。目前有关生物膜的形成机制研究已成为热点,也取得了较大的进展,但如何快速、有效地评估细菌生物膜的形成能力,帮助临床快速控制感染方面却明显不足。由于生物膜形成是一个复杂耗时的多基因调控、多因子参与的过程,因此,各个实验室体外检测生物膜形成的方法各不相同、操作程序缺乏标准化。目前生物膜形成能力的检测方法主要有胞外粘附基质检查法和显微镜形态学观察法,常用方法有刚果红实验[1]、半定量粘附实验[2]、银染法、扫描电镜或激光共聚焦扫描显微镜等,均为表性检查方法。刚果红实验为胞外多糖粘附素(PIA)染色法,生物膜形成过程中产生的胞外多糖粘附素与刚果红牢固结合,使菌落呈现红色,其操作简便快速,是生物膜形成的定性检测方法;半定量粘附实验为胞外粘附基质的结晶紫染色法,是表型检测的传统方法,但其操作较为复杂耗时;扫描电镜可直接观察生物膜的独特结构,结果更为准确,被认为是检测生物膜形成能力的“金标准”,但实验条件要求太高,且价格昂贵,难以满足临床实验室对生物膜形成能力的评估要求。近年来,随着有关生物膜形成机制研究的深入,越来越多的证据显示ica操纵子是生物膜形成的重要基因,其编码产生胞外多糖粘附素(PIA)是生物膜形成的最好桥梁,体外研究也证明PIA是表皮葡萄球菌逃逸免疫攻击和毒力所必需的[3,4]。Arciola CR等[5]就认为PCR法检测ica基因是非常有效的诊断技术,可大大提高生物膜细菌的诊断阳性率。因此,本次实验采用了刚果红实验、半定量粘附实验、扫描电镜3种表型检测法和PCR扩增icaA基因检测了45株临床分离的表皮葡萄球菌,结果显示4种方法的阳性检出率分别为31.1%、40.0%、40.0%、28.9%,阳性检出率无差异(χ2=1.80,P>0.05)。
本次实验以扫描电镜观察为“金标准”,发现半定量粘附实验的灵敏度和特异性均为100.0%,提示该方法可作为筛查生物膜形成的可靠方法,且价格低廉,若有经验丰富的技术人员,可作为常规检查应用于临床;刚果红实验、PCR扩增icaA两种方法的特异性均为100.0%,灵敏度分别为 77.8%、77.2%,这与Arciola CR等的报道略有差异,提示生物膜形成可能存在独立于ica和PIA之外的机制存在。Qin Z等[6]就报道表皮葡葡萄球菌细胞表面相关蛋白(Autolysin E,AltE,altE基因编码)具有粘附玻璃粘连蛋白(Vitronectin,Vn)活性,可以促使表皮葡萄球菌与宿主蛋白包被的生物材料结合,介导细菌黏附于多聚物表面,若altE基因缺失,细菌粘附能力下降;Rohde H等[7]也证实了在全髋关节(THA)和膝人工关节成形术(TKA)后人工关节感染中分离到的金黄色葡萄球菌和表皮葡萄球菌中存在着聚集相关蛋白(accumulation associated protein,AAP,aap基因编码)介导的生物膜形成机制。因此,在临床实践中,特别是标本量较大的实验室中,可考虑利用刚果红实验、PCR扩增icaA的简便快速、特异性高的特点,对表皮葡萄球菌生物膜形成能力进行过筛检查。可疑或阴性菌株则可以通过半定量粘附实验加以证实。
总之,表皮葡萄球菌生物膜形成能力的检测对临床控制生物材料引起的医院感染有着举足轻重的作用,其方法的标准化不可忽视,尚需要大样本的、广泛的深入研究,才能得到客观、准确的检测结果,真正为临床治疗生物膜引起感染提供帮助。
[1]韩乾国,余汝佳,高燕渝,等.临床分离表皮葡萄球菌生物膜相关遗传背景和表现型关系研究[J].四川医学,2006,27(5):453.
[2]王勇翔,李华林,李平洋,等.表皮葡萄球菌生物膜形成与ica操纵子的相关性研究[J].中华微生物学和免疫学杂志,2003,23(6):428.
[3]Vuong C,Kocianova S,Voyich JM,etal.A crucial role for exopolysaccharidemodification in bacterial biofilm formation,immune evasion and virulence[J].JBiol Chem,2004,279(52):54881.
[4]Gu J,Li H,LiM,et al.Bacterial insertion sequence IS256 as a potential molecularmarker to discriminate invasive strains from commensal strains of Staphylococcus epidermidis[J].J Hosp Infect,2005,61(4):342.
[5]Arciola CR,Campoccia D,Baldassarri L,etal.Detectionof biofilm formation in Staphylococcus epidermidis from implant infection.,comparison of a PCR-method that recognize the presence of ica geneswith two classic phenotypicmethods[J].JBiomed Mater RESA,2006,76(2):425.
[6]Qin Z,Qu Y,Yang L,et al.Role of autolysin mediated DNA release in biofilm formation of Staphylococcus epidermidis[J].Microbiology,2007,153(pt7):2083.
[7]Rohde H,Burandt EC,Siemssen N,et al.Polysaccharide intercellular adhesionor protein factors in biofilm accumulation of Staphylococcusepidermidis and Staphylococcus aureus isolated from prosthetic hip and knee joint infection[J].Biomaterials,2007,28(9):1711.
