响应面法优化杨梅渣中槲皮素提取工艺的研究
2011-11-02叶立斌励建荣
韩 强,陈 卫,叶立斌,励建荣,2,*
(1.浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江杭州310035;2.渤海大学,辽宁锦州121013)
响应面法优化杨梅渣中槲皮素提取工艺的研究
韩 强1,陈 卫1,叶立斌1,励建荣1,2,*
(1.浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江杭州310035;2.渤海大学,辽宁锦州121013)
采用超声辅助提取的方法,通过单因素结合响应面分析,对杨梅渣活性成分槲皮素的提取工艺进行了优化。在单因素实验的基础上,根据中心组合(Box-Benhnken)实验设计原理,采用三因素三水平的响应面分析法,以槲皮素提取率为响应值进行回归分析。结果表明,杨梅渣中槲皮素的最佳提取工艺为:提取时间33.5min,超声功率为254.6W,乙醇浓度为62.32%,料液比1∶20,槲皮素提取率为3.82mg/100g,与模型预测值基本相符。
超声辅助提取,杨梅渣,槲皮素,响应面分析法
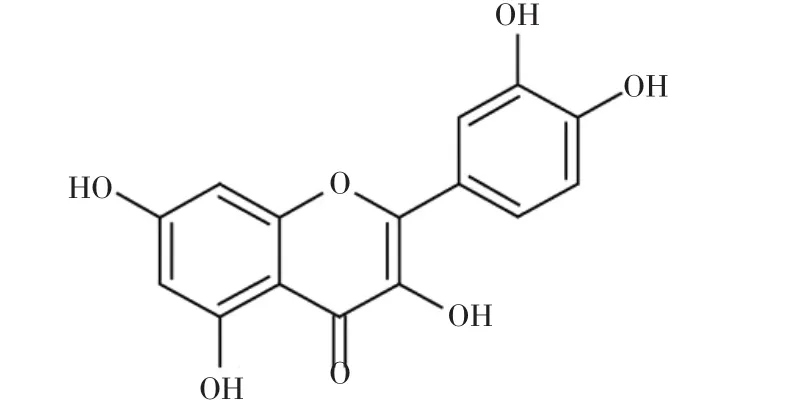
图1 槲皮素的分子结构式
1 材料与方法
1.1 材料与仪器
杨梅渣 由浙江海通食品集团股份有限公司提供;槲皮素标准品 购自上海博蕴生物科技有限公司,HPLC纯度95%以上;分析用甲酸、乙腈、乙醇 均为色谱纯,Fisher公司;提取用乙醇 工业纯。
Agilent 1100高效液相色谱仪 Agilent公司;Auto Science AS7240AT超声波清洗仪 宁波海曙金达超声波设备有限公司;高速万能粉碎机 天津市泰斯特股份有限公司。
1.2 实验方法
1.2.1 槲皮素标准液的配制 精确称取槲皮素标准品12.5mg,用无水乙醇定容至25mL,得到浓度为0.5mg/mL的槲皮素母液,从中分别取0.12、0.10、0.08、0.06、0.04、0.02mL至5mL容量瓶中,用无水乙醇定容,得到浓度分别为12.0、10.0、8.0、6.0、4.0、2.0μg/mL的槲皮素标准溶液。
1.2.2 杨梅渣提取液的制备 准确称取5g杨梅渣粉末于250mL三角烧瓶中,加入一定浓度(v/v)的乙醇在料液比1∶20,一定温度下,超声波提取一定时间,趁热减压抽滤,转移至100mL容量瓶中定容,0.45μm滤膜过滤后作为待测液。
1.2.3 HPLC测定槲皮素含量 参考国家药典中槲皮素的测定方法[9],稍作修改。色谱柱:Sunfire C18柱;紫外检测波长:378nm;柱温:30℃;流速:1.0mL/min;进样量:20μL;以峰面积外标法定量。流动相A:体积分数为0.1%甲酸;流动相B:100%乙腈溶液。洗脱程序:0~5min,0%B;5~10min,20%B;10~15min,40%B;15~25min,60%B;25~30min,70%B。
杨梅渣提取液定容后,过0.45μm滤膜,参照标准品测定的HPLC条件,计算溶液中槲皮素含量。
得率(mg/100g)=[(C×V)/m]×100
式中:C—总槲皮素含量(mg/mL);V—定容后样品液的体积(mL);m—称取样品的质量(g)。
1.3 数据分析
采用SPSS 15.0统计软件分析数据;采用Origin 8.0与Design Expert 7.1.1软件绘制分析图。
2 结果与分析
2.1 槲皮素标准曲线
在此色谱条件下,供试品色谱中槲皮素色谱峰保留时间与相应对照品一致,见图2。
图2为槲皮素标准品和样品的HPLC图谱,采用HPLC面积积分法绘制槲皮素标准曲线(图3),回归方程y=78394x-2.3155,R2=0.9999。可以看出,槲皮素在2.0~12.0μg/mL之间线性关系良好。用外标法计算样品质量浓度,从而得出槲皮素的提取率。
2.2 提取槲皮素单因素实验

图2 槲皮素对照品与提取液HPLC色谱图注:A为槲皮素标准品;B为样品。

图3 槲皮素标准曲线
影响杨梅渣槲皮素提取的因素很多,主要包括提取功率、提取温度、提取时间和乙醇浓度。在进行RSM分析前,先通过单因素实验来选取实验因素与水平。
2.2.1 提取功率对槲皮素得率的影响 固定乙醇浓度为60%,提取温度为60℃,提取时间为30min,料液比1∶20,研究提取功率对槲皮素提取率的影响,提取功率梯度设定为:56、112、168、224、280W,结果如图4所示。

图4 提取功率对槲皮素提取率的影响
由图4可见,在相同超声提取条件下,功率的大小对槲皮素的提取率有显著的影响。功率越高,槲皮素提取率越高,两者呈线性正相关关系。功率越大,萃取时料液扩散速度越快,并且对杨梅渣细胞的破坏作用越大,越有利于槲皮素浸出。当功率大于224W时,进一步增大提取功率,槲皮素提取率增加不明显,此时槲皮素分子的溶解和扩散基本达到平衡[10]。另外,功率过大,提取温度会发生较大波动,过大的能量产生的瞬间高温往往会使槲皮素化合物分解或部分分解。从升温速率、节能和安全角度考虑,采用224W进行提取比较恰当。
2.2.2 提取温度对槲皮素得率的影响 固定提取功率224W,乙醇浓度为60%,提取时间为30min,料液比1∶20,研究温度对槲皮素提取率的影响,提取温度梯度设定为:20、30、40、50、60、70℃,结果如图5所示。

图5 提取温度对槲皮素提取率的影响
由图5可知,在40~60℃温度范围内,随提取温度升高,槲皮素得率显著增加,进一步提高提取温度,槲皮素得率增长则不明显。在低于60℃时,由于温度的提高增加了溶剂分子和溶质分子的动能,促进扩散作用的进行,从而使槲皮素的提取率迅速增加[11];在60℃后,槲皮素得率趋于平衡,表明已经基本浸出。考虑高温对槲皮素的结构和性能还会产生其他的影响,初步推测比较合适的提取温度应该在60℃左右。
2.2.3 超声提取时间对槲皮素得率的影响 固定提取功率224W,乙醇浓度为60%,提取温度为60℃,料液比1∶20,研究提取时间对槲皮素提取率的影响,超声提取时间梯度设定为:10、20、30、40、50、60、70min,结果如图6所示。

图6 提取时间对槲皮素取率的影响
由图6可知,10~30min之间,随着提取时间的延长,槲皮素得率不断增加,30min以后趋于平缓。这可能是由于长时间超声处理,槲皮素在溶液中的浓度不断上升,并伴有少量胶体溶出,使得系统中黏度增加,阻碍槲皮素溶出,而导致槲皮素的得率趋于平稳,由此推测30min为较佳的提取时间。
2.2.4 乙醇浓度对槲皮素得率的影响 固定超声功率224W,提取温度为60℃,提取时间为30min,料液比1∶20,研究乙醇浓度对槲皮素提取率的影响,乙醇浓度梯度设定为:0%、20%、40%、60%、80%、100%,结果如图7所示。

图7 乙醇浓度对槲皮素提取率的影响
由图7可知,乙醇浓度在0%~60%时槲皮素提取率明显增加,继续增加乙醇浓度至80%,提取率基本不变;而当乙醇浓度在80%以后,受溶液极性的影响,提取率随着乙醇浓度的增加反而下降。这可能是因为随着乙醇体积分数的提高,溶于乙醇中的黄酮类化合物溶出量增加,提取率随之提高,直至达到槲皮素溶出最佳极性。随乙醇浓度的进一步增加,溶液极性降低,反而不利于槲皮素的溶出,从而使得槲皮素的提取率降低[12]。由此我们确定了乙醇最佳提取浓度为60%。
2.3 响应面法优化杨梅渣中槲皮素的提取工艺
2.3.1 分析因素的选取及分析方案 根据Box-Benhnken的中心组合实验设计原理,综合2.2单因素实验所得结果,在提取温度60℃,料液比1∶20条件下,选取对槲皮素提取率影响较明显的提取时间、超声功率和乙醇浓度这3个因素,采用三因素三水平响应面分析方法分析超声辅助提取最佳工艺条件,实验因素和水平设计见表1,结果见表2。
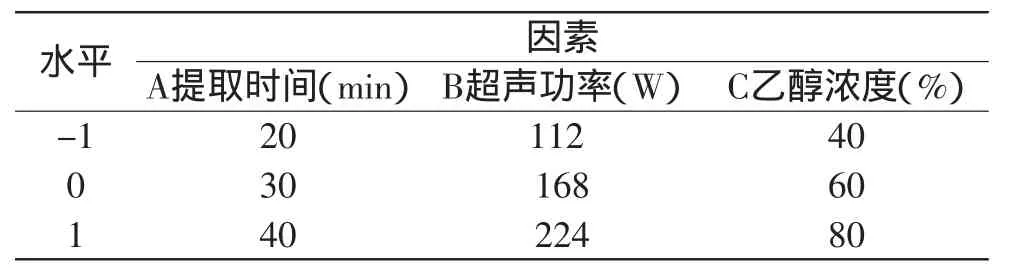
表1 响应面分析实验因素水平表
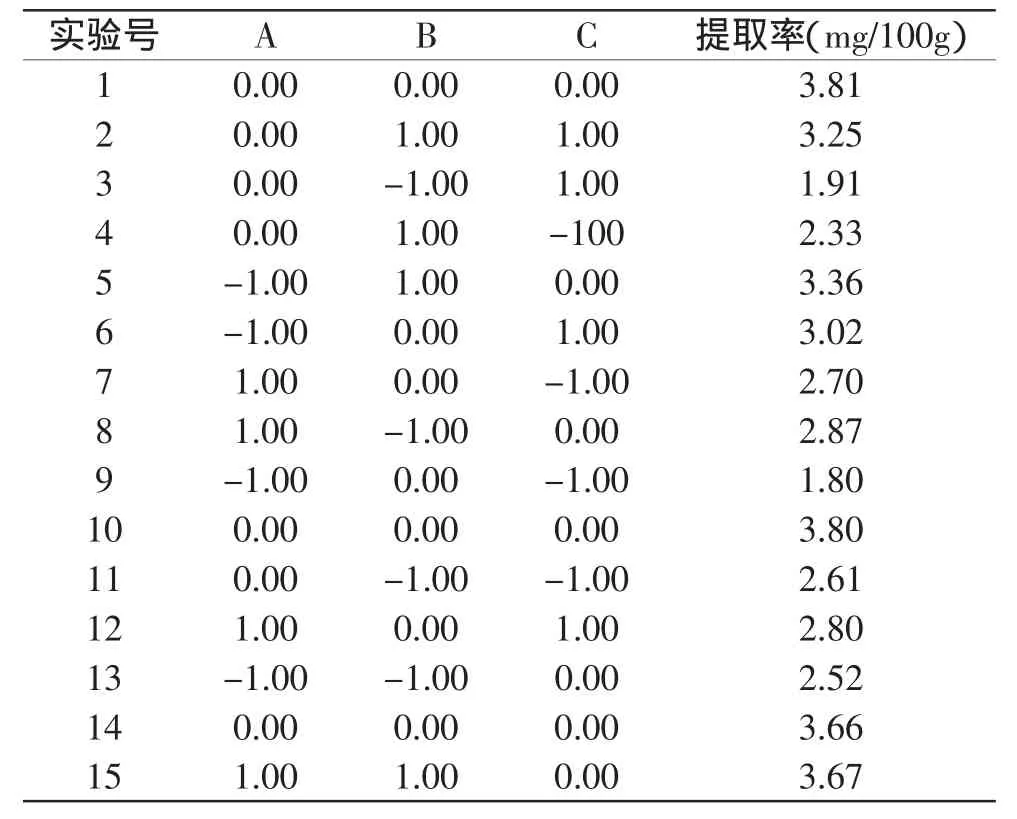
表2 响应面分析结果
2.3.2 模型的建立与显著性检验 由于各因素对槲皮素提取率的影响不是简单的线性关系,为了更明确各因素对响应值的影响,采用SAS统计软件V9.0 RSREG程序,对表3中槲皮素提取率实验数据进行多元回归拟合,获得回归方程:

当“Prob<F”值小于0.05级表示该指标显著,从表3的分析结果来看,整体模型的“Prob>F”值略大于0.001,表明该二次方程模型比较显著。回归方差分析显著性检验表明,该模型回归显著,并且失拟项不显著,说明方程对实验拟合较好[13]。各因素及因素的一次项对响应值的影响显著程度为B>BC>AC>C>A>AB。

表3 实验结果方差分析表
2.3.3 因素间的交互影响 借助Design Expert软件依回归方程式来绘制响应面图,见图8~图10。
2.3.3.1 提取时间与超声功率的交互作用 由图8可知,当乙醇浓度固定在60%,在一定的提取时间条件下,随超声功率的增加,槲皮素提取率增加,且刚开始的时间槲皮素提取率增加速度快,当达到一定时间后,提取率趋于平稳,这与单因素实验的结果相符。当在一定功率条件下,随着提取时间的增长,槲皮素提取率迅速增加,影响显著;当超过一定功率条件时,随着提取时间的增长,槲皮素提取率未见有上升的趋势。由此可见,槲皮素提取的超声功率和提取时间应该有一定限制范围。由等高线图接近圆形可知,提取时间与提取功率的交互项作用不显著。

图8 超声功率与提取时间对槲皮素得率影响的响应面图
2.3.3.2 提取时间与乙醇浓度的交互作用 由图9可见,固定超声功率为224W,在一定的提取时间条件下,随乙醇浓度的提高,槲皮素提取率迅速增加,影响显著;在中心点后,槲皮素的提取率随着乙醇浓度提高,出现下降趋势。在一定的乙醇浓度下,随提取时间的增加,槲皮素提取率增加,但长时间提取对槲皮素提取率影响不明显。由等高线为椭圆形可知,两者的交互作用较显著。

图9 乙醇浓度与提取时间对槲皮素得率影响的响应面图
2.3.3.3 超声功率与乙醇浓度的交互作用 由图10可见,固定提取时间30min,在一定的超声功率条件下,在低乙醇浓度时,随着乙醇浓度的增加,槲皮素提取率增加;且大功率条件下,槲皮素提取率随浓度变化速度加快。在乙醇浓度小于60%时槲皮素提取率增加较明显,以后反而下降,此结果与前面的结论相一致。在一定的乙醇浓度条件下,随着提取功率的增大,槲皮素提取率先升高后降低;在中心点附近,超声功率对提取率的影响最为显著。由等高线图为椭圆形可知,两者的交互作用显著。
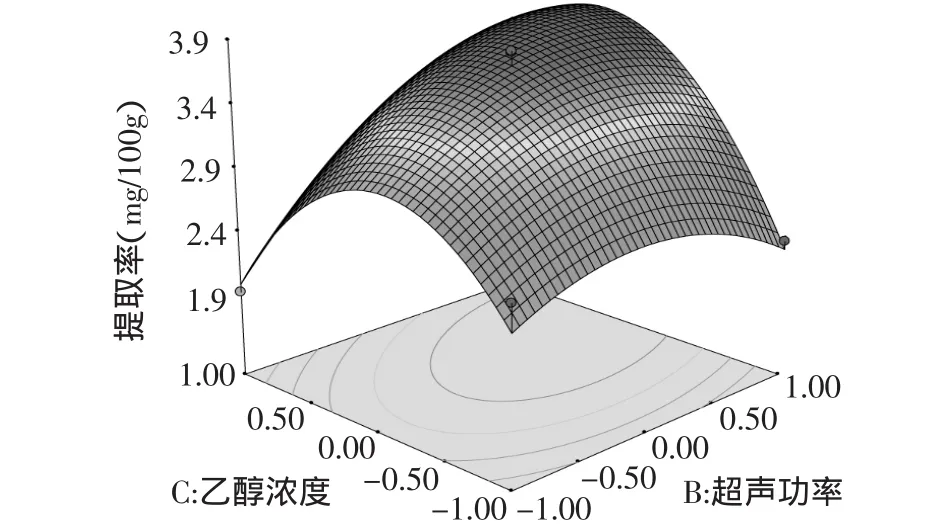
图10 乙醇浓度与超声功率对槲皮素得率影响的响应面图
2.3.4 提取工艺条件的确定 由响应面的分析可知,回归模型存在最大值,槲皮素提取率的最大值为3.886%。最高点位于实验设计范围内。其A,B,C最佳点位于0.350,0.547,0.116,即理论最佳提取工艺为提取时间33.5min,提取温度为60℃,提取功率为254.6W,乙醇浓度为62.32%,理论槲皮素提取率为3.88mg/100g,与模型预测值基本相符。
2.4 验证实验
为检验RSM法的可靠性,采用上述最优提取条件进行槲皮素的提取实验,考虑到实际操作便利,槲皮素最佳提取条件为提取时间34min,提取温度为60℃,提取功率为255W,乙醇浓度为62%,在此条件下进行3次平行实验,槲皮素提取率分别为3.86、3.90、3.70mg/100g,与理论预测值基本相符,这说明回归方程能够真实地反映筛选因素对杨梅渣中槲皮素提取率的影响,对于槲皮素提取工艺的研究具有指导意义。
2.5 超声辅助提取与传统水提法的比较
采用超声波辅助提取法和传统水提法对杨梅渣槲皮素进行提取,按照各自的工艺流程比较槲皮素提取率,结果见表4。
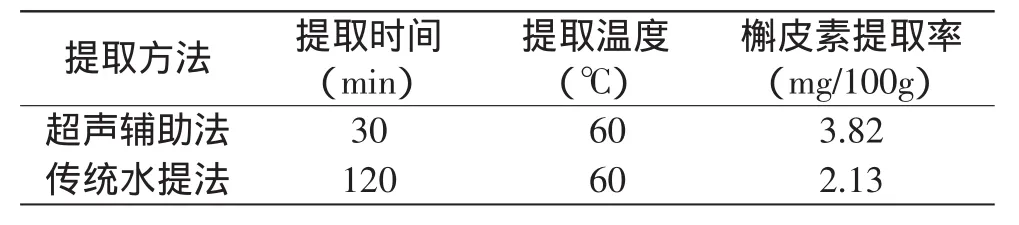
表4 超声辅助提取与传统水提法的效果比较
由表4可见,超声辅助提取法与传统水提法相比,提取时间缩短了四分之三,槲皮素产率提高了近一倍,这是因为超声促进了细胞壁的破碎以及槲皮素物质的溶出和扩散,从而使提取时间大大缩短,提取率明显提高。
3 结论
3.1 单因素实验表明,超声辅助提取杨梅渣中槲皮素的适宜条件为:提取时间30min,提取功率224W,提取浓度60%,提取温度为60℃。
3.2 应用SAS统计软件V9.0 RSREG程序回归分析确定各因素对槲皮素提取率的影响;通过岭脊法分析得到超声辅助提取的最佳工艺条件为:提取时间33.5min,提取功率为254.6W,乙醇浓度为62.32%,槲皮素的提取率为3.82mg/100g,与理论值基本相符。
3.3 超声辅助法提取槲皮素与传统水提法相比,具有省时、高效、节能等优点。
[1]胡静丽.杨梅叶提取物抑菌作用的研究[D].浙江:浙江大学硕士学位论文,2002:6-13.
[2]Lu Y R,Foo L Y.Identification and quantification of major polyphenols in apple pomace [J].Food Chemistry,1997,59(2): 187-194.
[3]Bao J,Cai Y,Sun M,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry (Myrica rubra)extracts and their color properties and stability[J].J Agric Food Chem,2005,53(6):2327-2332.
[4]Warren C A,Paulhill K J,Davidson L A,et al.Quercetin may suppressrataberrantcryptfociformation by suppressing inflammatory mediators that influence proliferation and apoptosis [J].Journal of Nutrition,2009,39(1):101-105.
[5]Mikstacka R,Rimando AM,Ignatowicz E.Antioxidant effect of trans-resveratrol,pterostilbene,quercetin and their combinations in human erythrocytes in vitro[J].Plant Foods Hum Nutr,2010,65(1):57-63.
[6]Boots AW,Haenen GR,Bast A.Health effects of quercetin: from antioxidant to nutraceutical[J].European Journal of Pharmacology,2008,585(2-3):325-337.
[7]王宁,李远志.超声波法提取柿叶总黄酮的工艺研究[J].现代食品科技,2008,24(7):687-690.
[8]刘迪,陈雪峰.超声波辅助萃取法提取桃叶中总黄酮的工艺研究[J].现代食品科技,2008,22(2):141-149.
[9]Monika O.Separation of quercetin,sexangularetin,kaempferol and isorhamnetin forsimultaneousHPLC determination of flavonoid aglycones in inflorescences,leaves and fruits of three Sorbus species[J].Journal of Pharmaceutical and Biomedical Analysis,2008,48:629-635.
[10]高蓉,陈练洪,李稳宏,等.超声法提取化香树果序中黄酮类化合物工艺[J].化学工程,2007,35(8):65-73.
[11]许晖,孙兰萍,李善菊,等.超声波辅助提取亚麻籽油的工艺条件优化[J].2009,24(7):64-69.
[12]黄运红,高兴强,黎伟伟,等.超声波提取脐橙皮黄酮类化合物的工艺研究[J].食品科学,2009,30(16):102-105.
[13]黄燕,吴平.SAS统计分析及应用[M].北京:机械工业出版社,2006:202-252.
Optimization of quercetin extraction technology from Red bayberry (Myrica rubra Sieb.et Zucc)pomace using response surface methodology
HAN Qiang1,CHEN Wei1,YE Li-bin1,LI Jian-rong1,2,*
(1.College of Food Science and Biotechnology,Zhejiang Gongshang University,Hangzhou 310035,China;2.Bohai University,Jinzhou 121013,China)
Extraction technology of quercetin from Red bayberry (Myrica rubra Sieb.et Zucc)pomace was investigated.Single factor experiments were first performed using ultrasonic-assisted extraction(UAE),then Box-Benhnken design (3 factors and 3 levels)combined with regression analysis were applied.Finally,response surface and contour were graphed with the extraction yield of quercetin as the response value. According to the above design and results,the optimal condition was obtained as follows:the extracting time was 33.5min,the extracting power was 254.6W,the ethanol concentration was 62.32%,and solid-liquid ratio 1∶20. Under this optimal condition,the yield of quercetin was 3.82mg/100g,which was almost in accordance with the predicted data.
ultrasonic-assisted extraction;Red Bayberry pomace;quercetin;response surface methodology
TS255.1
B
1002-0306(2011)10-0316-05
杨梅(Myrica rubra Sieb.et Zucc)属于杨梅科杨梅属,是原产于中国的亚热带果树之一,为多年生常绿小乔木,喜温暖湿润气候,耐阴,不耐强烈日照。中国是杨梅的主产区,主要分布在北纬18~33°之间[1]。现代医学研究表明,杨梅药用价值较高[2],其果实、仁、叶、皮均可入药,有生津止渴、和胃消食、益肾利尿及消暑等诸多功效。杨梅渣是杨梅果实在榨取汁液后留下的残渣,属于工业加工的下脚料。鉴于其高糖分含量,直接废弃对环境保护会产生负面影响,研究杨梅渣的深加工,具有双重意义。有关杨梅化学成分的研究已取得了很大进展,研究表明杨梅果实中含有葡萄糖、果糖、维生素﹑柠檬酸、氨基酸、木脂素、花青素、槲皮素等多种生物活性成分[3]。槲皮素(Quercetin)属黄酮类化合物[4],广泛存在于杨梅、苹果、柑橘等植物的花、叶、果实中,具有降血压、降血脂、调节机体免疫,清除自由基等多种生理功能[5-6]。近年来,应用超声技术提取植物黄酮的研究已有报道,研究表明该技术具有能耗低、效率高、不破坏有效成分的特点[7-8]。为了更好地开发利用杨梅资源,本文以杨梅加工的副产物杨梅渣为原料,基于单因素和响应面分析法,采用超声波辅助提取技术,优化活性成分槲皮素的提取工艺,以期为槲皮素的提取制备以及杨梅资源的充分利用提供理论参考。
2010-09-16 *通讯联系人
韩强(1985-),男,硕士研究生。
宁波市农业攻关国际科技合作项目(2008C10042);“十一五”国家科技支撑计划重点项目(2006BAD27B03)。
