低高级醇啤酒酵母的选育及中试发酵
2011-11-02蔺善喜凌宏志平文祥
赵 辉,蔺善喜,王 葳,凌宏志,平文祥,*
(1.黑龙江大学生命科学学院,黑龙江哈尔滨150080;2.农业微生物技术教育部工程研究中心,黑龙江哈尔滨150500)
低高级醇啤酒酵母的选育及中试发酵
赵 辉1,2,蔺善喜1,2,王 葳1,2,凌宏志1,2,平文祥1,2,*
(1.黑龙江大学生命科学学院,黑龙江哈尔滨150080;2.农业微生物技术教育部工程研究中心,黑龙江哈尔滨150500)
利用紫外和硫酸二乙酯对出发酵母菌株进行复合诱变,三重筛选获得高级醇产量少的菌株。同时采用响应面分析方法对发酵条件进行优化,得到最优发酵参数。中试发酵得到总高级醇含量70.67mg/L,感官和其它理化指标优良的啤酒。
高级醇,啤酒酵母,诱变,响应面法,中试发酵
1 材料与方法
1.1 材料与仪器
大麦芽 哈尔滨龙垦麦芽有限公司;菌种Saccharomgces Carlsbergensis HF2.3,黑龙江大学发酵工程实验室保存菌种;正丙醇、甲醇、乙醛、异丁醇、异戊醇、乙酸丁酯 色谱纯;其余药品 均为分析纯;MM(麦芽汁培养基) 料水比1∶3.5,升温浸出糖化法制备12°P麦芽汁;CM(酵母完全培养基,g·L-1)蛋白胨20,酵母膏10,葡萄糖20,pH 6.0;LM(乳酸培养基,g·L-1) 乳酸钙40,酵母膏0.2,琼脂30,pH 6.0;MCM(麦芽汁碳酸钙培养基) 在MM固体培养基中加入干热灭菌后的碳酸钙(1.5g·L-1);TTC(TTC上层培养基,g·L-1) TTC 0.5,乳酸5,琼脂15,pH 6.0。
DNP-9082电热恒温培养箱 上海精宏实验设备有限公司;UV755B紫外分光光度计 上海精密科学仪器有限公司;HZS-H水浴振荡器 哈尔滨东联电子技术有限公司;LD24-08医用离心机 北京医用离心机厂;GC7890气相色谱仪 上海天美科学仪器有限公司;GUQS-15A全自动式5L发酵罐 镇江东方生物工程设备技术公司;SBA-40C型生物传感分析仪 山东省科学院生物研究所;JY92-ⅡDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;1000L不锈钢全自动锥形微型啤酒设备 哈尔滨汉德酿造设备有限责任公司。
1.2 实验方法
1.2.1 实验条件
1.2.1.1 高级醇的检测 气相色谱法分析条件:以乙酸丁酯为内标,氢火焰离子检测器,PEG20M(聚乙二醇)毛细管色谱柱Ф0.25mm×(25~30)m,程序升温条件70℃(2min)至100℃(5℃/min),进样器温度180℃,检测器温度180℃,载气流速(高纯氮)0.5~1.0mL/ min,分流比20∶1~100∶1,进样量0.3μL。
1.2.1.2 其它理化成分分析 电位滴定法测定总酸含量;皂化法测定总酯含量;碘量法测定总醛含量;邻苯二胺法测定双乙酰含量;密度瓶法测定外观发酵度及酒精度。
1.2.2 菌株复合诱变及筛选 取15mL酵母菌悬液于无菌培养皿中,用事先预热20min的15W紫外灯进行诱变处理,照射距离25cm。采用不同的照射处理时间(0、10、20、30、40、50、60、90、120s),用生理盐水10倍系列梯度稀释并取100μL进行平板涂布计数,做酵母致死曲线。选择致死率约80%~90%处理时间的诱变菌进行复合诱变。
用磷酸缓冲液制备的0.1%、0.2%、0.3%、0.4%、0.5%、1%的DES各50mL,分别加入5mL生理盐水洗涤实验菌,处理20min后,迅速加入5mL 25%的硫代硫酸钠脱毒5~10min,用生理盐水10倍系列梯度稀释并取100μL进行平板涂布计数,做酵母致死曲线,选择致死率约80%~90%处理时间的诱变菌进行筛选。
初筛:将诱变处理过的酵母细胞均匀涂布在LM平板上,置黑暗处30℃培养3~5d。挑选生长菌落较大、菌层较厚、表面光滑和边缘整齐的菌落约40~50株转接于MCM平板上,于30℃培养3d,菌落影印到LM平板上,30℃培养3d。菌落长成后加入TTC暗培养2~3h,挑选在MCM上生长较好、中央隆起突出、溶钙圈适中、TTC上红色较深的菌株[15]。
复筛:选取初筛菌株用MM 200mL在室温下培养5~6d后进行高级醇含量检测,选择高级醇含量低的突变株。
1.2.3 诱变后菌株性能的研究
1.2.3.1 稳定性实验 将筛选出的优良菌株连续传代5次,进行发酵实验来检测突变菌的优良特性,考察其遗传稳定性。
1.2.3.2 诱变后菌株发酵成分分析 将诱变后的突变株进行啤酒发酵实验,进行包括高级醇等成分在内的理化分析,鉴定诱变后菌株的特性。
1.2.3.3 乳酸脱氢酶活性的研究 将菌悬液放在冰水浴中,200W连续超声破碎15min(破碎2s,间隔1s),破碎后溶液离心,得到上清液即为酶液,分光光度法测定酶活力。
1.2.3.4 乳酸产量的研究 利用SBA-40C型生物传感分析仪,发酵液经离心除杂后,调节pH在6~8之间,用定量进样针准确吸取25μL,并注入反应盒内。含有样品的底物在样品室内迅速混合均匀,被测定的对象透过酶膜圈的外层与固定化酶层接触并反应,反应放出的水再透过酶膜的内层与白金-银电极接触,并产生电流信号,该电流信号与底物浓度成线性比例关系,经微机处理的信号,可直接显示打印出来。
1.2.4 响应面法优化啤酒发酵条件 以Plackett-Burman实验确定发酵温度、氨基酸含量和接种量是影响啤酒发酵高级醇生成量的主要因素,并根据最陡爬坡实验筛确定中心组合设计的因素和水平,并进行响应面分析(利用SAS软件进行实验设计和数据处理),确定发酵最优条件,中心组合设计实验因素及水平见表1。

表1 中心组合设计实验因素及水平
1.2.5 中试啤酒发酵工艺流程 利用具有全夹套制冷,C.I.P自动清洗系统的1000L不锈钢锥体啤酒发酵罐,进行啤酒中试发酵,并进行理化指标分析,工艺流程见图1。

图1 中试啤酒发酵流程图
2 结果与讨论
2.1 诱变后菌株稳定性及发酵性能研究

图2 乳酸脱氢酶活力与高级醇变化趋势

图3 发酵过程中乳酸变化趋势
复合诱变后得到的啤酒酵母命名为HF2.32,将HF2.32连续传五代后,发酵实验表明传代前后菌株的发酵性能无明显差异,表明HF2.32具有遗传稳定性。
本实验中,通过诱变提高菌株乳酸脱氢酶的活性来降低高级醇的含量,要筛选的目标菌株乳酸脱氢酶活性显著增加,丙酮酸向乳酸转变,使乳酸积累增加,消耗丙酮酸和还原性辅酶,造成高级醇的合成量下降。由于乳酸合成反应的可逆性,主酵期后乳酸脱氢酶催化多余的乳酸逆反应形成丙酮酸,进一步合成酒精和CO2,而高级醇的合成反应是不可逆的,且主要在主酵期形成,其含量仍然保持低水平。由图2可知,经过诱变选育的突变菌株HF2.32高级醇产量比原始菌株降低了26.2%,乳酸脱氢酶活力比原始菌株提高了6.8个活力单位,由图3可知,诱变菌株的乳酸产量开始比出发菌株要高0.8mg/100mL,同时发酵实验表明HF2.3包括双乙酰在内的其他理化指标基本保持不变,证明复合诱变成功。
2.2 响应面法优化啤酒发酵条件
响应面分析结果如表2和图4所示,分析得到回归方程如下:

图4 y=f(x1,x2,x3)响应面图
由方差分析可知,方程二次项和交互项影响显著,一次项影响一般,说明响应值的变化相对复杂,各个具体实验因子对响应值的影响不是简单的线性关系。回归方程的决定系数R2=0.9423,且F检验极显著,说明对实验拟合情况良好。由响应面结果得到啤酒发酵最优条件为:发酵温度10.91℃,氨基酸含量172.83mg/L,接种后细胞浓度5.66×106个/mL,理论高级醇产量为72.23mg/L。

表2 优化实验结果

表3 各因素显著性比较结果
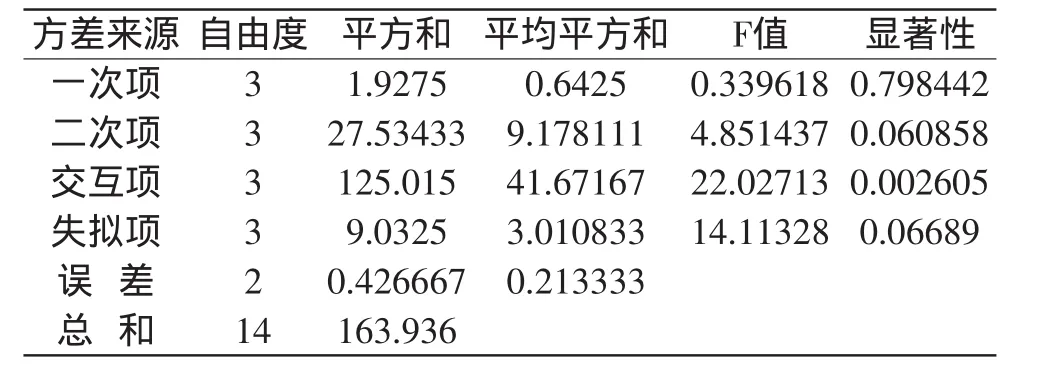
表4 回归方程各项的方差分析表
2.3 中试啤酒发酵分析
中试发酵啤酒高级醇含量如表5所示,菌株HF2.32总高级醇含量和正丙醇、异丁醇、正丁醇、异戊醇的含量均明显低于出发菌株,同时外观发酵度74%、酒精度4%、双乙酰0.071mg/L、总酯29.1mg/L、总醛18.51mg/L、总酸3.15mg/L,各项指标均达到国家标准。酒液淡黄、清澈透明、富有光泽,酒质柔和、浓香醇厚、有明显酒花香和麦芽香,且具有啤酒特有的爽口苦味和杀口力。

表5 中试发酵啤酒高级醇含量
3 结论
以实验室保藏的卡尔酵母为出发菌株,对其进行紫外-DES诱变处理,通过诱变提高菌株乳酸脱氢酶的活性来降低高级醇的含量,经乳酸钙培养基、麦芽汁碳酸钙培养基和TTC-上层培养基三重筛选,得到总高级醇产量降低26.2%的菌株HF2.32。响应面优化该菌株低产高级醇的发酵条件为:接种后细胞浓度5.66×106个/mL、氨基酸含量172.83mg/L、发酵温度10.91℃。利用选育的酵母和最优化的发酵条件,在1000L不锈钢全自动锥形发酵罐中进行啤酒中试发酵,得到总高级醇含量70.67mg/L,正丙醇、异丁醇、正丁醇、异戊醇含量皆较低,感官和其它理化指标优良的啤酒发酵液。
[1]李红捷,王伟,李颖.啤酒风味物质的影响和控制[J].专题论述,2009,139(7):24-26.
[2]顾国贤.新世纪中国啤酒工业发展展望[J].酿酒科技,2002,112(4):28-30.
[3]王传荣.控制啤酒中双乙酰含量措施的探讨与研究[J].食品工业科技,2008,29(10):275-278.
[4]周世水.中国啤酒发展的预测模型及分析[J].酿酒,2005(1):21-24.
[5]崔云前,周静.啤酒中高级醇的影响因素及降低其含量的措施[J].酿酒科技,2006(1):32-36.
[6]余晓红.啤酒酵母代谢副产物高级醇的影响因素研究进展[J].酿酒科技,2006(10):14-16.
[7]付有利,吕微,刘红伟.高级醇含量对啤酒风味影响的研究[J].河南科学,2007,25(1):54-56.
[8]McKarnsSC,HanschC,CaldwellWS,etal.Correlationbetween hydrophobicity of shortchain aliphhatic alcohols and their ability to alter plasma menbrane integrity[J].Appl Toxicol,1997,36:62-70.
[9]Harper C.The neurotoxicity of alcohol[J].Hum Exp Toxicol,2007,26:51-257.
[10]蔡车国,张秀丽,刘月英,等.优良啤酒酵母原生质体融合株GR5的构建及其发酵特性[J].工业微生物,2006,36(1):34-37.
[11]Nobuhiko Mukai,Chiharu Nishimori,Ikuko Wilson Fujishige, et al.Beer Brewing Using a Fusant between a Sake Yeast and a Brewer’s Yeast[J].Journal of Bioscience and Bioengineering,2001,91(5):482-486.
[12]王鹏银,郝欣,郭学武,等.离子注入诱变选育低产高级醇酿酒酵母菌株[J].酿酒科技,2008(2):17-26.
[13]M Ortega-Heras,M L Gonza lez-SanJose,S Beltran.Aroma composition of wine studied by different extraction methods[J]. Analytica Chimica Acta,2002,458:85-93.
[14]方维明,汪志君,高庆,等.低含量高级醇啤酒酵母菌株的选育[J].南京农业大学学报,2005,28(1):61-65.
[15]由媛,王芬,戴玉聪,等.激光诱变株啤酒酿造酵母JY2-2的选育及其中试[J].厦门大学学报:自然科学版,2006,45(5):713-716.
[16]潘明,周永进.微波技术选育啤酒酵母菌种的探讨[J].厦门大学学报:自然科学版,2003,42(4):508-511.
[17]李豪,车振明.微波诱变微生物育种的研究[J].山西食品工业,2005(2):5-7.
[18]Hiroyuki Yoshimoto, Tomoyuki Fukushige, Toshihiko Yonezawa,et al.Pyruvate decarboxylase encoded by the PDC1 gene contributes,at least partially,to the decarboxylation of αketoisocaproate for isoamyl alcohol formation in Saccharomyces cerevisiae[J].Journal of Bioscience and Bioengineering,2001,92(1):83-85.
[19]A Eden L,Van Nedervelde,M Drukker.Involvement of branched-chain amino acid aminotransferases in the production of fusel alcohols during fermentation in yeast[J].Appl Microbiol Biotechnol,2001,55(3):296-300.
[20]袁静.酵母的BAP2基因—控制高级醇的产生[J].啤酒科技,2002(4):55-60.
[21]Barbara Bendoni,Duccio Cavalieri,Enrico Casalone,et al. Trifluoroleucine resistance as a dominant molecular marker in transformation of strains of Saccharomyces cerevisiae isolated from wine[J].FEMS Microbiology Letters,1999,180(2):229-233.
[22]Shigetoshi Yoshikawa,Isamu Oguri,Kimio Kondo,et al. Enhanced formation of isoamyl alcohol in Zygosaccharomyces rouxiiduetoeliminationoffeedbackinhibitionofα-isopropylmalate synthase[J].FEMS Microbiology Letters,1995,127(1):139-143.
Screening of Saccharomgces carlsbergensis with lower higher alcohols and pilot fermentation
ZHAO Hui1,2,LIN Shan-xi1,2,WANG Wei1,2,LING Hong-zhi1,2,PING Wen-xiang1,2,*
(1.College of Life Science,Heilongjiang University,Harbin 150080,China;2.Engineering Research Center of Agricultural Microbiology Technology,Ministry of Education,Harbin 150500,China)
The good strain of lower higher alcohols was got by compound mutation of UV-DES with triplication screening.The fermentation conditions were optimized by using response surface analytical method and the optimization fermentation parameters were got.The beer with lower higher alcohols and good sense and physical and chemical indicators were got by pilot beer fermentation.
higher alcohols;Saccharomgces carlsbergensis;mutagenesis;response surface methodology;pilot fermentation
TS261.1+1
B
1002-0306(2011)10-0242-04
对啤酒风味影响较大的高级醇为正丙醇、异丁醇、异戊醇和β-苯乙醇[1-2],高级醇能赋予啤酒丰满的香气和口味[3],并增加酒体的协调性,但过量存在也是啤酒异杂味的主要来源[4-7],并能引起局部肝、脑损伤以及认知障碍[8-9],啤酒中的高级醇对人体的伤害远大于酒精,所以降低啤酒中高级醇的含量,对人们的身体健康至关重要。近年来通过酵母育种降低高级醇含量的研究主要包括:双亲灭活的原生质体融合[10-12]、离子注入诱变[12-13]、紫外诱变[14]、激光诱变[15]、微波诱变[16-17]和基因工程技术改造[18-22]等。从实验室保藏的卡尔酵母出发,利用紫外线和硫酸二乙酯对出发菌株进行复合诱变,根据酵母菌高级醇的合成代谢与乳酸代谢途径之间的关系,采用乳酸培养基、碳酸钙培养基和TTC上层培养基三重筛选获得优良菌株。同时采用响应面分析方法对发酵条件进行优化,得到最优发酵参数。利用具有全夹套制冷,C.I.P自动清洗系统的1000L不锈钢锥形发酵罐,进行中试啤酒发酵。
2011-06-22 *通讯联系人
赵辉(1971-),男,博士,在站博士后,副教授,研究方向:食品生物技术。
哈尔滨市科技局科技创新人才专项基金(2011RFQXN056);黑龙江省教育厅科学技术研究项目(12511409)。
