甲壳素固定化β-葡萄糖醛酸苷酶的研究
2011-11-02李开雄段海燕
孙 倩,李开雄,李 春,段海燕,叶 海,曹 红,*
(1.石河子大学食品学院,新疆石河子832000; 2.石河子大学化学化工学院/化工绿色过程新疆兵团重点实验室,新疆石河子832000)
甲壳素固定化β-葡萄糖醛酸苷酶的研究
孙 倩1,李开雄1,李 春2,段海燕2,叶 海2,曹 红2,*
(1.石河子大学食品学院,新疆石河子832000; 2.石河子大学化学化工学院/化工绿色过程新疆兵团重点实验室,新疆石河子832000)
以甲壳素为载体、戊二醛为交联剂,固定β-葡萄糖醛酸苷酶,对β-葡萄糖醛酸苷酶的固定化条件进行了研究,并通过正交实验确定了酶固定的最佳条件:戊二醛浓度0.7%,交联时间4h,吸附时间为9h,反应温度40℃,此时酶活力回收率可达67.32%。
β-葡萄糖醛酸苷酶,甲壳素,固定化
1 材料与方法
1.1 材料与仪器
菌种来源 课题组前期从土壤中筛选得到的Penicillium sp.Li-3;β-葡萄糖醛酸苷酶 实验室自制;其他试剂和药品 均为国产分析纯;基础产酶培养基 每升水中含甘草酸单铵盐2g,NaNO33g,K2HPO41g,MgSO4·7H2O 0.5g,KCl 0.5g,FeSO4· 7H2O 0.01g。
紫外可见分光光度计 澳大利亚GBC公司。
1.2 实验方法
1.2.1 β-葡萄糖醛酸苷酶的制备 将真菌Penicillium sp.Li-3接种到80mL的基础产酶培养基中,然后于30℃恒温摇床(170r/min)培养120h后,发酵终点的菌体用pH 4.5的醋酸-醋酸铵缓冲液洗涤、重悬后定容至50mL,于冰浴条件下超声破碎细胞(超声破碎条件:变幅杆末端直径φ10,工作时间2s,间隔时间4s,全程净超声时间20min,输出功率400W)。离心去除沉淀,上清液即为粗酶液。
1.2.2 β-葡萄糖醛酸苷酶的固定 称取0.1g的甲壳素,加入体积比为0.7%的戊二醛,交联4h后彻底水洗至洗脱液中没有戊二醛,然后加入pH6.0、总酶活为2098U的β-葡萄糖醛酸苷酶于冰浴中搅拌1h后,放入冰箱中4℃吸附过夜。次日用蒸馏水彻底水洗,过滤干燥,即可得到固定化 β-葡萄糖醛酸苷酶[11]。
1.2.3 标准曲线的建立 精密称取经105℃干燥3h的甘草酸单铵盐对照品30.5mg,用50%乙醇定容于50 mL容量瓶中,使其终浓度为0.61mg·mL-1,备用。精密吸取甘草酸标准对照品溶液0.2、0.4、0.6、0.8、1.0mL,分别置于10mL容量瓶中,分别加入蒸馏水至刻度、摇匀、定容。以50%乙醇作空白对照,在252nm波长处测定各吸光度值,绘制标准曲线,以吸光度对溶液总甘草酸的含量进行回归分析[12]。
1.2.4 游离酶和固定化酶活力的测定
1.2.4.1 游离酶活力测定 测定方法如下:200μL粗酶液加入到800μL含有甘草酸浓度2mg·mL-1、pH为4.5的醋酸-醋酸铵缓冲溶液中,40℃条件下反应1h后,沸水浴中使酶失活,取0.25mL反应液用50%乙醇定容至10mL,摇匀,在252nm下测定吸光度。空白对照只要将200μL粗酶液用相同体积煮沸失活的酶来代替,其余步骤相同。甘草酸的含量可根据甘草酸的标准曲线求得[12]。用空白对照中的甘草酸含量减去反应液中甘草酸量便可得消耗的甘草酸量。
β-葡萄糖醛酸苷酶的活力(U):在上述条件下,1mL酶液每小时分解消耗1μg甘草酸的量定义为一个酶活力单位。
1.2.4.2 固定化酶活力测定 固定化酶活力的测定将200μL粗酶液用200μL蒸馏水和一定量的固定化酶来代替,其余步骤相同。
固定化酶的相对酶活力,指在同组实验中以活性最高的为100,与其余的固定化酶活力之比,以百分数表示。
酶活力回收率(%)=(固定化酶活力/投入的游离酶活力)×100%
2 结果与讨论
2.1 标准曲线
通过测定的吸光度值,以吸光度对溶液中甘草酸浓度进行回归分析。经线性回归,得甘草酸对照品浓度Y(mg·mL-1)与吸光度(A)之间的线性回归方程:Y=0.0764X-0.0003,R2=0.9999。结果表明甘草酸在0.0122~0.0610mg·mL-1浓度范围内与吸光度呈良好的线性关系。标准曲线如图1所示。
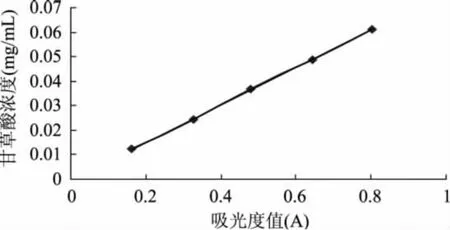
图1 甘草酸对照品标准曲线
2.2 各种因素对固定化β-葡萄糖醛酸苷酶的影响
2.2.1 戊二醛浓度对酶活力的影响 称取0.1g的甲壳素,分别加入浓度0.3%~0.9%的戊二醛溶液,后续步骤见1.2.2。由图2可知,当戊二醛浓度为0.7%时,固定化酶的相对酶活力最高。戊二醛浓度较高或较低时酶活均比较低。这是因为戊二醛既是交联剂,又是酶的变性剂。过低浓度的戊二醛使得酶交联到载体上的程度不够,所以酶的相对酶活力不高。但过高浓度的戊二醛会使载体交联度过大,形成的网络结构太紧密而限制了底物和反应产物的扩散,使得酶活性降低;同时,过高浓度的戊二醛会与酶蛋白产生过度交联,导致活性中心的改变而使酶失活。因此,戊二醛浓度以0.70%最佳。

图2 戊二醛浓度对固定化酶相对酶活力的影响
2.2.2 戊二醛与甲壳素交联时间对酶活力的影响由图3可知,当戊二醛与甲壳素的交联时间为4h时,固定化酶的相对酶活力达到最大值。这主要是因为交联的时间越长,交联的戊二醛量越多,最后固定化的酶量也越多。因此,交联时间以4h为最佳。

图3 交联时间对固定化酶相对酶活力的影响
2.2.3 酶吸附时间对酶活力的影响 分别选择不同的吸附时间3~10h,间隔1h测定固定化酶活力,从而确定不同的吸附时间对固定化酶相对酶活力的影响。由图4可知,虽然固定化酶活力在吸附5h时酶活力较高,但随着时间的推移,酶活力又开始下降,也就是说在这个时间段内酶蛋白与载体吸附并没有达到稳定,而在8h后载体固化能力才达到稳定,因此,选取吸附时间为8h。

图4 吸附时间对固定化酶相对酶活力的影响
2.2.4 固定化酶与底物反应温度对酶活力的影响分别选择不同的反应温度使固定化酶与底物反应,结果发现,当温度为40℃时,固定化酶的相对酶活力最高,而随着温度的逐渐升高,相对酶活力急剧下降。这是因为温度过高导致大部分酶活力丧失。因此,反应温度以40℃为最佳。
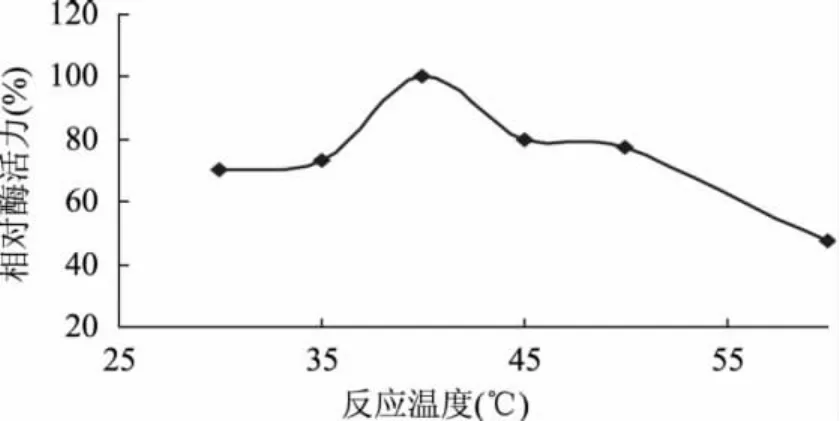
图5 反应温度对固定化酶相对酶活力的影响
2.2.5 β-葡萄糖醛酸苷酶的固定化 根据单因素实验所得出的最佳结果,称取0.1g的甲壳素,加入体积比为0.7%的戊二醛,交联4h后彻底水洗至洗脱液中没有戊二醛,然后加入pH6.0、总酶活为2098U的β-葡萄糖醛酸苷酶于冰浴中搅拌1h后,放入冰箱中4℃吸附8h,然后用蒸馏水彻底水洗,过滤干燥,得到固定化酶的酶活回收率为59.86%。
2.3 固定化β-葡萄糖醛酸苷酶的正交实验
通过对酶固定化条件的单因素实验,得出影响酶固定化的4个主要因素:戊二醛浓度、吸附时间、交联时间、反应温度(加酶量为2098U)。分别选取三个水平进行L9(34)正交实验。结果见表1和表2。

表1 正交实验因素和水平表
由表2可看出,A、C因素显著,B和D均为不显著因素,各因素对实验指标影响的主次顺序为:C>A>D>B。由表2还可得出,最佳的工艺条件组合为A2B3C2D2,即戊二醛浓度为0.70%,交联时间为4h,反应温度40℃,吸附时间9h。在此条件下做验证实验测得固定化酶的酶活回收率可达67.32%,证明了实验的可靠性。
3 结论
本实验以甲壳素为载体,通过单因素实验发现,固定化β-葡萄糖醛酸苷酶的活力受到戊二醛浓度、交联时间、反应温度以及吸附时间的影响,后又通过正交实验得出最佳固定化条件为:戊二醛浓度为0.7%,交联时间为4h,反应温度40℃,吸附时间9h,此时固定化酶的酶活回收率可达67.32%。

表2 正交实验设计及结果
本实验还发现,以甲壳素为载体,固定化β-葡萄糖醛酸苷酶,过程简单,条件温和,酶活回收率较高,并且载体甲壳素来源广泛,价格低廉,安全无毒,为固定化β-葡萄糖醛酸苷酶生物转化甘草酸合成GAMG的新工艺研究奠定了良好的基础,具有一定的实用意义。
[1]Baltina LA.Chemical modification of glycyrrhizic Acid as a route to new bioactive compounds for medicine[J].Curr Med Chem,2003,10(2):155-171.
[2]王裕生,邓文龙,薛春生.中药药理与应用:第二版[M].北京:人民卫生出版社,1998.
[3]凌关庭.食品添加剂手册(第三版)[M],北京:化学工业出版社,2003.
[4]冯世江,王小艳,李春.β-D-单葡糖糖醛酸基甘草次酸的生物合成与菌株筛选[C].南京:第一届化学工程与生物化工年会论文集,2004,11.
[5]Wang Xiao-yan,Li Chun,Feng Shi-jiang,et al.Identification and characterization of Fungi producing with catalysis diversify of Glycyrrhizin[J].Bioec Bioeco,2007,6.
[6]王小艳,李春,文先君,等.真菌三种β-D-glucuronidase催化甘草酸多样性的酶学性质的研究[J].生物加工过程,2007,5(2):17-22.
[7]王小艳,陈国强,李春,等.β-D-葡萄糖醛酸苷酶的基因克隆及在毕赤酵母中的表达[C].杭州:全国第四届化学工程与生物化工年会论文集,2007.
[8]宋占科,王小艳,李春,等.产紫青酶β-葡萄糖醛酸苷酶基因的克隆与原核表达[J].化工学报,2008,59(12):3101 -3106.
[9]Feng Shijiang,Li Chun,Xu Xiaolin,et al.Screening strains for directed biosynthesis of β-d-mono-glucuronide-glycyrrhizin and kinetics of enzyme production[J].Journal of Molecular Catalysis B:Enzymatic,2006,43:63-67.
[10]杨金水,刘葳.甲壳素/壳聚糖在酶固定化载体中的应用[J].生物技术,2006,16(2):89-91.
[11]许牡丹,杨伟东,王振磊.甲壳素固定化β-甘露聚糖酶的研究[J].食品科技,2007(1):50-52.
[12]张信平,李晓波,金小平.微波提取甘草皂苷的工艺研究[J].医药导报,2006,25(7):63-164.
Study on immobilization of β-glucuronidase by chitin
SUN Qian1,LI Kai-xiong1,LI Chun2,DUAN Hai-yan2,YE Hai2,CAO Hong2,*
(1.Food College,Shihezi University,Shihezi 832000,China; 2.College of Chemistry and Chemical Engineer/Xinjiang Bingtuan Key Laboratory for Green Processing of Chemical Engineering,Shihezi University,Shihezi 832000,China)
The method of immobilized β-glucuronidase was studied in this paper,β-glucuronidase has been immobilized on chitin with glutaraldehyde as crosslinking agent.Some factors that had effect on activity of immobilized β-glucuronidase were studied.The optimal conditions of immobilization were achieved by using the method of orthogonal test,when glutaraldehyde concentration was 0.7%,cross-linking time was 4h,adsorption time was 9h and reaction temperature was 40℃,the recovery rate of immobilized β-glucuronidase activity was 67.32%.
β-glucuronidase;chitin;immobilization
TS201.2+3
B
1002-0306(2011)09-0267-04
现代研究发现,与甘草中的主要有效成分甘草酸(Glycyrrhizin,GL)相比,单葡萄糖醛酸基甘草次酸(Glycyrrhetinic acid monoglucuronide,GAMG)的甜度更高、热量更低,其甜度是GL的5倍多,是蔗糖的1000多倍。GAMG在体液中具有更好的溶解度和跨膜转运能力,药物作用起效更快;动物实验研究表明,GAMG的LD50为5000mg/kg,远远大于GL的LD50(805mg/kg),无致畸变作用[1-3]。无论作为食品添加剂,还是作为原料药,GAMG均有望替代GL,并且可获得相当可观的经济效益。因此,关于GL生物法转化合成高生物活性(GAMG)现已成为国际上食品行业和医药领域的研究热点。本课题组前期从新疆主要甘草种植区的土壤中,筛选分离到可以利用甘草酸(GL)为唯一碳源进行生长的真菌-Penicillium sp. Li-3,由该菌表达的β-葡萄糖醛酸苷酶具有较高的化学键选择性,能定向催化甘草酸生成GAMG[4-8],其摩尔转化率可达到88.45%[9]。但在后续研究中发现,游离β-葡萄糖醛酸苷酶的稳定性较差,易失活,并且反应后混入催化产物,纯化困难,不能重复使用。本文研究固定化β-葡萄糖醛酸苷酶制备技术能够有效弥补游离酶存在的这些不足。甲壳素是一种天然氨基多糖,是甲壳类动物壳的主要成分。据估计它在生物圈合成与分解一年可达1×106t,是世界上产量最丰富的、可再生的有机资源之一[10]。由于甲壳素的特性和环保性,使其成为较好的酶固定化载体材料,而且酶经固定化后耐酸碱性强,耐热性好,酶活不受金属离子干扰,同时减轻对环境的污染,近年来,国际上也十分重视对这一资源的开发和利用,因此具有良好的发展前景。
2010-09-09 *通讯联系人
孙倩(1985-),女,硕士,研究方向:生物技术与酶工程。
教育部科学技术研究重点项目(209146);兵团博士资金项目(2009JC13);2008年度石河子大学高层次人才科研启动资金专项(RCZX200805)。
