基于抗体微阵列的食源性病原体综合检测平台
2011-11-02林荣生
林荣生
(厦门华厦职业学院食品药品安全检测中心,福建厦门361024)
基于抗体微阵列的食源性病原体综合检测平台
林荣生
(厦门华厦职业学院食品药品安全检测中心,福建厦门361024)
针对超低浓度食源性病原体样本检测的需要,将表面沉积铁氰酸镍薄膜的微叉指电极与生物活化的微珠相结合,设计并实现了通过测定电化学阻抗变化的抗体微阵列食源性病原体综合检测平台样件。提出了电化学阻抗等效电路,并通过电路模型分析表明,生物活化的微珠、微叉指电极之间的电容、溶液的电阻均对电化学阻抗传感单元的输出特性有显著影响。以不同浓度的病原体为样本,完成了Escherichia coli O157∶H7为目标病原体的实验研究。实验结果表明,该微抗体阵列的检出极限低至1.0pg/mL,可满足超低浓度食源性病原体的检测需要。
食源性病原体,抗体微阵列,超低浓度,电化学阻抗,生物活化微珠
1 工作原理与结构设计
图1给出了基于抗体微阵列的食源性病原体检测平台原理示意图:搜集各种常见食源性病原体样本,将其固定在抗体淘选(Panning)微系统中;从噬菌体展示抗体库中淘选出对应于各种食源性病原体的特征抗体,并将其固化到电化学阻抗微传感器阵列中的微电极表面,从而形成针对多种病原体的抗体微阵列;当经过制备的待测样本流经微传感器阵列时,通过测定阻抗的变化情况,即可确定样本中目标病原体的存在与否。
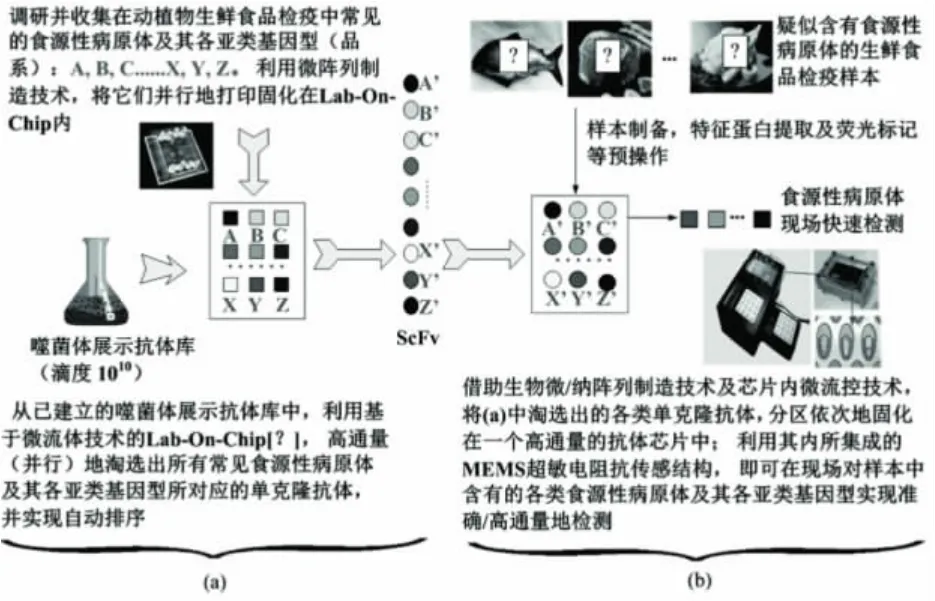
图1 基于抗体微阵列的食源性病原体检测平台原理示意图
1.1 抗体微阵列检测平台
食源性病原体抗体微阵列检测平台构成如图2所示:(a)为检测平台样件原型;(b)为平台内针对不同食源性病原体类型的抗体微阵列分区,布置在4英寸的Pyrex 7740玻片上;(c)为以Salmonella为代表,根据抗原区分的甲、乙、丙、丁、戊等基本菌属微阵列分区;(d)为对应于针对某一特定食源性病原体的ECI传感单元,包括微通道、微电极以及微电极上的铁氰酸镍薄膜等。各抗体微阵列之间通过微通道结构实现互连;微通道结构由聚二甲基硅氧烷(polydimethylsiloxane,PDMS)经SU8模具压铸形成。
1.2 ECI传感单元
ECI传感单元包括当待测样本流经ECI传感单元时,其中存在的目标病原体可被ECI单元的电极捕获;在ECI单元上施加一系列不同频率的小幅交流电压,测量交流电势与电流信号的比值(阻抗)随正弦波频率ω的变化,以及阻抗相位角φ随ω的变化,即可获知ECI单元中即时的电极特性,从而确定待测流体中是否存在目标病原体。

图2 食源性病原体抗体微阵列检测平台示意图
为增加ECI电极捕获目标病原体的概率,ECI电极采用叉指微电极(Interdigintated Microelectrodes, IDMs)结构,如图2(d)所示。叉指微电极除有高灵敏度的优点外,还有便于微型化、响应快、高信噪比、易加工等特点[7]。与常规的三电极结构相比,叉指微电极结构可省去参考电极(Reference electrode)。本文中微电极叉指宽度和间距均为 5mm,长度为500mm,厚度为100nm,叉指对数为25对;采用金(Au)溅射在Pyrex 7740玻片上通过湿法腐蚀实现。为增强金电极与玻片基底之间的附着力,在金与玻片之间先溅射钛/镉(Ti/Cd)薄膜作为粘附层。
为提高ECI传感单元的灵敏度,在IDMs表面沉积了一层铁氰酸镍(nickel hexacyanoferrate,NiHCF)薄膜。当微电极上施加有交流电势时,发生如(1)式所示的氧化-还原反应[11]:
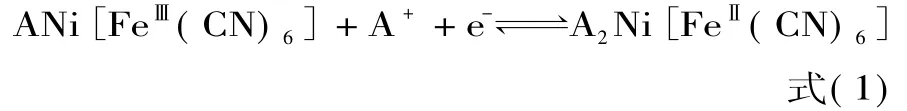
即:溶液中的阳离子(K+或Na+)和电子均向阴极区的NiHCF薄膜迁移;阳极区的NiHCF薄膜则释放出阳离子和电子,如图3所示。

图3 氧化-还原反应时,溶液-NiHCF薄膜-电极之间的电荷迁移
此外,NiHCF薄膜还具有独特的优点:可将6xHis抗体方便地固定到其表面,且与6xHis抗体结合牢固[12-13]。利用抗体-抗原结合的特异性,可将目标病原体捕获并固定在微电极表面,改变电极表面的氧化-还原反应特性,从而实现有效检测。
1.3 生物活化的微珠
根据超低浓度目标病原体检测的需要,为进一步提高ECI单元的灵敏度,引入生物活化的微珠(Microbeads)作为捕获目标病原体的辅助工具(图4)。微珠采用MicrobeadsTM AS的Dynoseeds@TS系列聚苯乙烯(polystyrene,PS)颗粒,直径为10μm;表面覆涂有与NiHCF薄膜表面固化的同种6xHis抗体。样本制备时,生物活化的微珠与样本预先混合;由于微珠直径远大于目标病原体,如:salmonella菌大小仅为(0.6~0.9μm)×(1~3)μm、Escherichia coli大小为0.5×1μm,且生物活化的微珠浓度较高,因而目标病原体易于被生物活化的微珠捕获,从而增加被微电极固定的几率。如图4所示,当目标病原体被微珠捕获并被固定于电极表面时,与6xHis抗体紧密结合,并呈“三明治”结构。
生物活化微珠的引入,势必影响ECI传感单元的输出特性:首先,微珠的介电常数仅为2.1,远低于电解质溶液的介电常数(约为75~80);其次,微珠的存在将会影响阳离子的迁移率,从而改变电极NiHCF薄膜上的氧化-还原反应特性。藉由微珠引起的电化学阻抗谱的变化,有望增加ECI传感单元的灵敏度。
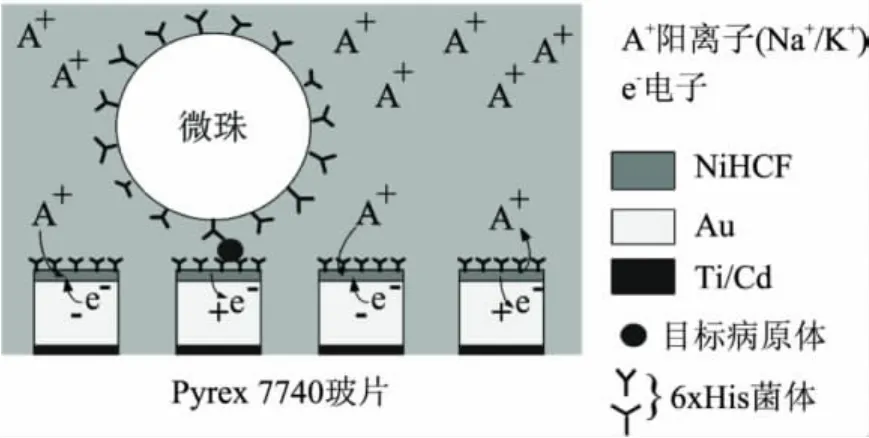
图4 生物活化的微珠辅助捕获目标病原体
2 ECI单元电路分析
2.1 等效电路
为揭示ECI传感单元的输出特性,综合考虑ECI传感单元的结构组成,总结得到如图5所示的等效电路:Ccell为IDMs之间的电容,其中考虑电解质溶液介电常数的影响;CPE1表示各向异性电极界面上的电容,包括电双层效应电容;CPE2对应于电极表面上阳离子的扩散效应。
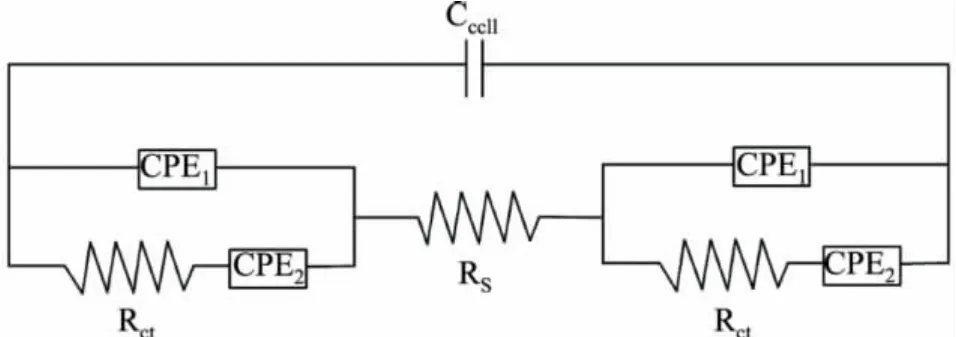
图5 ECI传感单元等效电路
根据Retter等的研究结果[14],最终可导得总阻抗ZTotal相当于NiHCF薄膜阻抗Zfilm与IDMs阻抗Zcell并联之和,即:

设总阻抗的实部和虚部分别为Ztotal,Re和Ztotal,Im,则有:
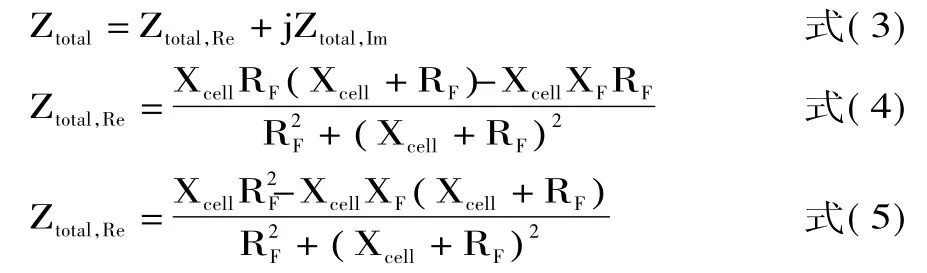
利用式(3)~式(5),可获得Nyquist或Bode曲线,分析ECI传感单元的电路特性。
2.2 影响ECI传感单元输出特性的因素
2.2.1 生物活化的微珠 首先考虑生物活化的微珠对ECI单元的影响。图6给出了有/无微珠固定条件下,IDMs表面上的电流密度分布情况,通过Comsol Multiphysics模拟获得。图6表明:在有生物活化微珠存在的条件下,微珠明显影响局部的电流密度分布;这说明生物活化微珠的存在,可改变局部的电化学反应特性,从而影响ECI传感单元的输出特性。同时,IDMs上固定微珠数目的多少,也对总阻抗有显著影响。

图6 生物活化的微珠对IDMs局部电流密度分布的影响注:(a)无微珠;(b)有微珠。
2.2.2 Ccell参数Ccell代表了IDMs本身的特性,同时也包含了电介质(样本溶液)的影响。图7分别给出了Ccell对总阻抗绝对值大小以及对总阻抗相位角的影响:当Ccell受微珠的影响、其数值略有减小时,在较低交流电压频率条件下,对总阻抗绝对值与相位角的影响不大;而在较高交流电压频率条件下,总阻抗绝对值及相位角均发生明显变化,前者略有增大,后者略有降低。
图7 Ccell对ECI传感单元输出阻抗的影响注:(a)总阻抗绝对值;(b)总阻抗角频率。
2.2.3 Rs和Rct等效电路中的Rs为溶液的电阻,直接影响阳离子的迁移特性;Rct则是NiHCF薄膜与电极之间电荷迁移相关的电阻。这两个参数也可影响ECI传感单元的输出特性,分别如图8和图9所示。
图8表明,Rs对ECI传感单元输出阻抗的影响显著;当Rs增大时,ECI单元的阻抗值也显著增大。图9则说明Rct对ECI传感单元的影响比较有限,仅对较大阻抗的实部稍有影响。这表明,溶液中阳离子扩散导致的电阻对ECI传感单元的影响更为显著。引入生物活化的微珠,实质上对局部阳离子的扩散有直接影响,而对NiHCF薄膜与IDMs之间的电子传输则影响很小。

图8 Rs对ECI传感单元阻抗的影响

图9 Rct对ECI传感单元阻抗的影响
3 结果与讨论
3.1 实验方法
以Escherichia coli O157∶H7为目标病原体,对抗体微阵列检测平台样件进行了实验。用高浓度的NaNO3溶液(0.1mol/L),制备了不同目标病原体浓度的待测样本,使之依次流经表面固化有Escherichia coli O157∶H7抗体的ECI传感单元。图10给出了实验过程示意图:(a)待测样本与覆涂有相应6xHis抗体的生物活化微珠预先混合;(b)为待测样本流入ECI传感单元的微通道,目标病原体被固定在微电极表面;(c)覆涂有其它抗体的微珠被缓冲液冲走,仅剩下目标病原体及微珠被固定在NiHCF膜表面。
3.2 实验结果
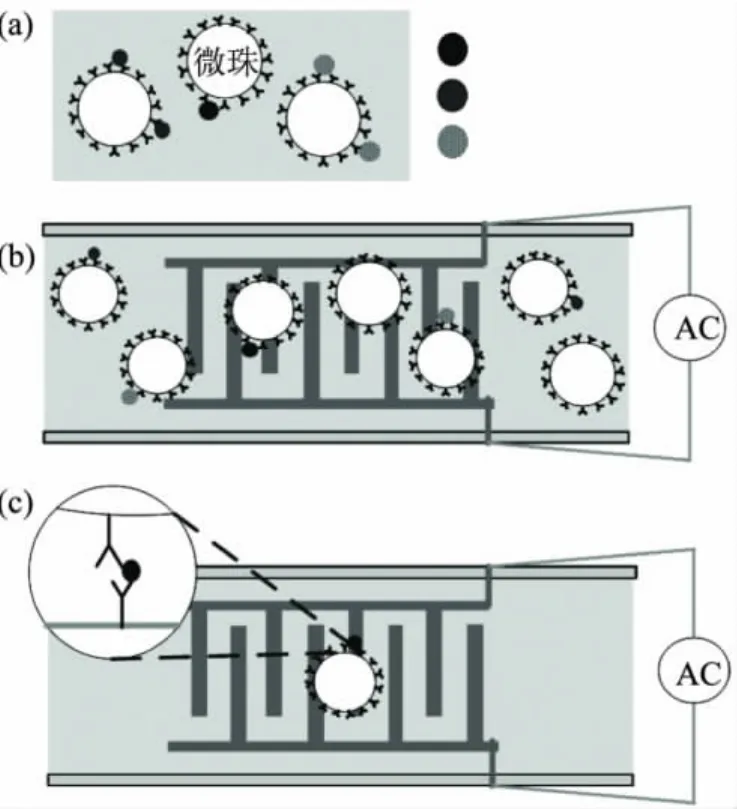
图10 抗体微阵列实验过程示意图
图11给出了以Escherichia coli O157∶H7为目标病原体实验结果与模型预测值对比。结果显示:ECI传感单元的阻抗变化随目标病原体浓度的增大而增大;ECI传感单元对Escherichia coli O157∶H7的检出最低浓度约为1.0pg/mL。这表明,以IDMs和微珠相结合的抗体微阵列传感单元适于检测超低浓度的食源性病原体样本。值得注意的是,实验测得的阻抗变化比模型预测值要小;其原因是,基于等效电路的模型预测与实际情形仍有一定误差,有待于在今后的工作中深入研究。
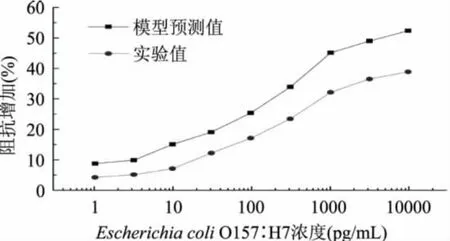
图11 以Escherichia coli O157∶H7为目标病原体的实验结果
4 结论
针对超低浓度食源性病原体检测的需要,采用在微叉指电极上沉积NiHCF薄膜,并引入生物活化的微珠,设计并初步实现了基于电化学阻抗分析的抗体微阵列食源性病原体综合检测平台。通过对等效电路的分析和模拟,得出以下结论:a.微珠对改变微叉指电极表面局部电化学反应状况有明显作用; b.微叉指电极对之间的电容对ECI传感单元的阻抗有一定影响;c.溶液中阳离子的迁移对阻抗特性有显著影响,NiHCF薄膜与电极之间的电子迁移对阻抗变化影响很小。
以Escherichia coli O157∶H7为目标病原体的实验结果表明,基于电化学阻抗分析的抗体微阵列食源性病原体综合检测平台具有极低的检出极限,可低至1.0pg/mL,适于超低浓度食源性病原体的检测需要。在后续研究中,将进一步探索对该系统的设计优化工作,以实现该平台的商品化开发。
[1]http://www.who.int/foodsafety/foodborne_disease/general/ en/index.htmL.
[2]Velusamy V,Arshak K,Korostynska O,et al.An overview of foodborne pathogen detection:In the perspective of biosensors[J].Biotechnology Advances,2010,28:232-254.
[3]Leonard P,Hearty S,Brennan J,et al.Advances in biosensors for detection of pathogens in food and water[J].Enzyme and Microbial Technology,2003,32:3-13.
[4]Wang RF,Cao WW,Cerniglia CE.A universal protocol for PCR detection of 13 species of foodborne pathogens in foods[J]. Journal of Applied Microbiology,1997,83:727-736.
[5]Artault S,Blind JL,Delaval J,et al.Detecting Listeria monocytogenes in food[J].International Food Hygiene,2001,12 (3):23.
[6]Hagens S,Loessner MJ.Application of bacteriophages for detection and control of foodborne pathogens[J].Appl Microbiol Biotechnol,2007,76(3):513-519.
[7]Varshney M,Li Y.Interdigitated array microelectrodes based impedance biosensors for detection of bacterial cells[J]. Biosensors and Bioelectronics,2009,24:2951-2960.
[8]Yang LJ,Li YB,Griffis CL,et al.Interdigitated microelectrode (IME)impedance sensor for the detection of viable Salmonella typhimurium[J].Biosensors and Bioelectronics,2004,19:1139 -1147.
[9]Yang L,Bashir R.Electrical/electrochemical impedance for rapid detection offoodborne pathogenic bacteria[J]. Biotechnology Advances,2008,26:135-150.
[10]Kim HJ,Park SH,Lee TH,et al.Microarray detection of food -borne pathogens using specific probes prepared by comparative genomics[J].Biosensors and Bioelectronics,2008,24:238-246.
[11]Yang MH,Yang YH,Qu FL,et al.Attachment of Nickel Hexacyanoferrates Nanoparticles on Carbon Nanotubes: Preparation,Characterization and Bioapplication[J].Analytica Chimica Acta,2006,571(2):211-217.
[12]王淑敏,屈建莹.铁氰酸镍膜修饰金电极的研制及应用[J].化学研究,2008,19(3):79-83.
[13]Chen W,Tang J,Cheng H,et al.A simple method for fabrication of sole composition nickel hexacyanoferrate modified electrode and its application[J].Talanta,2009,80:539-543.
[14]Retter U,Widmann A,Siegler K,et al.On the impedance of potassium nickel hexacyanoferrate composite electrode-the generalization of the Randles model referring to inhomogeneous electrode materials[J].Journal of Electroanalytical Chemistry,2003,546:87-96.
Comprehensive platform for detecting foodborne diseases pathogens based on antibody microarrays
LIN Rong-sheng
(Testing Lab for Food and Drug Safety,Xiamen Huaxia Vocational College,Xiamen 361024,China)
With the aim to solve the difficulty in detection of ultra-low level foodborne disease pathogens on the spot,a comprehensive antibody microarray platform for rapid detection of multiple foodborne disease pathogens had been designed and realized.By combination of interdigitated microelectrodes(IDMs)deposited with thin nickel hexacyanoferrate film and bioactivated microbeads,the electrochemical impedance(ECI)cell had been rendered with a good sensitivity.An equivalent circuit was proposed to analysis the effects from the parameters of the ECI cell.It was found the existence of the microbeads,capacitance between the IDMs,and resistance in the solution could influence of the impedance of the ECI cell.Witht Escherichia coli O157∶H7 as the target pathogens, experiments were carried out with different concentration of target.The experimental results showed a good detection limitation at 1.0pg/mL.It indicated that the antibody microarray platform was suitable for ultra-low level detection of foodborne disease pathogens.
foodborne pathogens;antibody microarray;ultra-low level;electro-chemical impedance;bioactivated microbeads
TS207.3
A
1002-0306(2011)12-0489-05
食源性病原体,如:Campylobacter、Salmonella、Listeria monocytogenes,Escherichia coli O157∶H7,已被世界卫生组织(WHO)确认是导致食品污染、影响公共食品安全的元凶[1-2]。能否在短时间内准确测定样本中含有病原体,特别地,探测低浓度以及超低浓度样本中病原体是否存在,对于在第一时间采取措施、防止发生食品中毒,具有重要意义。常规的食源性病原体检测方法,能够定性和定量地测定病原体的存在,具有较高的灵敏度;然而,其检测时间通常需要数小时至数天不等,并且需在专门实验室内完成[3],例如:NF EN ISO 11290-1法检测单核细胞增多性李斯特菌需要 7d时间方可得到结果[4]; polymerase chain reaction (PCR) 和 Reversal Transcriptase polymerase chain reaction(RT-PCR)检测常规食源性病原体,也需要在6~8h的微生物培养之后才能进行[5];此外,采用噬菌体技术检测食源性病原体虽然具有快速的特点,但却不适用于超低浓度样 本 检 测[6]。电 化 学 阻 抗 (Electrochemical Impedance,ECI)传感技术已经在用于病原体的生物传感器中获得应用[7]。Yang等人[8-9]采用差指微电极作为阻抗传感器研究了活性Salmonella的快速检测,记录了4种频率下阻抗增长曲线、阻抗随细胞生长时间的变化曲线,结果表明,对浓度为5.4×105CFU/mL的样本检测时间仅为2.2h。具有高通量特征的微阵列芯片[10],为开发针对多种病原体的综合检测,提供了有效的解决方案。本文将电化学阻抗传感技术与抗体微阵列相结合,把对应于常见食源性病原体的抗体集成到微阵列中,并应用微珠(Microbeads)增强阻抗变化信号,设计便携的食源性病原体综合检测平台,尤其适用于超低浓度食源性病原体样本的预防性检测。
2010-12-23
林荣生(1964-),男,副主任,研究方向:食品药品检测、有机高分子材料科学与工程。
