苔干多酚氧化酶的酶学特性研究
2011-11-02陈乃富
张 莉,陈乃富
(皖西学院生物与制药工程学院,安徽六安237012)
苔干多酚氧化酶的酶学特性研究
张 莉,陈乃富
(皖西学院生物与制药工程学院,安徽六安237012)
研究了苔干(Lactuca sativa var.angustata)多酚氧化酶的酶学性质。结果表明:以邻苯二酚为底物,该酶的最适pH为7.4,最适温度30℃,70℃以上温度使酶迅速失活,动力学方程v=518.96[S]/(0.0166+[S]),VC、异VC钠、NaHSO3、L-Cys可完全抑制酶活性,饱和NaCl、10%蔗糖、SDS、EDTA-Na2均可显著抑制酶活性。该酶能催化邻苯二酚、焦性没食子酸氧化,但对邻苯二酚的亲和力更强。
苔干,多酚氧化酶,提取,纯化,酶学特性
苔干,又名贡菜、响菜、山蜇菜,是安徽涡阳、江苏邳州等地的传统名优特产蔬菜,在分类上属菊科莴苣属茎用莴苣(Lactuca sativa var.angustata)[1-2]。苔干的种植加工有悠久的历史,因其特有的食用价值,早已驰名中外。苔干经刨皮、划菜成条、晾晒或烘干脱水而制成绿色或淡绿色的干制品。但是苔干无论是在加工过程中,还是在贮藏、销售等环节均存在褐变问题,影响到产品质量及商品价值。尤其是在加工过程中如因阴天无法晾晒或烘干方法不当,均可因褐变尤其是酶促褐变,引起严重的产品质量问题。酶促褐变主要是由多酶氧化酶(Polyphenol oxidase,简称 PPO,EC 1.10.3.1)催化引起的[3-4]。本文对苔干多酶氧化酶的酶学特性进行了研究,为科学控制苔干加工、贮藏、销售过程中的酶促褐变提供理论依据。
1 材料与方法
1.1 实验材料
新鲜苔干 采购于安徽涡阳义门镇,为秋季苔干,新鲜苔干购回时带叶整株放入-18℃冰箱中冷冻保存。
1.2 实验方法
1.2.1 PPO粗酶液提取 取100g去掉叶片的苔干,加入300mL预冷的0.2mol/LpH6.8柠檬酸-磷酸缓冲液,按文献[5]方法制备PPO粗酶液。
1.2.2 PPO的Sephadex G-75柱层析纯化 将PPO粗酶液用甘油浓缩至约为原体积的1/6,取此浓缩粗酶液2mL上Sephadex G-75凝胶柱(内径1.5cm,柱高50cm)以0.2mol/L pH6.8柠檬酸-磷酸缓冲液进行洗脱,洗脱速度为0.5mL/min,自动部分收集器每5min收集一管。将记录仪记录的蛋白质峰值附近的5支试管中的洗脱液合并,即为纯化的PPO酶液,以此酶液进行酶学特性研究。
1.2.3 PPO的酶学性质 PPO的酶活性的定义与测定、酶促反应的吸收光谱特征、酶促反应速度曲线、pH等对PPO活性影响的测定均参照文献[5]进行。但是所用测定酶活性的最大波长为410nm。
2 结果与分析
2.1 酶促反应的吸收光谱
图1所示的是酶促反应开始后连续6次可见光范围内的扫描的吸收光谱,6次扫描的总时间为14min,每次扫描时间约为2'20″,实验结果见表1。
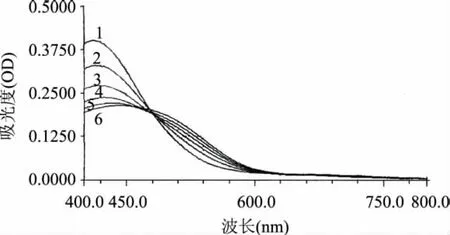
图1 酶促反应产物的吸收光谱
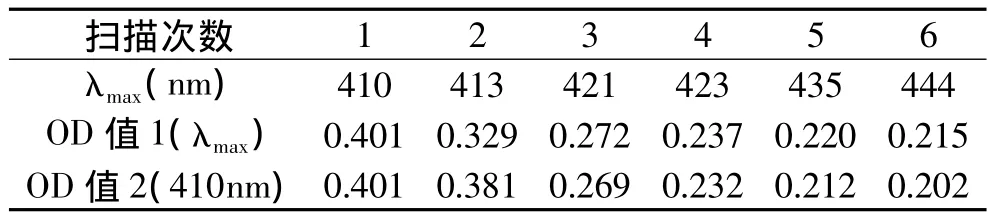
表1 连续扫描的λmax值及OD值变化
结合图1及表1可知,PPO催化邻苯二酚反应的产物在不同时间扫描得到的可见光吸收光谱特征相似,均有一个最大的吸收峰,但每次扫描得到的最大吸收波长均不相同,而是随着酶促反应时间的延长(随扫描次数的增加),最大吸收波长λmax在逐渐增大,从第一次扫描的410nm,增加到第六次扫描的444nm。
表1中的OD值1,是用吸收光谱中最大吸收波长λmax在表中所示的扫描次数中得到吸光度值;OD值2是固定用410nm波长在表中所示的扫描次数中得到的吸光度值;随反应时间的延长,OD值1、OD值2均呈现出逐渐下降的趋势。这是由于PPO催化邻苯二酚转变成醌,醌进一步聚合,最后生成结构更为复杂的黑色素。醌的进一步聚合无需酶的催化能自动进行。所以随酶促反应时间的延长,OD值会因产物的转化出现减少趋势。也正是因为醌的进一步聚合向黑色素方向转化而使得产物的吸收峰值波长不断增大,向长波方向偏移。
上述酶促反应的变化趋势与蕨菜PPO催化邻苯二酚反应的变化趋势有相似之处[5]。这也说明在测定PPO活性时,要确定适宜的酶促反应时间,并准确把握这一反应时间来测定OD值是十分重要的。
2.2 PPO的酶促反应速度曲线
图2所示为苔干PPO催化邻苯二酚反应速度曲线。可以清楚地看出,随反应时间的延长,单位时间内的产物生成量一直在减少,即酶促反应的速度在逐渐减小。反应至140s时,产物生成量不再增加,反应至200s后,产物生成量反而呈略下降趋势,这与2.1项所述吸收光谱及吸光度变化的原因相同,也是因为PPO催化邻苯二酚转变为产物醌后,醌可以进一步自动聚合向黑色素方向转化,使得吸光度减小。但是60s以内的产物生成量与反应时间近似呈线性关系,基本能反映酶促反应的初速度且60s也能满足实验操作的需要,所以选用测定酶促反应1min时的OD值来表示酶活性的高低。
2.3 pH对PPO活性的影响
从图3分析,苔干PPO的最适pH为7.4,这与蕨菜PPO的最适pH相同,与牛蒡PPO的最适pH7.2相近[6],比苹果梨PPO最适pH4.6高出近3个pH单位[7]。pH在4~7范围内,苔干PPO活性变化幅度较小,而在pH7~8范围内的活性变化幅度非常大,说明苔干PPO在pH为7~8范围时,对pH的变化非常敏感,很小的pH变动,会引起酶活性发生很大变化。当pH降至7以下时,PPO活性也减小到最适pH时活性的25%以下,当pH降至4时,酶活性只相当于pH7.4时活性的11.3%。说明对于苔PPO而言,pH在7以下就可有效抑制其活性,从而减少褐变的发生。
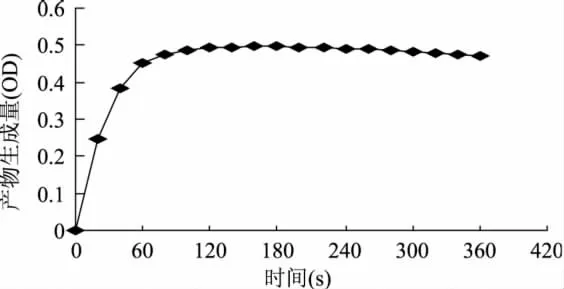
图2 PPO 反应速度曲线
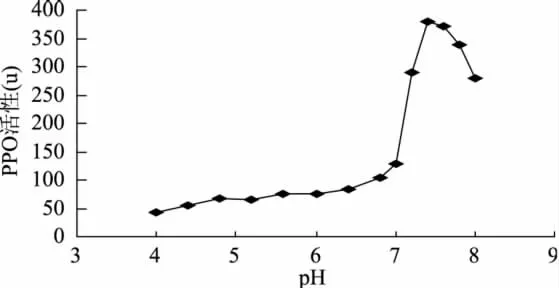
图3 PPO活性与pH的关系
2.4 温度对PPO活性的影响
图4说明,苔干PPO的最适温度为30℃,在15~45℃范围内均表现较高的活性,15~30℃时随温度的升高PPO活性逐渐增大,30℃以上时的酶活性表现下降趋势。图5所示的为PPO酶液在60、70、80、90、100℃水浴中保温一定时间后测定的活性与室温放置酶液测定活性的比值(%)。从图5可以看出,70℃以上温度有利于钝化酶的活性;80℃水浴温度处理60s,PPO活性只有未处理活性的23.5%;90℃处理60s、100℃处理30s,PPO活性均降至20%以下; 90℃以上温度处理120s后,PPO活性基本消失。说明采用短时高温的热处理方法是一种有效的钝化苔干PPO活性的方法。
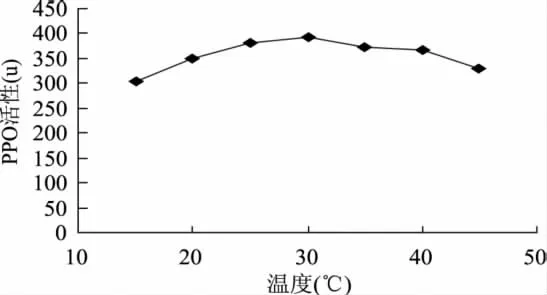
图4 PPO活性与温度的关系
2.5 底物浓度对PPO活性的影响

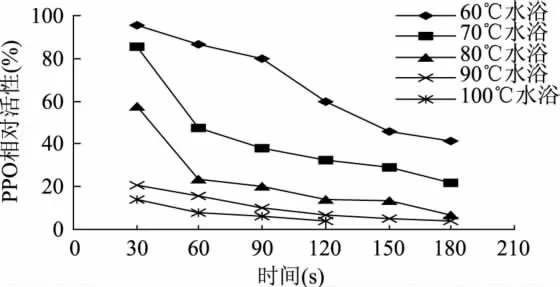
图5 PPO的热稳定性
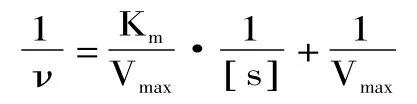

相关系数r=0.9940,如图6所示。从图6中可以得出,Vmax=518.96u,Km=1.66×10-2mol/L。苔干PPO以邻苯二酚为底物的动力学方程为
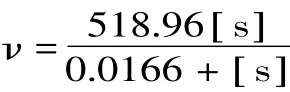
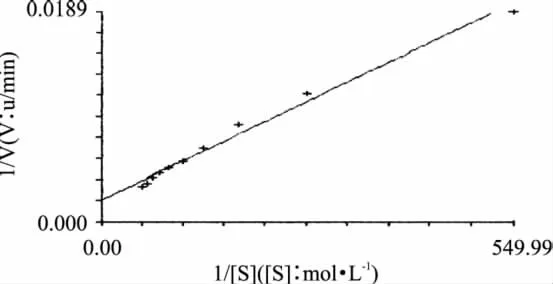
图6 底物浓度对反应速度的Lineweaver-Burk图
2.6 抑制剂对PPO活性的影响
如表2所示抑制剂的抑制效果,其中PPO相对活性是指各种含抑制剂的酶活性与不含抑制剂的酶活性的比值(%)。由表2分析:VC、异VC钠、NaHSO3、L-Cys在0.1%~1%浓度范围对PPO皆表现出强烈的抑制作用,而且随浓度增大抑制效果增强,直至完全抑制。其中VC、异VC钠一方面能抑制PPO酶本身的催化作用,同时又能还原PPO形成的产物醌为酚,并且还消耗反应体系中的氧。NaHSO3与L-Cys能与醌类形成无色聚合物又能还原醌,因此,它们都表现出强烈的抑制作用。饱和NaCl也能较强地抑制酶活性。10%蔗糖和一定浓度的SDS也表现较强的抑制作用,这与它们对蕨菜PPO的影响不同,二者对蕨菜PPO有一定激活作用[5]。不同浓度的EDTA-Na2表现出不同的抑制效果,浓度越高抑制作用越强。EDTA-Na2对PPO活性的影响可能是与酶分子中Cu2+结合而抑制酶的活性[5,7-8]。苯甲酸钠随浓度的增大,也略表现一定的抑制作用,但抑制效果没有其它的抑制显著。综上分析认为,选择适当的抑制剂来抑制PPO活性是控制酶促褐变的一条有效途径。
2.7 PPO催化不同底物反应的结果分析
表3所示苔干PPO催化邻苯二酚(0.04mol/L)、焦性没食子酸(邻苯三酚,0.04mol/L)、愈创木酚(0.04mol/L)、L-酪氨酸(饱和浓度)四种底物反应的产物吸光度,由于焦性没食子酸在碱性条件下可以发生自氧化,故这里酶促反应选用的是pH6.8而不是pH7.4的柠檬酸-磷酸缓冲液。
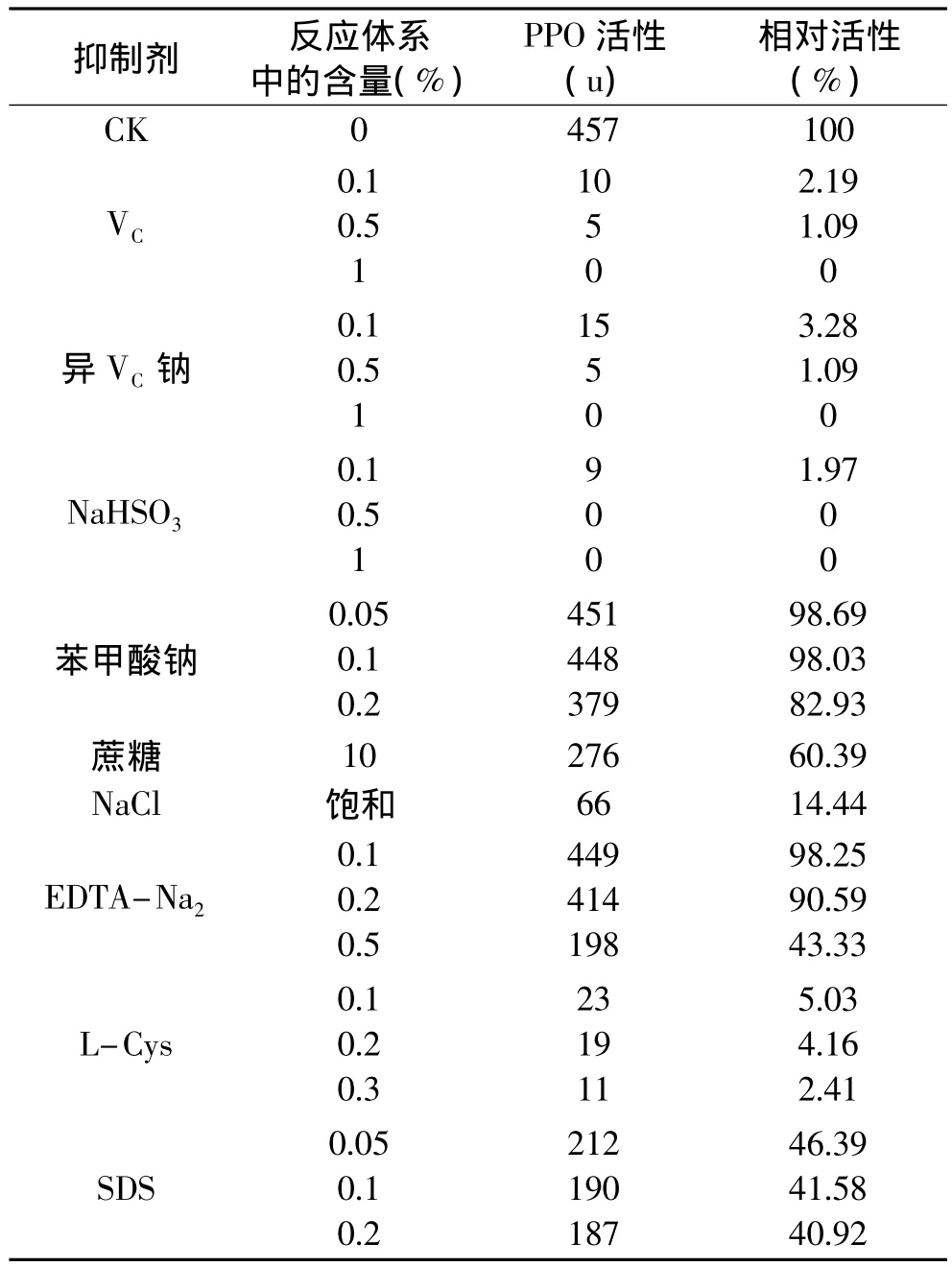
表2 抑制剂对PPO活性的影响

表3 PPO催化不同底物的酶活性
以邻苯二酚为底物的酶活性为100,另外三种底物的酶活性分别与以邻苯二酚为底物的酶活性相比,得相对活性(%),见表3。从表3看出,PPO催化不同底物的活性差异较大,愈创木酚、L-酪氨酸不是其适宜底物,而邻苯二酚、焦性没食子酸则是其适宜底物,但对邻苯二酚的亲和力更强。这与有关文献[5,8-9]报道相一致。
3 结论
3.1 苔干多酚氧化酶催化邻苯二酚生成的产物在410nm处有最大吸收峰,但随反应时间的延长,最大吸收峰有向长波偏移的趋势。测定酶促反应1min时的速度能基本反映酶促反应的初速度。
3.2 pH对酶活性影响显著,酶的最适pH为7.4,调pH至偏酸环境可有效地抑制PPO活性。
3.3 反应体系温度在15~45℃范围内酶活性较高,最适温度为30℃。酶的热稳定性差,70℃以上短时高温可有效钝化酶活性。
3.4 以邻苯二酚为底物的PPO动力学方程为:v= 518.96[S]/(0.0166+[S])。
3.5 酶的适宜底物为邻苯二酚(二元酚)及焦性没食子酸(三元酚)。VC、异VC钠、NaHSO3、L-Cys对酶都有极强的抑制作用;饱和NaCl、10%蔗糖、SDS、EDTA-Na2也有显著抑制效果;苯甲酸钠抑制效果较差。
[1]安徽省科学技术厅.安徽植物志[M].第四卷.合肥:安徽科技出版社,1991:635-636.
[2]郭文场,杨松涛,吕忠宁.古来“贡菜”话苔干[J].植物杂志,2001(1):27-28.
[3]张国珍.食品生物化学[M].北京:农业出版社,1992: 303-308.
[4]王璋.食品酶学[M].北京:轻工业出版社,1992:303-278.
[5]陈乃富.蕨菜多酚氧化酶的酶学性质[J].云南植物研究,2003,25(6):705-710.
[6]乔旭光,夏向东,张步志,等.牛蒡多酚氧化酶酶学性质研究[J].山东农业大学学报,1997,28(3):327-330.
[7]程建军,马莺,杨咏丽,等.苹果梨中多酚氧化酶酶学特性的研究[J].园艺学报,2002,29(3):261-262.
[8]张淑政,姚延寿,常鹏,等.华北落叶松多酚氧化酶动力学特性及其同酶的研究[J].山西大学学报:自然科学版,1999,22(1):61-64.
[9]毕阳,欧阳春光.苹果梨多酚氧化酶(PPO)的部分特性[J].食品科学,2001,22(12):29-30.
Enzymologic properties of polyphenol oxidase of Lactuca sativa var.angustata
ZHANG Li,CHEN Nai-fu
(Department of Biological and Pharmaceutical,West Anhui University,Liu’an 237012,China)
The kinetic property of polyphenol oxidase(PPO)in Lactuca sativa var.angustata was analyzed.The result showed that,by using the catechol as the substrate,the most suitable pH and temperature for this enzyme was at 7.4 and 30℃,respectively,and it would be rapid inactivated if the temperature went above 70℃.The kinetic equation was v=518.96[S]/(0.0166+[S]),and VC,sodium D-isoascorbate,NaHSO3,L-Cys could completely inhibit PPO activity.Saturated NaCl,sugar(10%),SDS and EDTA-Na2could remarkably inhibite PPO activity.This enzyme could catalyze the oxidization of catechol and pyrogallic acid,and had higher affinity to catechol.
Lactuca sativa var.angustata;polyphenol oxidase(PPO);extraction;purifying;kinetic property
TS255.1
A
1002-0306(2011)12-0200-04
2011-08-31
张莉(1973-),女,硕士,副教授,研究方向:天然产物开发利用。
