胚胎脑片免疫荧光组织化学双重漂染技术在神经元发生研究中的应用
2011-11-02吴美延莉陈爱军
敖 然 吴美延 赵 慧 周 莉陈爱军
(吉林大学白求恩医学院组织学与胚胎学系,长春 130021)
胚胎脑片免疫荧光组织化学双重漂染技术在神经元发生研究中的应用
敖 然 吴美延 赵 慧 周 莉*陈爱军
(吉林大学白求恩医学院组织学与胚胎学系,长春 130021)
目的 为更客观地观察胚胎脑神经祖细胞的增殖、分化和迁移,建立胚胎脑片免疫荧光组织化学双重漂染技术。方法 灌流固定,取胚胎14天(E14)大鼠脑,低熔点琼脂糖包埋,振动切片机连续冠状切片,免疫荧光组织化学双重漂染,激光扫描共聚焦显微镜下观察。结果 波形蛋白(Vimentin)和乙酰胆碱转移酶(ChAT)双阳性细胞呈黄色荧光,胞体位于脑室区,长突起呈放射状。ChAT阳性细胞呈红色荧光,除胞体位于脑室区,长突起呈放射状伸展外,可见皮层板区也有阳性细胞集聚。结论 此项技术可直接观察到胚胎脑神经祖细胞和成神经细胞的完整形态,并通过免疫荧光组织化学方法鉴定其表型,从而阐明相互之间的关系。
胚胎脑片; 免疫荧光组织化学; 神经元发生
在研究胚胎端脑神经元发生时,为证实神经元的来源、迁移和归宿,常常需要通过免疫组织化学技术鉴别神经元类型,有时还需检测两种标志性蛋白共存于同一种细胞质内。但是,由于胚胎端脑细胞核大,细胞质极少,一般免疫组织化学双重染色很难客观地辨认两种蛋白是否共存于同一胞质内。此外,一般石蜡切片和冰冻切片,厚度为5-20μm,端脑细胞多为放射状突起细胞,在如此薄的组织切片上仅能见到长突起的断续截面,而不能观察这些细胞长突起的立体完整形态以及与周围细胞的联系,因此,薄切片和一般免疫组织化学染色技术限制了对胚胎脑发育的研究。使用琼脂糖包埋胚胎脑组织,振动切片机把脑切成厚度为60-100μm的脑片,免疫荧光组织化学技术进行漂染,激光扫描共聚焦显微镜下观察,不但可以观察端脑细胞的完整形态,还可以在活体荧光标记之后动态观察神经祖细胞增殖、分裂,产生成神经细胞后的迁移以及最后的归宿,从而更深入地了解神经元发生的细胞机制。然而,由于缺乏此类技术的相关资料,使其不能在国内普遍应用。因此实验经过反复摸索,建立了一套较完善的技术体系。
材料和方法
1 实验动物
实验所用清洁级 Wistar大白鼠3只,雌性2只,雄性1只,由本校实验动物中心提供(实验动物质量合格证号为 SCXK-(吉)2003-0001)。雌性大鼠体质量为(220±10)g,雄性大鼠体质量为(250±10)g,按常规方法将雌雄大鼠合笼交配,次日清晨以镜检阴道涂片,发现精子或阴栓之日为妊娠第零天(E0),并记录胎龄,屏障环境饲养。
2 实验方法
2.1 取材及脑片标本制备
取怀孕14天 Wistar大鼠乙醚麻醉,打开胸腔左心室插管,快速注入预热生理盐水,冲净血液,10%中性甲醛溶液灌流固定,取出胚胎脑,置入同一种固定液中,再固定24h,4℃;10%低熔点琼脂糖包埋,置于4℃冰箱内冷却1h,继续固定 24h,4℃。调节振动切片机刀片角度。修整组织块,去掉组织周围过多的琼脂糖,用胶水把包埋块固定于切片台上,将胚胎脑调整为冠状位,切片厚度为60μm,调节切片速度和振幅,连续切片,切片置入装有0.01Mol PBS的平板孔中保存备用[1-3]。
2.2 免疫荧光组织化学双重漂染
胰蛋白酶消化修复抗原,用预热0.1%胰蛋白酶液37℃孵育切片,30min;为使抗体渗入细胞内,使用去污剂使细胞膜穿孔,3%TritonX-100恒温摇床中孵育20℃,24h;0.01%卵白素孵育30min,RT,以封闭内源性生物素[4-7];即3%甲醇-过氧化氢孵育40min,RT,封闭内源性过氧化物酶;为封闭非特异性反应,分别用 5%山羊血清和 2%BSA孵育30min,RT;同时加入两种不同一抗孵育,4℃过夜,一是小鼠抗大鼠单克隆抗波形蛋白抗体(Vimentin),二是兔抗大鼠多克隆抗乙酰胆碱转移酶抗体(ChA T),用一抗稀释液(含10mg/ml BSA 和0.05(v/v)%Tween的 PBS)配制抗体,效价分别为1:200和1:100,PBS分别替代两种抗体作为阴性对照;针对ChAT滴加羊抗兔生物素化 IgG(二抗)孵育40min,RT;SABC复合物标记Cy3孵育40min,RT(避光);针对Vimentin滴加羊抗小鼠 FITC-IgG(二抗稀释液为含5%BSA和1‰Triton X-100的PBS),效价为1:50,孵育60min,RT(避光);防荧光淬灭封片剂封片,放入湿盒中保存;激光扫描共聚焦显微镜观察并拍照。以上步骤除加一抗前封闭非特异性反应步骤无需将组织片冲洗外,其余步骤完成后均需使用含0.1%Triton X-100的 PBS漂洗3-5次 ,每次 3-5min。
结 果
在激光扫描共聚焦显微镜下观察连续切片的每一张脑片,发现仅在第三张脑片端脑背侧前角部(图1a)可见乙酰胆碱转移酶(ChAT,胆碱能神经元标志性蛋白)阳性细胞呈红色荧光,这些细胞胞体位于脑室区,长突起呈放射状伸展,此外,皮层板区也积聚许多不规则形ChAT阳性细胞(图1c);而波形蛋白(Vimentin,放射状胶质细胞标志性蛋白)阳性细胞几乎在每一张脑片中均有表达,呈绿色荧光,这些细胞胞体位于脑室区,长突起呈放射状伸向软脑膜[8,9],并在其末端相互连接成网(图1b)。当把同一张脑片的两种不同荧光染色重叠时,ChAT和Vimentin双阳性细胞呈黄色荧光,仅见于脑室区呈放射状(图1d)。此结果不仅提示胆碱能神经元是由放射状胶质细胞产生,而且还提示放射状胶质细胞在不对称分裂的同时,已经出现将要产生的神经元表型,这一发现对于研究端脑神经元的发生和迁移机制甚为重要。
讨 论
使用琼脂糖包埋胚胎脑组织,振动切片机切片,免疫荧光组织化学技术漂染,激光扫描共聚焦显微镜下观察,这种技术比一般免疫组织化学技术在研究脑发育方面有更多的优越性。由于大脑神经元发生是以脑室为中心向周围呈放射状迁移,逐渐形成放射状结构单位,此种立体结构很难在平面上完整显示,而振动切片机切出的厚切片则弥补了这一不足。放射状胶质细胞是胚胎端脑中瞬时性神经干细胞,它将在不同时间分化为神经细胞和神经胶质细胞。波形蛋白(vimentin)仅在神经干细胞阶段特异性表达,当细胞分化为特定类型的神经元时,波形蛋白表达逐渐消失[10]。然而,我们正是应用了上述技术才在实验中发现放射状胶质细胞在神经干细胞阶段不但表达波形蛋白,同时还表达它将要分化的神经元类型特异性蛋白,如胆碱能神经元的乙酰胆碱转移酶。尽管对此现象的意义还不甚了解,但是,它提示了在脑发育早期神经递质乙酰胆碱的作用远比目前已知的更为复杂。此项技术的应用使得胚胎端脑放射状胶质细胞如何产生神经细胞和神经胶质细胞的过程以及它们的时空关系更容易被观察。这对研究脑神经元和神经胶质细胞发生机制至关重要。
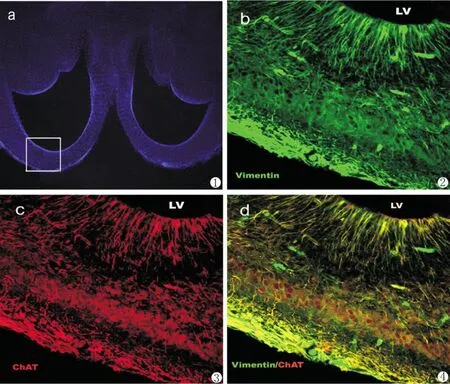
图1 E14大鼠脑片免疫荧光双重染色图1a.端脑冠状切片hoechst33258染色,白框显示端脑背侧前角部;图1b.Vimentin阳性细胞呈绿色荧光,这些细胞胞体位于脑室区,长突起呈放射状伸向软脑膜,并在其末端相互连接成网;图1c.端脑背侧前角部可见ChAT阳性细胞,呈红色荧光,这些细胞胞体位于脑室区,长突起呈放射状伸展。此外,皮层板区集聚许多不规则形ChAT阳性细胞;图1d.同一张脑片的两种不同荧光染色重叠,ChAT和Vimentin双阳性细胞呈黄色荧光,多见于脑室区呈放射状。Fig.1 Immunofluorescence Double Staining for E14 Rat Brain sliceFig.1a. showing telencephalon coronal section with hoechst33258 staining,fore corner of dorsal telencephalon is showed by the white frame. Fig1b. Vimentin positive cells appeared to be green fluorescence,the cellular bodies locate in the ventricle zone(VZ),radial long processes extend to the pial and the each other links into web. Fig1c. ChAT positive cells with red fluorescence were found in the fore corner of dorsal telencephalon. Fig1d. When immunofluorescence double stainning was merged in a visual field ChAT and Vimentin double-positive cells appear to be yellow fluorescence and the radial long processes were seen in the VZ and SVZ,then ChAT positive cells were only observed in the cortex plate.
此项技术的每一环节与常规免疫组织化学技术均有所不同。首先,选择低熔点琼脂糖作为包埋剂,可以避免因包埋组织时组织受热过度而使被检物丧失抗原性。再则,低熔点琼脂糖质地软、黏度大,易与脑组织融为一体。关于使用浓度,文献的报道不尽相同[11,12]。我们经反复试验摸索出适合于本实验的最佳浓度,即10%琼脂糖。配制时应注意以下几点:一是根据所需包埋组织的数量,配制适量的琼脂糖溶液,现配现用,不宜反复加热,因为加热时液体蒸发过多,琼脂糖易粘在容器底部,还会出现许多气泡,影响包埋组织的质量;二是注意控制包埋时溶解琼脂糖的温度,一般控制在50℃左右为宜;三是在进行包埋前,取出浸泡在10%中性甲醛中的大鼠胚胎脑,自来水充分冲洗残留的甲醛,吸干脑表面的水分,防止在切片时脑组织与琼脂糖分离;四是在包埋胚胎脑时,使胚胎嘴部朝向正上方,以保证脑片呈冠状面。操作时首先用镊子夹住组织放入包埋槽底部,缓慢倒入琼脂糖溶液,待浸没包埋槽底部后慢慢抽出镊子,继续倒入琼脂糖,使其完全覆盖组织,将包埋好的组织块置入冰箱冷藏室内40-60min,完全凝固后再置入10%中性甲醛溶液24h,以增加琼脂糖的硬度。如果使用其它组织可以适当调整在甲醛内浸泡时间,尽量使琼脂糖的硬度与组织相近,以免切片时组织与琼脂糖分离。倘若长时间浸泡,应及时更换甲醛液。
振动切片机是以切厚组织片为特点,固定和非固定组织均可。这种厚组织片不易贴附于载玻片染色,故采用漂染方法。切片前先用量角器调节刀片角度,一般不应小于20度,若角度不适当,刀片过度上翘,切片时后部的金属托挤压组织块,使组织碎裂;组织块修整后使用502胶将其固定在托盘上,随后加入0.01mol/L PBS浸没组织块即可切片。切片的速度和振幅需依据组织块的硬度和大小进行调节。若已切好的组织片不准备当天染色,可放入留有微量PBS平板孔中,4℃冰箱保存备用。此过程应注意如果切片在平板孔中浸泡时间过长,易使琼脂糖与组织分离,染色时不便于操作。
对于免疫荧光组织化学厚切片染色,欲达到理想的染色效果,关键问题在于如何使抗体进入细胞内和抑制非特异性反应[13]。本实验为使抗体能穿过细胞膜进入细胞内与细胞质中的中间丝蛋白结合,经反复摸索细胞膜打孔条件,最后确认使用高浓度去污剂,即3%TritonX-100,把装有脑片的平板孔放入恒温摇床中,20℃,孵育24h。在每一步骤后的漂洗中,使用含 0.1%TritonX-100的 PBS,并且增加漂洗次数,效果更佳。在控制非特异性反应方面,注意要分别使用与二抗种属相同的非免疫血清和2%BSA封闭,在一抗孵育和漂洗结束后再增加一次2%BSA封闭,以防止二抗发生的非特异性反应。一抗和二抗稀释液的配制也需加入一定量的BSA和低浓度的 Triton X-100,使得在加入一抗和二抗的同时,再次封闭非特异性反应。由于采用免疫荧光双重染色,同时加入两种不同种属的抗体,因此在配制抗体时,既要使所用稀释液符合第一种抗体的效价,又要同时符合第二种抗体的效价。此外,对照实验也很重要,除需设置一抗阴性对照和二抗阴性对照以外,还需设置阳性对照,以此来判定实验结果真实性和操作方法的正确性。免疫荧光组织化学染色的大部分步骤结束后均需充分漂洗切片,以去掉残留的试剂和未结合的抗体。在漂洗切片时,如使用吸管吹打,琼脂糖与脑片容易分离,可将装有组织片的平板孔放在微量振荡器上,利用振荡使脑片在漂洗液中缓慢旋转,起到充分漂洗的作用。
使用一般荧光显微镜不能观察免疫荧光染色的厚切片,因为激发光在标本的表层则被消耗掉,标本其余部分的荧光不能被激发。激光扫描共聚焦显微镜具有深度识别能力和纵向分辨力,可以弥补这一不足。激光扫描共聚焦显微镜逐层对脑片获得光学横断面图像,实现显微“CT”功能。它提供的图片信息甚至可能比几百张切片还要多。在这些图片信息中我们更直接地观察到 E14大鼠端脑神经祖细胞的增殖、分化,产生成神经细胞的过程。如果通过电穿孔把带有绿色荧光蛋白的逆转录病毒导入胚胎脑侧脑室,制备成脑片后在不同时间拍照,则能动态观察神经元发生和迁移,倘若把脑片实施免疫荧光化学染色,可以鉴别神经元类型[14,15]。因此,熟练掌握这项技术是深入研究胚胎脑发育和神经元发生不可缺少的。
[1]Kim B.Nguyen,Michael P. Pender.A simple technique for flat osmicating and flat embedding of immunolabelled vibratome sections of the rat spinal cord for light and electron microscopy.Journal of Neuroscience Methods,1996,65(1):51-54
[2]Evers,H.B.M. Uylings.Effects of microwave pretreatment on immunocytochemical staining of vibratome sections and tissue blocks of human cerebral cortex stored in formaldehyde fixative for long periods.Journal of Neuroscience Methods,1994,55(2):163-172
[3]Archana Hayaran,Veena Bijlani.Polyacrylamide as an infiltrating and embedding medium for vibratome sectioning of human fetal cerebellum containing Dil-filled axons.Journal of Neuroscience Methods,1992,42(1-2):65-68
[4]Inge Brounsa,Luc Van Nassauwa,Jeroen Van Genechtena et al.Triple Immunofluorescence Staining with Antibodies Raised in the Same Species to Study the Complex Innervation Pattern of Intrapulmonary Chemoreceptors. Journal of Histochemistry and Cytochemistry,2002,50:575-582
[5]Jeremy K. Brown,Alan D. Pemberton,Steven H.Wright et al.Primary Antibody-Fab Fragment Complexes:A Flexible Alternative to Traditional Direct and Indirect Immunolabeling Techniques.Journal ofHistochemistry and Cytochemistry,2004,52(9):1219-1230
[6]Inge Brouns,Jeroen Van Genechten,Hiroyuki Hayashi,et al.Dual Sensory Innervation of Pulmonary Neuroepithelial Bodies.American Journal of Respiratory Cell and Molecular Biology,2003,28:275-285
[7]Qing-Shan Xue,Larry Sparks and Wolfgang J Streit.Microglial activation in the hippocampus of hypercholesterolemic rabbits occurs independent of increased amyloid production. J Neuroinflammation. 2007,4:20
[8]Todd E Anthony,Corinna Klein and Gord Fishel et al.Radial Glia Serve as Neuronal Progenitors in All Regions of the Central Nervous System.Neuron,2004,41(6):881-890
[9]Magdalena Götz,Eva Hartfuss and Paolo Malatesta.Radial glial cells as neuronal precursors:a new perspective on the correlation of morphology and lineage restriction in the developing cerebral cortex of mice.Brain research bulletin,2002,57(6):777-788
[10]Christine Y B,Michael JR,Raymaond PR and et al.Roles of the mammalian subventricular zone in brain development.Progress in Neurobiology,2003,603 1-21
[11]Andrew C. Vendel,Mark D. Terry and Amelia R.Striegel et al.Alternative Splicing of the Voltage-Gated Ca2+Channelβ4 Subunit Creates a Uniquely Folded N-Terminal Protein Binding Domain with Cell-Specific Expression in the CerebellarCortex. Neuroscience,2006,26(10):2635-2644
[12]Angelique C.Paulk,James Phillips-Portillo and Andrew M. Dacks et al. The Processing of Color,Motion,and Stimulus Timing Are Anatomically Segregated in the Bumblebee Brain. The Journal of Neuroscience,2008,28(25):6319-6332
[13]Juan M.Luque,Javier Morante-Oria and Beat M.Riedererb et al.Whole-mount confocal immunofluorescence of mammalian CNS.Brain Research Protocols,2001,6(3):129-133
[14]R. Dickie,R.M. Bachoo,M.A. Rupnick et al.Three-dimensional visualization of microvessel architecture ofwhole-mounttissueby confocalmicroscopy.Microvascular Research,2006,72(1-2):20-26
[15]C.W. Jones,D. Smolinski,A. Keogh et al.Confocal laser scanning microscopy in orthopaedic research.Progress in Histochemistry and Cytochemistry,2005,40(1):1-11
Application of immunofluorescence double stainning technology for embryo brain slices to the study of neurogenesis
Ao Ran,Wu Meiyan,Zhao Hui,Zhou Li*,Chen Aijun
(Department ofHistology and Embryology,N ormen Bethune College of J ilin University,Changchun130021,China)
Objective To establish the double immunofluorescent staining technique for the embryonic brain slices to objectively observe the proliferation,differentiation and migration of neural progenitor cells in rat embryo brains.Methods Rat embryos of 14 days(E14)were fixed by perfusion.The brains were taken and embedded in low-melting agarose,then sliced with a vibratome,stained by double immunofluorescence and observed by using confocal laser scanning microscopy. Results Vimentin and choline acetyltransferase(ChAT)double positive cells showed yellow fluorescence their bodies located in the ventricle zone(VZ),and the radial long processes in the subventricle zone(SVZ).Only ChAT positive cells with red fluorescence were found in the cortex plate of dorsal telencephalon.Conclusion The morphology and identity of neural progenitor cells and neuroblasts are identified by using the technique,and their relationship can be analyzed by double immunofluorescent staining.
Embryonic brain slice; Immunofluorescence histochemistry; Neurogenesis
R329
A
10.3870/zgzzhx.2011.02.018
2010-10-10
2010-11-01
吉林大学本科生实验创新计划项目
敖然,女(1987年),汉族,七年制学生。
*通讯作者(To whom correspondence should be addressed)
