C反应蛋白真核表达质粒的构建、表达及其对小鼠血管平滑肌细胞 TNF-α表达的影响
2011-11-02李茂荣刘正湘
李茂荣刘正湘
(1北京航天总医院心血管内科,北京 100076;2华中科技大学同济医学院附属同济医院心血管内科,武汉 430030)
C反应蛋白真核表达质粒的构建、表达及其对小鼠血管平滑肌细胞 TNF-α表达的影响
李茂荣1刘正湘2*
(1北京航天总医院心血管内科,北京 100076;2华中科技大学同济医学院附属同济医院心血管内科,武汉 430030)
目的 构建小鼠C-反应蛋白基因重组质粒pIRES-CRP,观测其对血管平滑肌细胞 TNF-α表达的影响。方法用RT-PCR法,以小鼠肝组织RNA为模板,扩增获得编码C-反应蛋白(C-reactive protein,CRP)的全长基因。将CRP基因克隆入真核表达质粒pIRES中,构建重组真核表达质粒pIRES-CRP。将重组质粒转染 HeLa细胞,通过 RT-PCR法检测CRPmRNA的表达,Western blot检测CRP蛋白的表达。将阳性质粒转染小鼠血管平滑肌细胞,通过Western blot检测CRP对 TNF-α表达的影响。结果 经酶切鉴定、PCR和测序分析结果表明,所克隆的CRP基因与报道结果完全一致,重组体的连接方向正确,阅读框与预期完全一致,真核表达质粒pIRES-CRP构建成功。将重组质粒pIRES-CRP瞬时转染 Hela细胞,通过RT-PCR和Western blot证实CRP基因得到表达。将阳性质粒转染小鼠血管平滑肌细胞,TNF-α的表达明显高于空白对照组和空载体组(P<0.01)。结论 成功构建小鼠CRP基因重组质粒pIRES-CRP,CRP基因能在人子宫颈癌Hela细胞中正常转录和翻译,表达的蛋白能与CRP的特异抗体反应。CRP能明显上调小鼠血管平滑肌细胞 TNF-α的表达,这为解释CRP在冠状动脉的形成过程中起着促炎作用提供了新的实验依据。
小鼠肝细胞 ; 小鼠血管平滑肌细胞; C-反应蛋白; TNF-α; 基因表达
C-反应蛋白(CRP)是一种非特异性全身炎症标志物,与许多慢性疾病的发病机制有关,包括糖尿病(DM)、癌症、老年痴呆症、心血管(CV)疾病。事实上,全身循环高灵敏度C反应蛋白的测量一直作为动脉粥样硬化、充血性心力衰竭、房颤、心肌炎、主动脉瓣疾病和心脏移植预后的一种指标。CRP主要由肝细胞合成,受白介素,TNF等炎症因子的调节。正常血浆水平低于5mg/L。当机体有创伤、感染、缺血坏死、炎症及恶性肿瘤等刺激时,发生急相反应。病变部位激活的细胞产生胞内信号多肽-细胞因子,刺激急相反应蛋白的生成。CRP是最主要的急性期蛋白,在急性反应期其血清水平迅速升高,可达正常水平的数百倍,乃至上千倍[1-2]。但迄今为止,人们对CRP的具体功能尚未完全认识,其生理作用有待进一步研究。另外CRP在心血管疾病发生发展过程中是因还是果也有待研究[1,3]。
近年的研究表明,CRP不仅是一种炎性标志物,而且也调节其他炎性细胞因子的表达。TNF-α是与动脉粥样硬化发病有关的主要炎性介质。为此我们采用 RT-PCR技术将小鼠CRP基因扩增出来,利用基因工程技术将其克隆入真核表达载体pIRES中,构建重组质粒pIRES-CRP,观察其在真核细胞的表达及对TNF-α表达的影响,为深入研究该蛋白的生理功能及其与心血管疾病的关系奠定基础。
材料和方法
1.菌株与实验动物
大肠埃希菌DH5α,pIRES质粒,人子宫颈癌(Hela)细胞由本室保存。8周龄BALB/c小鼠购于同济医学院实验动物学部。
2.酶与主要试剂
限制性内切酶、T4DNA连接酶购自 Takara公司,DNA聚合酶、DNA Marker购自华美生物工程公司,Trizol试剂为上海华舜生物工程公司产品,逆转录酶和RNA酶抑制剂是 Toyobo公司产品。脂质体Lipofectamine 2000购自 Invitrogen公司,兔抗小鼠CRP和 TNF-α单克隆抗体购自北京天为时代生物工程公司,羊抗兔酶标二抗购自武汉博士德生物工程有限公司,抗 GAPDH购自 Santa Cruz Biotechnology公司,细胞基础培养基 DMEM(高糖)、胎牛血清购自 HYCLONE公司。
3.重组质粒pIRES-CRP的构建
采用TRIzol试剂从小鼠新鲜肝组织中提取总RNA,通过逆转录反应合成cDNA,再以此cDNA为模板,利用CRP基因的上、下游引物(上游引物:5′-TTTCGCTA GCA TGGAGAAGCTACTCTGG-3′;下游 引物 :5′-GAACGAA TTCTCAGGACCACAGCTGCG-3′;上游引物 5’端引入 N heⅠ酶切位点,下游引物 5’端引入 EcoRⅠ酶切位点)扩增出CRP基因。将上述扩增的CRP基因及质粒pIRES分别用 N heⅠ和 EcoRⅠ双酶切后,回收大片段,利用T4 DNA连接酶连接,连接产物转化感受态 E-.coli DH5α,接种于含有氨苄青霉素 (100μg/ml)的LB平板上筛选,随机挑选4个阳性克隆进行菌落PCR鉴定,提取质粒DNA进行 N heⅠ/EcoRⅠ双酶切鉴定及测序鉴定。
4. RT-PCR和Western blot检测CRP在 Hela细胞的表达
按照Lipofectamine 2000转染试剂说明书,先将处于对数生长期的 Hela细胞按4×105/每孔 的密度置入六孔板,24h后将重组质粒pIRES-CRP转染 Hela细胞,同时设立阴性对照(转染空质粒pIRES)及空白对照(未转染的 Hela细胞)。转染后每孔加入1 ml TRIzol,提取总RNA。以总RNA为模板,加入CRP上下游引物和人β-Actin上下游引物各10pmol/μl,进行 RT-PCR扩增,产物用2%琼脂糖凝胶电泳检测。将重组质粒转染的 Hela细胞离心后去上清,加入2×上样缓冲液,冻融2次,煮沸5min,进行 SDS-PAGE蛋白电泳。在上样孔分别加入转染重组质粒的细胞,转染空质粒的细胞和未转染任何质粒的细胞的裂解液,并且加入分子量Marker进行 SDS-PAGE蛋白电泳,将蛋白质从SDS-PAGE凝胶转移到硝酸纤维素滤膜上,封闭,依次加入兔抗鼠CRP一抗和羊抗兔酶标二抗,然后用ECL显色。内参为 GAPDH。
5.血管平滑肌细胞的培养与鉴定
采用改良贴壁法,选择体重为 20g左右的BALB/c小鼠,用拉颈法处死动物,无菌条件下取出主动脉,用DMEM高糖培养基洗2次以除净血液,置于培养皿中,迅速撕除外膜并弃之。在培养液中将血管剪成约1mm的组织,移入2ml培养瓶,加入含10%胎牛血清的DMEM培养基,置37℃,5%CO2孵箱内静置培养4d后换液,待细胞长满瓶底后用0.25%胰蛋白酶消化传代。实验采用3-5代细胞。
血管平滑肌细胞的鉴定:光镜下细胞呈谷峰样生长,特异性平滑肌α-肌动蛋白单克隆抗体免疫细胞化学染色见胞浆呈阳性染色。
6.Western blot检测CRP对血管平滑肌细胞TNF-α表达的影响
按照Lipofectamine 2000转染试剂说明书,先将处于对数生长期的血管平滑肌细胞按4×105/每孔的密度置入六孔板,24h后将重组质粒pIRESCRP转染血管平滑肌细胞,同时设立阴性对照(转染空质粒pIRES)及空白对照(未转染的血管平滑肌细胞)。转染后细胞离心后去上清,加入2×上样缓冲液,冻融 2次,煮沸 5min,进行 SDS-PAGE蛋白电泳。在上样孔分别加入转染重组质粒的细胞,转染空质粒的细胞和未转染任何质粒的细胞的裂解液,并且加入分子量Marker进行 SDS-PAGE蛋白电泳,将蛋白质从SDS-PAGE凝胶转移到硝酸纤维素滤膜上,封闭,依次加入兔抗鼠 TNF-α一抗和羊抗兔酶标二抗,然后用 ECL显色。内参为 GAPDH。实验重复3次,计算机软件分析灰度值。
7.统计学处理
结 果
1.重组质粒pIRES-CRP的鉴定
挑选阳性克隆进行扩增,提取质粒pIRESCRP,用 N heⅠ/EcoRⅠ双酶切可得到长约678bp小片段--即CRP,进行菌液 PCR扩增也得到了相应条带,表明重组质粒pIRES-CRP构建成功,(见图1,2)。使用通用引物对插入片段进行两个方向测序,双向测序结果相吻合,测序结果经BLAST分析,与小鼠CRP基因序列相吻合(见图3)。
2.重组质粒pIRES-CRP在子宫颈癌 Hela细胞中的表达鉴定
2.1 RT-PCR检测CRP的表达

图1 重组质粒pIRES-CRP的双酶切鉴定M1:1 kb Marker;M2:100bpMarker Lane1:1.pIRESCRP双酶切鉴定 (N heI+EcoRI)Fig.1 Restriction enzymes maps of recombinant plasmid pIRES-CRPM:1 kb Marker;M2:100bpMarkerLane1:restriction enzymes map of pIRES-CRP(NheI+EcoRI),

图2 重组质粒pIRES-CRP的PCR鉴定M:100bp Marker;Lane1:重组质粒的PCR产物;Lane 2:含重组质粒的菌液PCR产物Fig.2 PCR amplification ofrecombinantplasmid pIRES-CRPM:100bp Marker;Lane1:PCR amplification of pIRES-CRP;Lane 2:PCR amplification of Bacilli containing recombinant plasmid
以空质粒pIRES转染和不进行转染的 Hela细胞作为对照,提取转染细胞的RNA进行RT-PCR鉴定,结果发现只有转染了重组质粒pIRES-CRP的Hela细胞可扩增出大小约700bp CRP基因片段,对照组未扩增出相应的基因片段。(见图4)。

图4 pIRES-CRP在 Hela细胞中表达的RT-PCR鉴定M:100bp Marker;Lane1:pIRES-CRP转染 Hela细胞(内参为β-actin);Lane2:pIRES质粒转染的 Hela细胞(内参为β-actin);Lane3:未转染的 Hela细胞(内参为β-actin);Fig.4 CRP expression of pIRES-CRP in Hela cells identified by RT-PCRM:100bp Marker;Lane1:Hela cells transfected with pIRES-CRP;Lane 2:Hela cells transfected with pIRES;Lane 3:Hela cells untransfected

图3 CRP的测序鉴定(通过BLAST正反测序,得到下列图谱,其中有一处是两次测序结果拼接而成)Fig.3 Sequencing of CRP
2.2 Western blot检测CRP蛋白的表达
重组质粒pIRES-CRP转染 Hela细胞后,收集细胞进行裂解,离心收集上清,按常规方法进行SDSPAGE电泳、转膜、封闭,加入兔抗鼠CRP一抗和羊抗兔酶标二抗,然后用ECL显色。结果显示:pIRES-CRP转染的Hela细胞检测到CRP的表达,对照组未检测到CRP的表达,表明重组质粒pIRES-CRP能在 Hela细胞表达。(见图5)。

图5 CRP在 Hela细胞中表达的Western blot分析Lane1:未转染的 Hela细胞 ;Lane2:pIRES质粒转染的 Hela细胞;Lane3:pIRES-CRP转染 Hela细胞Fig5 CRP expression of pIRES-CRP in Hela cells identified by Western blotLane1:Hela cells untransfected;Lane 2:Hela cells transfected with pIRES;Lane 3:Hela cells transfected with pIRES-CRP
2.3 重组质粒pIRES-CRP对血管平滑肌细胞TNF-α表达的影响
重组质粒pIRES-CRP转染血管平滑肌细胞后,收集细胞进行裂解,离心收集上清,按常规方法进行SDS-PAGE电泳、转膜、封闭,依次加入兔抗鼠TNF-α一抗和羊抗兔酶标二抗,然后用 ECL显色。计算机软件分析灰度值。结果表明,pIRES-CRP转染组,pIRES空质粒转染组及未转染质粒空白对照组的 TNF-α与 GAPDH蛋白表达灰度植分别为0.496 ±0.08,0.184 ±0.03,0.113 ±0.027。pIRESCRP转染组 TNF-α的表达水平显著高于其它各组(P<0.01)。
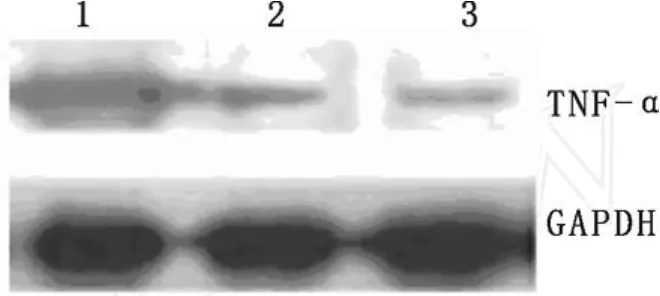
图6 pIRES-CRP质粒对 TNF-α表达的影响Lane1:pIRES-CRP质粒转染的血管平滑肌细胞;Lane2:pIRES质粒转染的血管平滑肌细胞;Lane3:未转染的转染的血管平滑肌细胞Fig.6 Effect of pIRES-CRP Plasmid on the expression of TNF-αLane1:mouse aortic smooth muscle cells transfected with pIRES-CRP;Lane 2:mouse aortic smooth muscle cells transfected with pIRES;Lane 3:mouse aortic smooth muscle cells untransfected
讨 论
CRP是一种炎症反应时的急性时相蛋白,因其能与肺炎双球菌细胞壁上的C多糖结合而得名。属结构上非常保守的穿透素蛋白家族成员,由5个完全相同的非糖基化亚单位通过非共价键相连,每个亚单位由206个氨基酸组成,分子量23kD。它不仅是炎症标志物,而且本身直接参与炎症过程[3-4]。当感染和组织损伤时可激活巨噬细胞和其他白细胞等,这些细胞产生白细胞介素-6(IL-6)、白细胞介素-1(IL-1)及肿瘤坏死因子-α(TNF-α)等细胞因子。这些细胞因子和其他介导物质到达肝脏,刺激肝细胞和上皮细胞合成CRP,外周血淋巴细胞亦能合成少量CRP[3]。它通过经典途径激活补体,释放炎症介质,促进粘附和吞噬细胞反应,使靶细胞溶解;作用淋巴细胞和单核细胞受体,致淋巴细胞坏死、增生,促进淋巴因子生成,并促进抑制性 T淋巴细胞增生,也增强了吞噬细胞的吞噬作用;抑制血小板的聚集和释放反应,还能妨碍血小板引起血管收缩;刺激单核细胞表面的组织因子表达和其它免疫调控功能。此外,CRP浓度的增高是导致心血管疾病的直接因素,它的增高不仅仅是一种伴随现象,研究表明在纠正了其他危险因子后,CRP浓度的增高仍是心血管疾病的独立危险因子[1,6,7]。
CRP原本是一个非特异的炎性标志物,但最近的许多研究提示CRP可能在冠状动脉的形成、发展和演变过程中起着直接的病理生理作用[8-9],其机制包括:刺激内皮细胞分泌 E-选择素、细胞间粘附分子、血管粘附分子、血小板趋化因子、白细胞介素-6;调节动脉壁内多种细胞及循环中单核细胞,促进炎性因子的分泌;调节巨噬细胞摄取低密度脂蛋白,然后变为泡沫细胞;增强其他炎性介质的炎性效应;促进血管内皮细胞增生、迁移、动脉内膜增厚,抑制内皮细胞的生存与分化,参与动脉硬化的发生发展过程。CRP也是急性冠脉综合症斑块破裂的决定因素。即使没有血脂异常、高血压、吸烟史、糖尿病和冠心病家族史,CRP也是冠心病的独立预测因子和心肌梗死的危险因子。检测CRP可提高传统危险因子的预测价值[10-12]。近期的研究表明,CRP通过刺激IL-6的产生,抑制过氧化物酶体增殖物激活受体γ表达,在动脉粥样硬化形成中具有促炎作用[13]。
但迄今为止,人们对CRP的具体功能尚未完全认识,因此深入研究其生理作用具有十分重要的意义。是CRP水平的升高引起了心血管疾病的发生与发展,还是心血管疾病的产生引起了CRP水平的升高也有待研究[3],CRP与其他炎性细胞因子的关系亦有待研究。为了深入研究CRP的作用机制,研究采用重组DNA技术,将编码CRP蛋白基因克隆入真核表达载体pIRES中,构建成真核表达质粒pIRES-CRP。将重组质粒pIRES-CRP瞬时转染Hela细胞,通过 RT-PCR和 Western blot证实 C-反应蛋白基因得到表达,表达的蛋白能与CRP的特异抗体反应。
TNF-α具有多种生物学作用,一方面参与机体的免疫防御功能,维持机体的稳态及抵御各种致病因子,可选择杀伤肿瘤细胞;另一方面 TNF-α的异常分泌又可介导休克、炎症反应、组织损伤等病理生理反应,参与细胞的凋亡过程。在动脉粥样硬化的发生发展过程中,TNF-α作为炎性细胞因子可能扮演了重要角色,但 TNF-α与CRP的关系并不十分清楚。以前人们认为当感染和组织损伤时,巨噬细胞和其他白细胞分泌 TNF-α及其他细胞因子,刺激肝细胞和上皮细胞合成CRP。但我们的实验发现,CRP可刺激血管平滑肌细胞表达TNF-α,表明CRP水平升高可加速 TNF-α的产生,促进炎症反应,从而为解释CRP在冠状动脉病变的形成、发展和演变过程中起着直接的病理生理作用提供了新的实验依据。
[1]Lavie CJ,Milani RV,Verma A,et al.C-reactive protein and cardiovascular diseases-is it ready for primetime?Am J Med Sci,2009,338(6):486-492
[2]Kaptoge S,Di Angelantonio E,Lowe G,et al.C-reactive protein concentration and risk of coronary heart disease,stroke,and mortality:an individual participant meta-analysis.Lancet,2010,375(9709):132-140
[3]Nordestgaard BG.Does elevated C-reactive protein cause human atherosclerosis?Novel insights from genetics,intervention trials,and elsewhere.Curr Opin Lipdol,2009,5:393-401
[4]Eisenhardt SU,Habersberger J,Peter K.Monomeric CReactive Protein Generation on Activated Platelets:The Missing Link Between Inflammation and Atherothrombotic Risk.Trends Cardiovasc Med,2009,19(7):232-237
[5]Singh SK,Suresh MV,Hammond DJ Jr,et al.Binding of the monomeric form of C-reactive protein to enzymatically-modified low-density lipoprotein:Effects of phosphoethanolamine,Clin Chim Acta,2009,406(1-2):151-155
[6]Ryan S,Taylor CT,McNicholas WT.Systemic inflammation:a key factor in the pathogenesis of cardiovascular complications in obstructive sleep apnoea syndrome?Postgrad Med J,2009,85(1010):693-698
[7]Sattar N,Murray HM,McConnachie A,et al.C-reactive protein and prediction of coronary heart disease and global vascularevents in the Prospective Study of Pravastatin in the Elderly at Risk(PROSPER).Circulation,2007,115:981-989
[8]Kubo T,Matsuo Y,Hayashi Y,et al.High-sensitivity C-reactive protein and plaque composition in patients with stable angina pectoris:a virtual histology intravascular ultrasound study.Coronary Artery Disease,2009,20(8):531-535
[9]Nakou ES,Liberopoulos EN,Milionis HJ,et al.The role of C-reactive protein in atherosclerotic cardiovascular disease:an overview.Curr Vasc Pharmacol,2008,6(4):258-270
[10]Osman R,L’Allier PL,Elgharib N,et al. Critical appraisal of C-reactive protein throughout the spectrum of cardiovascular disease.Vasc Health Risk Manag,2006,2(3):221-237
[11]Fujila Y,Kakino A,Harada-Shiba M,et al.C-reactive protein uptake by macrophage cell line via class-A scavenger receptor.Clin Chem,2010,56(3):478-481
[12]Devaraj S,Xu DY,Jialal I.C-reactive protein increases plasminogen activator inhibitor-1 expression and activity in human aortic endothelial cells:implications for the metabolic syndrome and atherothrombosis.Circulation,2003,107:398-404
[13]Na Liu,Liu J T,Ji YY,et al C-reactive protein triggers inflammatory responses partly via TLR4/IRF3/NF-κB signaling pathway in ratvascularsmooth muscle cells.Life Sci,2010,87(11-12):367-374
Construction and exprerssion of mouse C-reactive protein eukaraotic plasmid and its effect on TNF-αexpression in mouse aortic smooth muscle cells
Li Maorong1Liu Zhengxiang2﹡
(1Department of Cardiology,Beijing Aerospace General Hospital,Beijing100076;2Department of Cardiology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,W uhan430030,China)
Objective To obtain the full length gene of C-reactive protein(CRP)from mouse liver cells,to construct the recombination plasmid pIRES-CRP and to investigate its effect on TNF-αExpression in mouse aortic smooth muscle cells.Methods CRP genes were obtained by RT-PCR with total RNA of mouse as the template and cloned into the eukaryotic expression plasmid pIRES to construct the recombinant plasmid pIRES-CRP.After the recombinant plasmid pIRES-CRP was transfected into Hela cells,the expression of CRP genes was detected by using RT-PCR and Western blot. The expression of TNF-α genes was detected by using Western blot when the recombinant plasmid pIRES-CRP was transfected into mouse aortic smooth muscle cells.Results Restriction enzyme analysis,PCR and sequencing results showed that the recombinant plasmid pIRES-CRP was constructed successfully.After the recombinant plasmid pIRESCRP was transfected into Hela cells,the expression of CRP genes could be detected by RT-PCR and Western blot. The expression of TNF-α genes was significantly higher than that in the control group and the vector group(P<0.01)when the recombinant plasmid pIRES-CRP was transfected into mouse aortic smooth muscle cells.Conclusion The eukaryotic expression plasmid pIRES-CRP was constructed successfully and CRP genes of mice were expressed in Hela cells by this vector. The expression of TNF-α genes of mouse aortic smooth muscle cells can be promoted by CRP,which provides new evidence for the pro-inflammatory action of CRP in atherogenesis.
Mouse liver cell; Mouse aortic smooth muscle cell; C-reactive protein;TNF-α;Gene expression
R329
A
10.3870/zgzzhx.2011.01.003
2010-10-10
2010-12-01
李茂荣,男(1968年),汉族,硕士,副主任医师
*通讯作者(To whom correspondence should be addressed)
