β-catenin在食管鳞癌中的异常表达及临床意义
2011-11-02王金胜武纪爱芳任宏政文继舫
王金胜 魏 武纪爱芳 任宏政文继舫
(长治医学院附属和平医院中心实验室,山西 046000;1中南大学湘雅医学院病理学系,长沙 410008)
β-catenin在食管鳞癌中的异常表达及临床意义
王金胜 魏 武*纪爱芳 任宏政1文继舫1
(长治医学院附属和平医院中心实验室,山西 046000;1中南大学湘雅医学院病理学系,长沙 410008)
目的 探讨β-catenin基因在食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)中的表达及其意义。方法 免疫组化法检测65例ESCC及20例因ESCC手术切除的远切端正常食管黏膜组织中β-catenin的表达及定位,分析其与临床病理学参数的关系;RT-PCR检测31例新鲜ESCC及相应的远切断正常食管黏膜组织中β-catenin mRNA的表达。结果 免疫组化结果显示:在20例因ESCC手术切除的远切端正常食管黏膜组织中,β-catenin主要位于胞膜;在65例ESCC组织中,β-catenin的胞质积累阳性率为63.1%,胞核积累阳性率为30.8%;β-catenin的胞质/核积累与淋巴结转移相关(P=0.005),但与患者的年龄、性别、肿瘤的分化程度及浸润深度等无关。RT-PCR结果显示:在31例ESCC及相应的远切端正常食管黏膜组织中,均检测到β-catenin mRNA的表达,与相应的远切端正常食管黏膜组织比较,癌组织中β-catenin基因mRNA的表达水平明显升高(P=0.037),其中表达升高的21例,占67.7%,表达无明显差异的8例,占25.8%,表达降低的2例,占6.5%。结论 在 ESCC中存在β-catenin mRNA表达水平的升高以及β-catenin蛋白的异常胞质/胞核积累,并与淋巴结转移有关。
食管鳞状细胞癌; β-catenin; 淋巴结转移; 免疫组织化学
近年来研究表明,Wnt信号通路异常激活与结直肠癌、肝癌、乳腺癌、子宫内膜癌、卵巢癌、前列腺癌等恶性肿瘤的发生发展密切相关。β-catenin是Wnt信号通路的关键枢纽分子之一,它在胞质内的积累和核转位是该信号通路激活的关键。近年来研究表明,在部分食管癌中存在β-catenin异常的细胞质/核的积累[1~4],并且β-catenin的异常胞质/核积累与Wnt途径下游靶基因 MMP-7[2]、MMP-26[3]、垂体瘤转化基因[4]等的表达相关。我们利用免疫组织化学技术检测了65例食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)组织以及20例正常食管黏膜组织中β-catenin的表达和定位,RT-PCR检测了31例ESCC及其相应的正常黏膜组织中β-catenin mRNA的表达,旨在进一步探讨β-catenin在ESCC发生发展中的作用。
材料和方法
1.材料
1.1 石蜡标本
复查2004年1月至2005年7月山西省长治医学院附属和平医院病理科存档的 ESCC标本共65例,术前均未接受过化疗和放疗。其中男性36例,女性29例,年龄37-76岁,平均年龄为56.3岁。病理分级采用 WHO(1996)分类法,根据分化程度不同分为高,中,低三级,其中21例为高分化癌,32例为中分化癌,12例为低分化癌,临床病理资料完整,全部经病理检查确诊。另取20例因ESCC手术切除的远端食管黏膜组织,经病理诊断证实为正常食管黏膜。
1.2 新鲜手术标本
收集山西省长治医学院附属和平医院肿瘤组织标本库中2006年4月-6月手术切除的 ESCC新鲜组织31例,其中男性21例,女性10例,年龄42-74岁,平均年龄为57.4岁。无菌状态下切取约0.5cm×0.5cm×0.8cm大小的癌组织(高分化癌8例,中分化19癌例,低分化癌4例)及相应切端选取正常食管黏膜。标本取下后立即以液氮速冻并保存,RT-PCR检测备用;部分标本用10%中性福尔马林固定,组织学诊断备用。
1.3 试剂
β-catenin鼠抗人单克隆抗体(工作浓度为1∶200),美国 Chemicion;Trizol试剂,美国 Invitrogen;免疫组化检测试剂盒 SP-9000及 DAB Kit(ZLI-9032②)购自北京中衫金桥公司;逆转录试剂盒为美国Fermentas产品;DNA序列由上海生工生物工程技术服务有限公司合成。
2.方法
2.1 免疫组织化学染色
用SP法检测β-catenin蛋白的表达,操作按试剂盒说明书进行。用已知阳性片作为阳性对照,用PBS替代一抗作阴性对照。采用p H6.0的枸橼酸盐缓冲液经中火档微波处理进行抗原修复,各批次实验均设阳性和阴性对照片以评判批间差异。
2.2 结果判断
参照Zhou[5]等的判定标准。以细胞膜或胞质或胞核染为黄色者定为阳性信号。根据切片中阳性信号定位不同的细胞所占比例将结果分类:细胞膜表达为主指阳性信号集中在细胞膜的细胞>50%;细胞质表达为主指阳性信号集中在细胞质的细胞>50%;有核定位指阳性信号在细胞核的细胞≥1。
2.3 RT-PCR
用 Trizol试剂抽提组织总RNA。取少量RNA于1.2%的琼脂糖凝胶电泳,检测抽提的 RNA质量。测定各组细胞 RNA浓度后取 2μg RNA,按AMV试剂盒说明进行逆转录反应。以逆转录产物为模版进行 PCR反应,条件如下:95℃预变性5min,94℃变性 50sec,60℃退火 40sec,72℃延伸40sec,共30个循环,最后72℃延伸10min。引物序列为β-catenin[6]正义链:5′-AAGGTCTGAGGAGCAGCTTC-3′,反义链:5’-GTGAAGATCTGCGTCTGCTTGG-3’,扩增片断长度为 668 bp;β-actin 正义链:5’-A GTTGCGTTACACCCTTTCTTG-3’,反义链:5’-TCACCTTCACCGTTCCAGTTT-3’,扩增片断长度为150bp。产物进行1.5%琼脂糖凝胶电泳,紫外光分析仪上观察、照相。采用凝胶图像处理软件 ImageTool(IT)3.0测量各条带的光密度值,计算目的基因mRNA表达的相对值(mRNA表达的相对值 =β-catenin光密度值/β-actin光密度值)。当癌组织/正常黏膜的比值大于>1.2时,为表达升高;当比值介于0.8-1.2时,为表达无变化;当比值<0.8,为表达降低。
3.统计学处理
免疫组织化学结果分析采用卡方检验,ESCC组织与正常黏膜组织β-catenin基因mRNA的表达水平的比较采用非参数秩和检验,以 P<0.05时确定差异具有统计学意义。
结 果
1.β-catenin蛋白在正常食管黏膜及 ESCC组织中的表达
在正常食管黏膜上皮中,β-catenin蛋白均匀分布于细胞膜,胞质(核)未见明显的阳性信号。在ESCC组织中,β-catenin蛋白在胞质弥散表达,可见部分细胞中的核定位,而细胞膜上的表达量减少,有些病例甚至检测不到。此外,同一肿瘤标本,部分区域β-catenin蛋白强表达,而部分区域表达却很弱,甚至不能被检测出;即使在同一癌巢的不同区域,βcatenin蛋白的表达水平也存在差异,呈现明显的异质性(表 1,图 1-5)。

表1 β-catenin蛋白在食管鳞癌中的表达及定位Table 1 Expression and Location ofβ-catenin in ESCC
2.β-catenin蛋白表达与ESCC临床病理学参数的关系
分析65例 ESCC中β-catenin蛋白胞质/核积累与患者的性别、年龄、肿瘤的分化程度、浸润深度、淋巴结转移等临床病理学参数的关系,发现β-catenin的胞质/核积累与淋巴结转移相关(P=0.005),但与患者的年龄、性别、肿瘤的分化程度及浸润深度等无关(表2)。
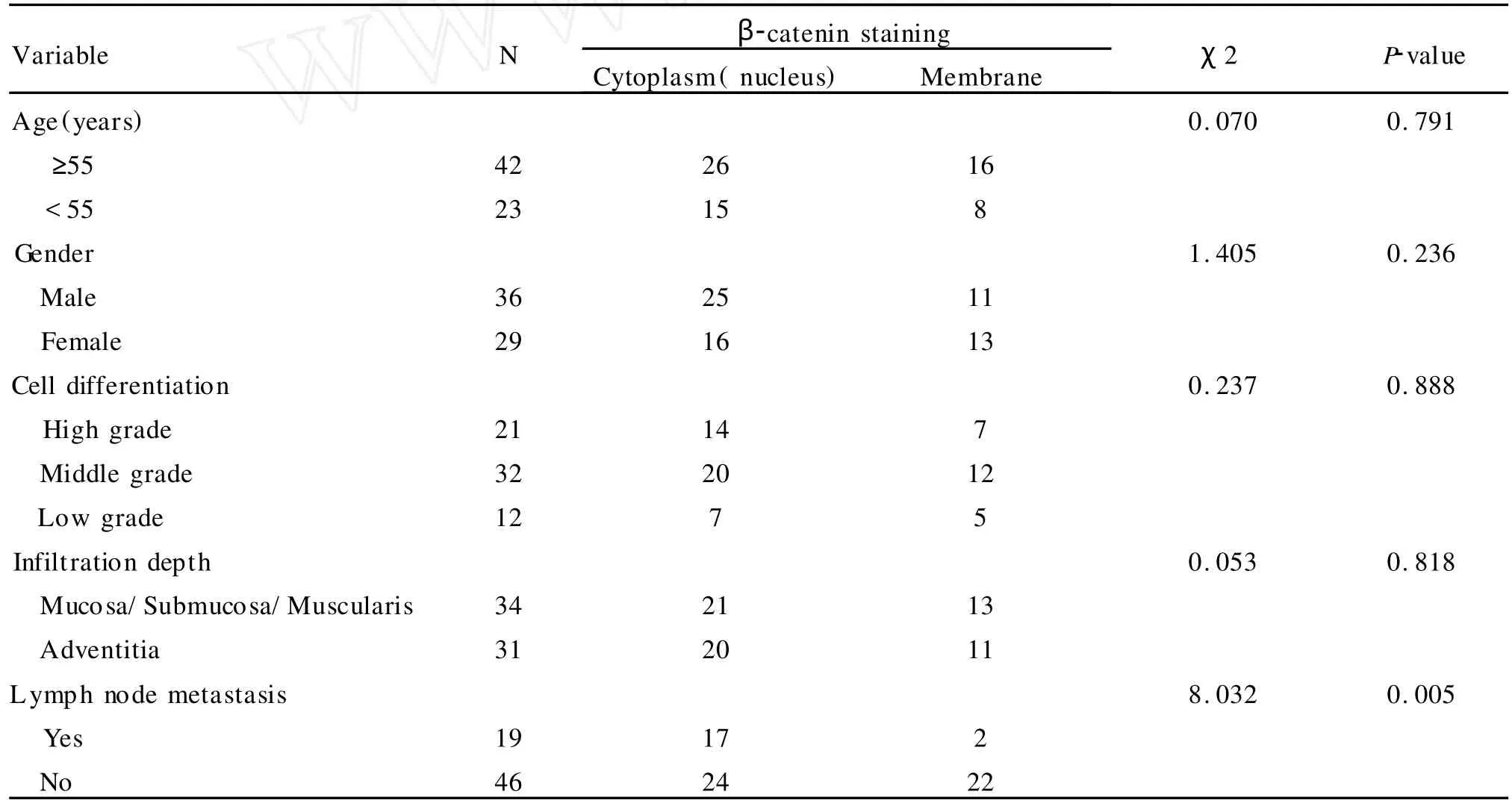
表2 β-catenin蛋白表达与食管鳞癌临床病理学参数的关系Table 2 Correlation ofβ-catenin expression with ESCC clinicopathological parameters
3.RT-PCR检测β-catenin在 ESCC和正常食管黏膜组织中的表达
RT-PCR结果显示(图6):在31例 ESCC组织及相应的正常食管黏膜组织中,均检测到β-catenin基因mRNA水平的表达。与相应的正常食管黏膜组织相比较,表达升高的21例,占67.7%,表达无明显差异的8例,占25.8%,表达降低的2例,占6.5%。癌组织中β-catenin基因mRNA的表达水平较正常食管黏膜组织明显升高(P=0.037),提示在β-catenin在 ESCC的发生、发展过程中可能具有重要的作用。
讨 论
研究表明,β-catenin在细胞内主要有两方面的功能:一是组成上皮细胞粘附/肌动蛋白细胞骨架网络的结构组分,参与细胞之间的粘附[7];二是游离的β-catenin作为Wnt信号通路的关键分子,将信号导入细胞核而在基因转录中起作用[8]。在分化成熟的正常细胞中,β-catenin主要定位于细胞膜,胞质中游离的β-catenin维持在极低的水平,由 Wnt信号调节。目前,β-catenin被视为原癌基因编码的蛋白质,它在胞质内的积累是 Wnt信号通路激活的关键[9]。
应用免疫组化检测 ESCC中β-catenin的表达及定位的研究已见报道。由于判定标准的不同,报道的β-catenin的胞质(核)阳性率存在较大的差异,胞质阳性率在31.8%到71.0%之间不等,而胞核阳性率介于8.0-35.3%之间[5,10-17]。我们采用Zhou[5]等的判定标准,发现β-catenin的胞质阳性率为63.1%(41/65),胞核阳性率为30.8%(20/65)。在结直肠癌中,β-catenin第3外显子突变、APC基因突变、Axin突变等均可导致β-catenin的异常胞质/胞核积累[18-20]。然而 APC、Axin、β-catenin 等 Wnt信号途径分子在 ESCC中发生突变的频率均极低[10-13,21-24]。因此,在 ESCC中可能某种独立于APC、Axin、β-catenin 等 Wnt信号途径分子突变之外的原因介导了的Wnt/β-catenin信号途径的异常激活。Wang等[17]发现在 ESCC细胞系 EC9706中,End-binding蛋白1(EB1)通过与APC蛋白相互作用 ,影响由 APC、GSK-3β、axin/conductin 和βcatenin组成的多蛋白复合体介导的β-catenin的降解,导致β-catenin胞质积累、核转位及β-catenin/TCF转录活性增加。Deng等[25]发现β-catenin与靶基因结缔组织生长因子(CTGF)之间存在一个正反馈环,CTGF在 ESCC细胞中过表达能引起βcatenin的胞质/胞核的积累,导致β-catenin-Tcf/Lef信号通路激活。
Kimura等[26]研究发现,在部分 ESCC中,胞质中可溶性的β-catenin的含量明显高于正常食管黏膜。我们应用 RT-PCR检测了31例 ESCC中βcatenin基因在转录水平的表达,发现与正常食管黏膜比较,67.7%的 ESCC中存在β-catenin mRNA表达水平的升高。Lv等[27]的研究表明,β-catenin mRNA在ESCC癌组织中的表达显著高于临近的正常食管粘膜组织,并且β-catenin mRNA的过表达与淋巴结转移和临床病理分(期)级相关。因此,除了上述的影响β-catenin胞质积累的因素之外,βcatenin基因扩增也可能与β-catenin在 ESCC中的异常表达有关。我们前期研究证实 ESCC细胞系Eca-109细胞中存在β-catenin的过表达和异常的细胞质/核定位,抑制β-catenin的表达能显著抑制其增殖[28]。
目前,关于β-catenin胞质/核积累和 (或)βcatenin胞膜表达水平的降低与 ESCC临床病理学参数的关系尚存在不同的研究结果。De Castro J[11]发现β-catenin的表达模式(核表达与膜表达)与肿瘤分期、分化程度、对化疗的敏感性、生存率等无关;膜表达水平(正常与减少)与肿瘤的分期分级、生存率等也无关。Kudo J[13]的研究也发现β-catenin胞核积累与肿瘤大小、肿瘤分期、分化程度、淋巴结转移、对化疗的敏感性、生存率等无关。我们的研究结果表明,β-catenin胞质/核积累与患者的年龄、性别、肿瘤分化程度、浸润深度等无关,与淋巴结转移显著相关(χ2=8.032,P=0.005),与 Zhang等[16]和Zhou等[5]的研究结果相一致。Zhang等[16]的研究表明,ESCC中 E-cadherin胞膜表达减少与βcatenin的胞膜表达减少和胞质积累有关,并导致E-cadherin/cat复合体解聚,细胞黏附减弱,从而促进了肿瘤细胞的浸润与转移。Yamamoto[14]等的研究发现β-catenin胞核积累与下游靶基因MMP-26的表达正相关,MMP-26在ESCC中高表达且通过激活MMP-9酶原参与淋巴结转移。
[1]Patel M,Ferry K,Franceschi D,et al.Esophageal carcinoma:currentcontroversialtopics. CancerInvest,2004,22(6):897-912
[2]Lu SH.Alterations of oncogenes and tumor suppressor genes in esophageal cancer in China.Mutat Res,2000,462(2-3):343-353
[3]McCabe ML,Dlamini Z.The molecular mechanisms of oesophageal cancer.Int Immunopharmacol,2005,5(7-8):1113-1130
[4]Jemal A,Siegel R,Ward E,et al.Cancer statistics.2007.CA Cancer J Clin,2007,57(1):43-66
[5]Zhou XB,Lu N,Zhang W,et al.Expression and significance of beta-catenin in esophageal carcinoma.Ai Zheng,2002,21(8):877-880
[6]Yokoyama K,Kamata N,Hayashi E,et al.Reverse correlation ofE-cadherin and snail expression in oral squamous cell carcinoma cells in vitro.Oral Oncol,2001,37(1):65-71
[7]Bienz M,Clevers H.Linking colorectal cancer to Wnt signaling.Cell,2000,103(2):311-320
[8]Moon RT,Bowerman B,Boutros M,et al.The promise and perils of Wnt signaling through beta-catenin.Science,2002,296(5573):1644-1646
[9]査锡良.一个新原癌基因的产物—β-连环蛋白.生命的化学,1998,18(2):15
[10]Ninomiya I,Endo Y,Fushida S,et al.Alteration of beta-catenin expression in esophagealsquamous-cell carcinoma.Int J Cancer,2000,85(6):757-761
[11]de Castro J,Gamallo C,Palacios J,et al.beta-catenin expression pattern in primary oesophageal squamous cell carcinoma.Relationship with clinicopathologic features and clinical outcome.Virchows Arch,2000,437(6):599-604
[12]Saeki H,Tanaka S,Sugimachi K,et al.Interrelation between expression of matrix metalloproteinase 7 and beta-catenin in esophageal cancer.Dig Dis Sci,2002,47(12):2738-2742
[13]Kudo J,Nishiwaki T,Haruki N,et al.Aberrant nuclear localization of beta-catenin without genetic alterations in beta-catenin or Axin genes in esophageal cancer.World J Surg Oncol,2007,5:21-27
[14]Yamamoto H,Vinitketkumnuen A,Adachi Y,et al.Association of matrilysin-2(MMP-26)expression with tumor progression and activation of MMP-9 in esophageal squamous cell carcinoma.Carcinogenesis,2004,25(12):2353-2360
[15]Zhou C,Liu S,Zhou X,et al.Overexpression of human pituitary tumor transforming gene(hPTTG),is regulated by beta-catenin/TCF pathway in human esophagealsquamous cell carcinoma. Int J Cancer,2005,113(6):891-898
[16]Zhang G,Zhou X,Xue L,et al.Accumulation of cytoplasmic beta-catenin correlates with reduced expression of E-cadherin,but not with phosphorylated Akt in esophageal squamous cell carcinoma:immunohistochemical study.Pathol Int,2005,55(6):310-317
[17]Wang Y,Zhou X,Zhu H,et al.Overexpression of EB1 in human esophageal squamous cell carcinoma(ESCC)may promote cellular growth by activating beta-catenin/TCF pathway.Oncogene,2005,24(44):6637-6645
[18]Morin PJ,Sparks AB,Korinek V,et al.Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC.Science,1997,275(5307):1787-1790
[19]Kinzler KW,Vogelstein B.Lessons from hereditary colorectal cancer.Cell,1996,87(2):159-170
[20]Farr GH,Ferkey DM,Yost C,et al.Interaction among GSK-3,GBP,axin,and APC in Xenopus axis specification.J Cell Biol,2000,148(4):691-702
[21]Sanders DS,Bruton R,Darnton SJ,et al.Sequential changes in cadherin-catenin expression associated with the progression and heterogeneity of primary oesophageal squamous carcinoma.Int J Cancer,1998,79(6):573-579
[22]Roth MJ,Hu N,Johnson LL,et al.beta-Catenin splice variants and downstream targets as markers for neoplastic progression of esophageal cancer. Genes Chromosomes Cancer,2005,44(4):423-428
[23]Powell SM,Papadopoulos N,Kinzler KW,APC gene mutations in the mutation cluster region are rare in esophageal cancers.Gastroenterology,1994,107(6):1759-1763
[24]Nakajima M,Fukuchi M,Miyazaki T,et al.Reduced expression of Axin correlates with tumour progression of oesophageal squamous cell carcinoma.Br J Cancer,2003,88(11):1734-1739
[25]Deng YZ,Chen PP,Wang Y,et al.Connective tissue growth factor is overexpressed in esophageal squamous cell carcinoma and promotes tumorigenicity throughβcatenin-T-cellfactor/Lef signaling.J BiolChem,2007,282(50):36571-36581
[26]Kimura Y,Shiozaki H,Doki Y,et al.Cytoplasmic beta-catenin in esophageal cancers.Int J Cancer,1999,84(2):174-178
[27]Lv J,Cao XF,Ji L,et al.Association of Wnt1/betacatenin with clinical pathological characteristics and prognosis of esophageal squamous cell carcinoma.Genet Test Mol Biomarkers,2010,14(3):363-369
[28]Wang Jinsheng,Zheng Changli,Wen Jifang,et al.Gene silencing ofβ-catenin by RNAi inhibits cell proliferation in human esophageal cancer cells in vitro and in nude mice.Dis Esophagus,2009,22(2):151-162
图 版 说 明
图1 β-catenin蛋白在正常食管黏膜上皮的表达,阳性信号位于细胞膜(SP×200)
图2 β-catenin蛋白在肿瘤细胞膜上的表达及细胞质中的积累(SP×200)
图3 β-catenin蛋白在肿瘤细胞质中的积累(SP×200)
图4 β-catenin蛋白在肿瘤细胞质中的异质性表达(SP×200)
图5 β-catenin蛋白在肿瘤细胞质中的积累及细胞核定位(SP×200)
图6 RT-PCR分析正常食管黏膜和食管鳞癌组织中βcatenin mRNA的表达
EXPLANATION OF FIGURES
Fig.1 The expression ofβ-catenin in nonneoplastic esophageal mucosal tissue,the positive signal locates in membrane.(SP×200)
Fig.2 The expression ofβ-catenin in ESCC,the positive signal locates in cytoplasm and membrane.(SP×200)
Fig.3 The expression ofβ-catenin in ESCC,the positive signal locates in cytoplasm.(SP×200)
Fig.4 The heterogeneous expression ofβ-catenin in ESCC.(SP×200)
Fig.5 The expression ofβ-catenin in ESCC,the positive signal locates in cytoplasm and nucleus.(SP×200).
Fig.6 RT-PCR analysis for the mRNA abundance ofβ-catenin in ESCC and their corresponding nonneoplastic epithelia tissues.M:DNA marker,N:正常食管黏膜(Normal esophageal mucosa),T:食管鳞癌(ESCC);β-catenin 扩增产物 668bp(β-catenin PCR products,668bp),内参β-actin扩增产物150bp(Internal control β-actin PCR products,150bp)
Abnormal expression ofβ-catenin in esophageal squamous cell carcinoma and its clinical significance
Wang Jinsheng,Wei Wu*,Ji Aifang,Ren Hongzheng1,Wen Jifang1
(Central L aboratory,Heping Hospital A f f iliated to Changzhi Medical University,S hanxi046000;1Department of Pathology,Xiangya Medical College,Central South University,Changsha410008,China)
Objective To explore the expression and significance ofβ-catenin in esophageal squamous cell carcinoma(ESCC).Methods Immunohistochemiscal staining was used to examine the expression ofβcatenin protein in 65 cases of formalin-fixed,paraffin-embeded ESCC tissue(n=65)and their corresponding nonneoplastic epithelial tissues(n=20).RT-PCR was used to determine the expression ofβ-catenin in 31 cases of fresh ESCC tissue(n=31)and their corresponding nonneoplastic epithelial tissues(n=31).Results In the 20 samples of normal esophageal mucosa,immunohistochemistry showed thatβ-catenin was mainly located in the membrane,while 41 in 65(63.1%)tumor samples had cytoplasmic accumulation of β-catenin and 20(30.8%)had nuclear staining.The cytoplasmic/nuclearβ-catenin was significantly associated with lymph node metastasis(P=0.005),but not with the patient’s age,gender,tumor grade or differentiation grade.In 31 fresh ESCC tissues studied,all tumor samples and paired normal samples expressedβ-catenin mRNA.Twenty-one of 31(66.7%)tumors expressedβ-catenin mRNA at a higher level than their corresponding nonneoplastic tissues,8 of 31(25.8%)were almost the same,and 2 of 31(6.5%)showed lower expression.Altogether,tumor tissues expressed a significantly higher level ofβ-catenin mRNA than the corresponding nonneoplastic tissues(P=0.037).Conclusion ESCC shows an increased expression ofβ-catenin mRNA,and the abnormal cytoplasmic/nuclear accumulation ofβ-catenin is significantly associated with lymph node metastasis.
Esophageal squamous cell carcinoma; β-catenin; Lymph node metastasis; Immunohistochemistry
R329
A
10.3870/zgzzhx.2011.02.005
2011-01-10
2011-04-01
山西省自然科学基金资助(2010011047-5)
王金胜,男(1975年),汉族,副教授。
*通讯作者(To whom correspondence should be addressed)
