辛伐他汀对动脉粥样硬化大鼠凋亡相关基因Fas及FasL蛋白表达的影响
2011-11-02胡司淦柴大敏乔琛琛吴士礼高大胜王洪巨
胡司淦柴大敏乔琛琛 邵 杉 吴士礼 高大胜 王洪巨
(蚌埠医学院第一附属医院心血管科,安徽 233004;1蚌埠医学院病理学教研室,安徽 233030)
辛伐他汀对动脉粥样硬化大鼠凋亡相关基因Fas及FasL蛋白表达的影响
胡司淦*柴大敏1乔琛琛 邵 杉 吴士礼 高大胜 王洪巨
(蚌埠医学院第一附属医院心血管科,安徽 233004;1蚌埠医学院病理学教研室,安徽 233030)
目的 通过研究辛伐他汀对动脉粥样硬化大鼠血管壁中细胞凋亡相关基因Fas及FasL蛋白表达产物的影响,探讨其在预防动脉粥样硬化发生中的可能机制。方法 复制动脉粥样硬化大鼠模型,以辛伐他汀干预,取胸主动脉,观察其斑块变化,采用免疫组化Elivision法测定动脉粥样硬化血管壁中Fas、FasL蛋白表达。结果 Fas蛋白表达在实验组明显高于对照组及干预组(P<0.01,P<0.05),实验组FasL蛋白表达也明显高于对照组及干预组(P<0.05)。结论 Fas及 FasL基因通过促进细胞凋亡作用而诱发动脉粥样硬化过程,辛伐他汀可通过调节细胞凋亡过程发挥抗动脉粥样硬化作用。
辛伐他汀; 动脉粥样硬化; 细胞凋亡; 免疫组织化学
近年来研究证实细胞凋亡在动脉粥样硬化中扮演重要角色,认为细胞凋亡与斑块形成、不稳定、破裂和血栓形成有关[1]。在粥样斑块中的各型细胞,包括血管平滑肌细胞、巨噬细胞、内皮细胞和淋巴细胞均存在不同程度的凋亡,特别是平滑肌细胞和巨噬细胞的增殖和凋亡参与斑块的形成和破裂[2],并且Frostegard等研究[3]发现炎性细胞(包括巨噬细胞、单核细胞和淋巴细胞)和血管细胞(包括血管平滑肌细胞和血管内皮细胞)在通过凋亡和增殖维持自身稳态中可能存在交叉反应。目前认为干预细胞凋亡过程对阻止动脉粥样硬化发展可能有重要意义。国内外他汀类的临床试验证实其可以降低血脂,降低心血管病事件的发生率,即稳定斑块作用;改善血管内皮功能;减少或消除血管炎症反应。虽然其稳定斑块的机制尚不完全清楚,但已发现后者不能完全用他汀类的降脂作用来解释。有作者发现应用他汀类药物后,动脉粥样硬化斑块中巨噬细胞凋亡与增殖在发生改变,推测该变化可能影响了斑块的稳定性[4]。有关他汀类对粥样斑块中细胞凋亡的影响及相关机制的在体研究报道罕见。我们旨在通过他汀药物辛伐他汀对动脉粥样硬化斑块中细胞凋亡基因蛋白产物的影响,以进一步探索细胞凋亡在动脉粥样硬化斑块中的作用以及他汀类药物干预的可能作用机制。
材料和方法
1.实验动物与试剂
雄性Sprague-Dawley(SD)大鼠 36只,清洁级,体重80-100g,购自浙江省实验动物中心,许可证号SCXK(浙)20080033。维生素D3购自上海通用药业股份有限公司,批号:080604;丙基硫氧嘧啶购自上海朝晖药业有限公司,批号:081103;胆酸钠及胆固醇均购自安徽天启化工科技有限公司;猪油为市售食用猪油;辛伐他汀(舒降之)购自杭州默沙东制药有限公司,批号:100015。
2.大鼠动脉粥样硬化模型建立[5]
36 只SD大鼠入住动物实验室后以标准饲料适应性喂养1周。随机分为对照组(n=10)、实验组(n=13)、干预组(n=13),对照组大鼠喂食普通饲料,实验组和干预组大鼠首先一次性腹腔注射维生素D3(60万IU/kg),对照组给予同等体积的生理盐水,然后喂食高脂饲料即3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油、81.3%基础饲料。6周后,干预组大鼠加以辛伐他汀(5mg/kg/D)灌胃,对照组和实验组予以同等体积的生理盐水灌胃,继续喂养4周。所有大鼠均分笼按清洁级动物饲养,饮用洁净水,整个试验周期为11周。
3.标本的收集与处理
各组动物于实验结束时行空腹心脏取血,分离血清,用Olympus AU5400全自动生化分析仪检测血清胆固醇、甘油三酯、高密度脂蛋白及低密度脂蛋白水平。并于实验结束时将所有大鼠处死,立即取胸主动脉,用10%福尔马林液固定,石蜡包埋、切片、HE染色光镜观察主动脉的形态。
4.免疫组化方法
Fas试剂购自武汉博士德生物公司,FasL购自Santa Cruz公司。应用免疫组化Elivision方法对9例对照组,11例实验组及12例干预组大鼠进行Fas、FasL蛋白表达检测,操作步骤按说明书进行。
5.结果判定
Fas和FasL的阳性着色定位于血管平滑肌细胞、巨噬细胞的细胞浆或细胞膜,出现棕黄色颗粒。每张切片随机观察10个高倍视野,每个视野计数200个细胞,统计阳性细胞数及观察显色度,阳性强度用半定量法,按阳性细胞所占百分数评分:阳性细胞<10%为0分,10%-50%为1分,51%~75%为2分,>75%为3分。细胞不着色为0分,浅黄为1分,黄色为2分,棕褐色为3分。两者分数相乘0分为阴性(-),1-4分为弱阳性(+),>4分为中强度阳性(++)。
6.统计学处理
结 果
实验过程中4只大鼠发生死亡,其中对照组1只,实验组2只,干预组1只。
1.三组血脂水平变化
实验结束时三组动物均心脏取血,检测血脂,结果显示实验组血清胆固醇、低密度脂蛋白(Low density lipoprotein,LDL)均显著高于对照组及干预组(P<0.01),甘油三酯(Triglyceride,TG)水平三组间无明显差异,高密度脂蛋白(High density lipoprotein HDL)水平在对照组均明显高于实验组及干预组(P<0.01)。见表 1。
表1 三组血清血脂水平比较(±s)(mmol/l)Table 1 The level of serum lipid in three groups(±s)(mmol/l)

表1 三组血清血脂水平比较(±s)(mmol/l)Table 1 The level of serum lipid in three groups(±s)(mmol/l)
*P<0.01,compared with control group;#P<0.01,compared with experimental group
Groups cases Total cholesterd TG HDL LPC对照组(Control group)实验组(Experimental group)干预组(Intervention group)9 11 12 1.49 ±0.47 4.68 ±1.93 *2.50 ±0.46#1.46 ±0.51 2.02 ±1.29 1.59 ±1.20 2.59 ±0.92 0.80 ±0.39*1.00 ±0.31*0.63 ±0.07 1.92 ±0.87*1.01 ±0.17#
2.病理形态学改变
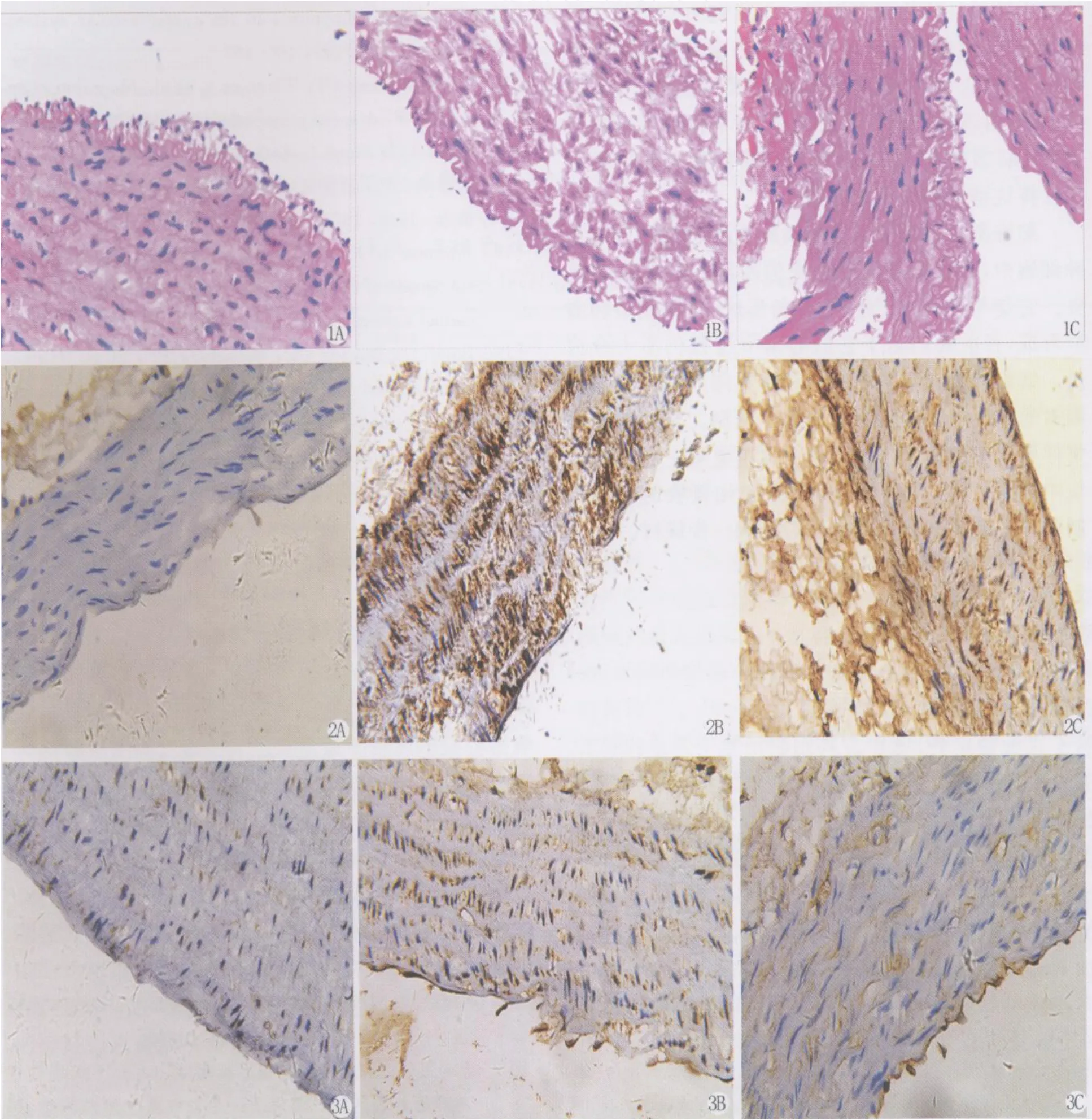
光镜下对照组升主动脉内膜薄且结构完整、规则,未见斑块,中膜、外膜形态规则,分界清楚;实验组内膜明显增厚,脂质斑块弥漫,内有泡沫细胞大量积聚,覆盖于整个管腔表面,平滑肌细胞排列紊乱,中膜弹力纤维增粗,弹力纤维和胶原纤维排列紊乱;干预组仅局部存在斑块、泡沫细胞数目减少、体积变小、胞内空泡明显减少,内膜增生程度低于实验组,弹力纤维和胶原纤维排列也较实验组规则。见图1。
3.免疫组化结果
免疫组化结果表明,凋亡相关基因Fas和FasL在三组中均有不同程度的表达,阳性颗粒主要存在于细胞膜、细胞浆,呈棕黄色,在血管壁的巨噬细胞、血管平滑肌细胞及淋巴细胞表达明显。2种基因表达水平在对照组、实验组及干预组蛋白表达量各不相同。Fas蛋白表达水平在实验组明显高于对照组及干预组(P<0.01,P<0.05)见表 2、图 2,FasL 蛋白表达在实验组明显高于对照组及干预组(P<0.05)见表 3、图 3。
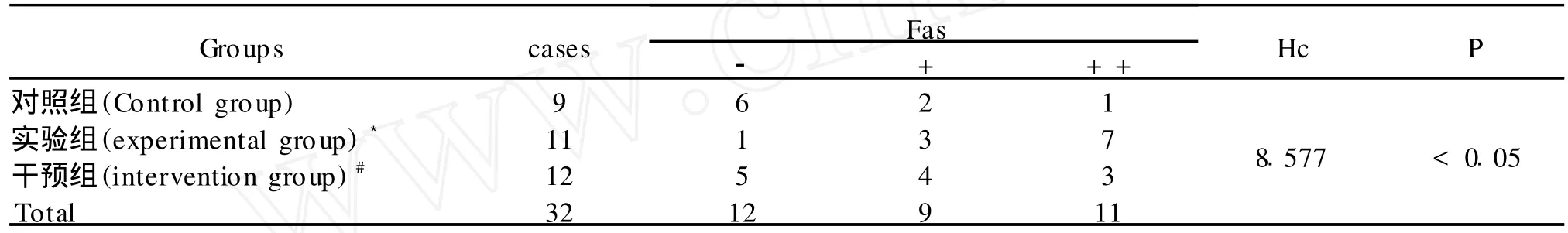
表2 三组Fas蛋白的表达水平比较Table 2 The expression level of Fas protein in three groups

表3 三组FasL蛋白的表达水平比较Table 3 The expression level of FasL protein in three groups
讨 论
目前研究认为冠状动脉粥样斑块的不稳定发生破溃破裂继发血栓形成导致冠状动脉急性完全或部分堵塞是产生冠状动脉事件的重要原因。近来的研究发现细胞凋亡和炎性反应贯穿于冠状动脉内粥样斑块的发生与发展以及斑块的破溃破裂过程的全过程[6,7]。细胞凋亡(又称程序性死亡)参与动脉粥样硬化斑块的形成发展以及易损斑块的形成和破裂过程。目前我们对其在动脉粥样硬化中的具体发生机制及其后果仍不清楚,但有研究发现血管内皮细胞的凋亡可能启动动脉的粥样硬化过程,局部血管平滑肌细胞和巨噬细胞的凋亡则更多地参与易损斑块的形成以及斑块的破裂[8]。
Bennett[9]指出冠状动脉粥样硬化性心脏病的细胞凋亡主要是由Fas和 FasL所介导。Fas抗原系统主要表达于激活的 T细胞、B细胞、自然杀伤细胞、巨噬细胞、单核细胞等炎性细胞和血管细胞的表面,这些细胞上的Fas与FasL结合后介导细胞的凋亡过程[10]。研究[11]也发现 Fas系统参与调节动脉粥样斑块中血管平滑肌细胞、血管内皮细胞和炎性细胞的凋亡过程。在动脉内膜损伤时Fas有异常表达,血管平滑肌细胞的增殖和凋亡受Fas-FasL系统的调控[12]。Boylle JJ[13]等提出 Fas抗原表达增高介导的血管平滑肌细胞凋亡增多、纤维帽张力下降可直接导致斑块破裂参与急性冠脉事件的发生。并且研究也发现Fas基因启动子区域的基因多态性可增加急性心肌梗死的发生率[14]。在本研究中实验组Fas及 FasL蛋白表达明显高于对照组(P<0.01,P<0.05),Fas及 FasL蛋白在动脉粥样硬化血管壁中的高表达表明动脉粥样硬化血管较正常血管存在较多的细胞凋亡,Fas与FasL介导的细胞凋亡参与动脉粥样硬化的形成过程,并且也发现 Fas与FasL主要表达于血管壁的巨噬细胞、血管平滑肌细胞及淋巴细胞的细胞浆及细胞膜上。目前有很多临床实验证实他汀类药物可以减少冠心病的死亡和心肌梗死的发生,他们可以通过减少斑块表面的细胞凋亡而稳定斑块。他汀类药物可直接影响细胞的生存,并且具有在斑块内的抗炎作用从而抑制炎症细胞触发的细胞凋亡。他汀类药物通过影响eNOS的产生抑制血管内皮细胞的凋亡。早期应用他汀类药物可抑制激活 T淋巴细胞对血管内皮细胞的损伤,从而减少血管内皮细胞凋亡,防止易损斑块破裂,预防冠脉事件发生[15]。在体外实验中他汀类药物可以很大程度的增加血管平滑肌细胞的凋亡[16],然而在体内的动物实验和人体实验中表现为他汀类药物在减少胆固醇的同时可以减少斑块的血管平滑肌细胞和巨噬细胞的凋亡[4],并且表现出独立于降低胆固醇以外的抗凋亡作用。本研究中实验组与干预组比较,实验组Fas及FasL蛋白表达明显高于干预组(P<0.05),而干预组与对照组比较,Fas与FasL蛋白表达无统计学意义,表明辛伐他汀可通过调节Fas及FasL的表达影响血管细胞的细胞凋亡而发挥抗动脉粥样硬化作用。
细胞凋亡现象可发生于动脉粥样硬化斑块的各种细胞中,并且表现随着斑块的发展变的越来越重要。它参与斑块的产生、脂核的形成、斑块破裂和血栓形成,目前我们对于它们的调节过程仍不十分清楚。细胞凋亡在不同的细胞和在不同的局部或全身因素的作用下表现为不同的调节机制。目前对动脉粥样硬化中细胞凋亡靶点的干预主要集中在减少斑块中细胞的凋亡,对于动脉粥样硬化斑块的凋亡机制和调节方式的研究值得我们更深一步探讨。
[1]Karaflou M,Lambrinoudaki I,Christodoulakos G.Apoptosis in atherosclerosis:a mini-review.Mini Rev Med Chem,2008,8(9):912-918
[2]Yang Z,Gagarin D,St Laurent G3rd,et al.Cardiovascular inflammation and lesion cell apoptosis:a novel connection via the interferon-inducible immunoproteasome.Arterioscler Thromb Vasc Biol,2009,29(8):1213-1219
[3]Frostegard J,Ulfgren AK,Nyberg P,et al.Cytokine expression in advanced human atherosclerotic plaques:dominance of pro-inflammatory(Th1)and macrophage stimulating cytokines.Atherosclerosis,1999,145(1):33-45
[4]Crisby M,Nordin-Fredriksson G,Shah PK,et al.Pravastatin treatment increases collagen content and decreases lipid content,inflammation,metallo proteinases and cell death in human carotid plaques:implications for plaques stabilization.Circulation,2001,103(7):926-933
[5]杨鹏远,芮耀诚,焦亚斌.动脉粥样硬化大鼠实验模型的建立.第二军医大学学报,2003,24(7):802-804
[6]Hansson GK. Immune mechanisms in atherosclerosis.Artherioscler Thromb Vasc Biol,2001,21(12):1876-1890
[7]Leinonen M,Saikku P.Evidence for infectious agents in cardiovascular diseases and atherosclerosis.Lancet Infect Dis,2002,2(1):11-17
[8]Stoneman VEA,Bennett MR.Role of apoptosis in atherosclerosis and its therapeutic implications.Clin Sci,2004,107(3):343-354
[9]Bennett MR. Apoptosis in the cardiovascular system.Heart,2002,87(5):480-487
[10]Tabas I,Seimon T,Timmins J,et al.Macrophage apoptosis in advanced atherosclerosis.Ann NY Acad Sci,2009,1173 Suppl 1:E40-45
[11]朱锡华.Fas系统研究进展.中华微生物学和免疫学杂志,1996,16(2):77-82
[12]Jeremias I,Kupatt C,Martin Villalba A,et al.Involvement of CD95/Apo-1/Fas in cell death after myocardial ischemia.Circulation,2000,102(8):915-920
[13]Boyle JJ,Bowyer DE,Weissberg PL,et al.Human blood-derived macrophage induce apoptosis in human plaque–derived vascular smooth muscle cells by Fas-Ligand/Fas interactions.Arterioscler Thromb Vasc Biol,2001,21(9):1402-1407
[14]Hanasaki H,Takemura Y,Fukuo K,et al.Fas promoter region gene polymorphism is associated with an increased risk formyocardial infarction. Hypertens Res,2009,32(4):261-264
[15]Sato K,Nuki T,Gomita K,et al.Statins reduce endothelial cell apoptosis via inhibition of TRAIL expression on activated CD4 T cells in acute coronary syndrome.Atherosclerosis,2010,213(1):33-39
[16]Erl W,Hristov M,Neureuter M,et al.HMG-CoA reductase inhibitors induce apoptosis in neointima derived vascular smooth muscle cells.Atherosclerosis,2003,169(2):251-258
图 版 说 明
图1 血管组织 HE染色结果,1A表示对照组,1B表示实验组,1C表示干预组。(HE染色×400)。
图2 Fas蛋白在三组中表达水平不同,图2A示Fas蛋白在对照组低表达,图2B示 Fas蛋白在实验组高表达,图2C示 Fas蛋白在干预组中表达。(Elivision法 ×100)。
图3 FasL蛋白在三组中表达水平不同,图2A示FasL蛋白在对照组低表达,图2B示 FasL蛋白在实验高表达,图2C示FasL蛋白在干预组中表达。(Elivision法×100)。
EXPLANATION OF FIGURES
Fig.1 HE staining of vascular tissue. 1A is control group.1B is experimental group.1C is intervention group.(HE staining ×400).
Fig.2 The expression level of Fas protein was different in three groups.2A show lower expression of Fas protein in the control group.2B show high expression of Fas protein in the experimental group.2C show moderate expression of Fas protein expression in the intervention group. (Elivision method ×100).
Fig.3 The expression level of FasL protein was different in three groups.3A show lower expression of FasL protein in the control group.3B show high expression of FasL protein in the experimental group. 3C show moderate expression of FasL protein expression in the intervention group. (Elivision method ×100).
E ffect of simvastatin on apoptosis related genes fas and fasl protein expression
Hu Sigan,Chai Damin1,Qiao Chenchen,Shao Shan,Wu Shili,Gao Dasheng,Wang Hongju
(Department of Cardiovasology,First A f f iliated Hospital,Bengbu Medical College,A nhui233004;1Department ofPathology,Bengbu Medical College,A nhui233030,China)
Objective To investigate the effect of simvastatin on the protein expression of apoptosis relate genes Fas and FasL in atherosclerotic rats,and explore the possible mechanism of simvastatin in preventing atherosclerosis.Methods We made the rat model of atherosclerosis,with simvastatin intervention,and took the thoracic aortato observe the plaque.The expressions of Fas and FasL protein were determined using Elivision immunohistochemical technique.Results The positive rates of Fas expressions in the experimental group were higher than those in the control group and the intervention group(P<0.01,P<0.05).The expression of FasL protein in the experimental group was also obviously higher than that in the control group and the intervention group(P<0.05). Conclusion Fas and FasL genes can accelerate the process of apoptosis during atherosclerosis.Simvastatin acts against atherosclerosis by adjusting cell apoptosis.
Simvastatin; Atherosclerosis; Apoptosis; Immunohistochemistry
R329
A
10.3870/zgzzhx.2011.02.013
2010-11-30
2011-02-20
蚌埠医学院科研课题资助(BY0855)
胡司淦,男(1979年),汉族,主治医师。
*通讯作者(To whom correspondence should be addressed)
