茴香豆挥发性成分分析
2011-10-30孙培培黄明泉孙宝国
孙培培,黄明泉*,孙宝国,刘 丹
(北京工商大学 北京市食品风味化学重点实验室,食品添加剂与配料北京高校工程研究中心,北京 100048)
茴香豆挥发性成分分析
孙培培,黄明泉*,孙宝国,刘 丹
(北京工商大学 北京市食品风味化学重点实验室,食品添加剂与配料北京高校工程研究中心,北京 100048)
采用顶空固相微萃取(head space solid phase microextraction,HS-SPME)结合气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)对茴香豆中挥发性成分进行提取与分析,通过单因素试验考察萃取头、萃取时间和萃取温度对萃取分析结果的影响。结果表明,较优的顶空固相微萃取条件为使用75μm Carboxen/PDMS萃取头于55℃顶空吸附60min;通过GC-MS分析,共鉴定出38种成分,占色谱流出组分总量的86.87%,其中烃类15种、醛酮类13种、醇酚类3种、醚类3种、其他类4种,峰面积相对值较高的有大茴香脑(40.75%)、壬醛(4.16%)、顺式茴香脑(3.77%)、柠檬烯(3.48%)、草蒿脑(2.9%)。
茴香豆;顶空固相微萃取;气相色谱-质谱法;挥发性成分
蚕豆(Vicia fabaL.)又名为胡豆、罗汉豆,在我国已有两千年栽培史,是我国重要的豆科作物之一[1],它高蛋白(含量高达30%)、低脂肪、富含淀粉,且蛋白质中氨基酸种类齐全,具有健脾利湿、清热消肿、降血脂等功效[2-3]。蚕豆在我国民间有多种食用方法[4],并可深加工成蚕豆休闲食品[5]、蚕豆酱[6]等。茴香豆是绍兴特产,是以干蚕豆作原料,与茴香、桂皮、食盐等辅料煮至而成[7]。茴香豆酥软清鲜,香味浓厚,咸而透鲜,回味微甘。如今茴香豆不仅是作为绍兴特色的菜肴,还作为绍兴特色食品加工包装成休闲食品。它不仅具有独特的滋味,而且具有特殊的香味。对茴香豆中挥发性香成分进行研究有助于进一步开发茴香豆新产品。
用于食品中挥发性香成分的提取技术主要有溶剂辅助蒸馏技术[8]、同时蒸馏萃取技术[9]、超临界萃取技术、固相微萃取技术[10]等。其中固相微萃取(solid phase microextration,SPME)方法快速、简便、无溶剂,可以与气相色谱、液相色谱联用进行分离,集采样、萃取、浓缩、进样于一体,是一种新型的、环境友好的样品预处理技术,已广泛应用于食品、环境、医药等领域的样品分析测定;Yu等[11]对中国传统型豆酱通过固相微萃取进行了GC-MS分析;陆占国等[12]通过固相微萃取对茴香籽香气成分进行了研究;贾春晓等[13]利用顶空-固相微萃取法结合气相色谱-质谱法测定了八角茴香挥发性成分;雷宏杰[14]在蚕豆酱质量的初步研究中应用HS-SPME-GC-MS对传统发酵和高温发酵两种工艺的成熟酱醅中的挥发性风味物质进行了检测。本实验采用顶空固相微萃取和气质联用方法分析茴香豆中的挥发性成分,并对分析出的挥发性成分进行定量。
1 材料与方法
1.1 材料、试剂与仪器
茴香豆 市购。
普通化学试剂均为分析纯;C6~C30正构烷烃(色谱纯) 北京迪马科技有限公司。
6890N/5973I气相色谱-质谱联用仪 美国Agilent公司;DF-101S集热式恒温加热磁力搅拌器 河南省予华仪器有限公司;萃取装置[包括SPME手动进样手柄、萃取头(75μm Carboxen/PDMS、100μm PDMS、50/30μm DVB/CAR/PDMS、65μm PDMS/DVB]美国Supelco公司。
1.2 方法
1.2.1 顶空固相微萃取
1.2.1.1 萃取头老化
在使用萃取头之前按照Supelco公司推荐的条件在气相色谱的进样口老化至检测无杂峰出现,所选4种纤维头操作参数见表1。
萃取纤维类型 膜厚/μm老化温度/℃ 老化时间/h 用途
Car box en/PDMS 75 30 0 1.0 痕量挥发性有机化合物
PD MS 100 50 0.5 小分子挥发性非极性物质DVB/CA R/PDMS 50/30 270 1.0 C3~C20大范围分析
PD M S/DVB 65 250 0.5 极性挥发性物质,醇、胺类
1.2.1.2 萃取样品
取新购买的60g茴香豆放入100mL锥形瓶中,密封,将锥形瓶放入一定温度恒温水浴锅中平衡15min,再将老化好的萃取针头插入样品瓶中,用手柄将纤维头推出置样品瓶顶空距样品约5mm,恒温萃取一定时间;然后抽回纤维头拔出萃取头在GC-MS进样口于250℃解析5min,进行GC-MS分析。
1.2.1.3 顶空固相微萃取条件的优化
按照1.2.1.2节方法,采用单因素选优方式对萃取纤维头、萃取时间、萃取温度3个影响因素进行考察,通过比较峰面积和峰个数优化萃取条件。
1.2.2 GC-MS分析条件
色谱条件:色谱柱为AB-5MS(30.0m×0.25mm,0.25μm);进样口温度250℃,不分流;载气He,恒流模式,流速1.0mL/min;升温程序为起始温度35℃(保持3min),以8℃/min的速度升至150℃(保持5min),再以8℃/min速度升至230℃(保持2min),再以25℃/min的速度升至280℃(保持2min)。
质谱条件:电子轰击离子源(electron impact ion source,EI),电子能量70eV;离子源温度230℃;四极杆150℃;扫描模式Scan;无溶剂延迟;质量扫描范围m/z33~300。
1.2.3 定性定量分析
分析结果由Nist 08谱库检索结果、保留指数与人工图谱解析共同确定,且根据匹配度均大于70的原则进行鉴定确认,其中保留指数的计算方法参考文献[15]。
恒温时,保留指数为:

式中:t(a)′为待测组分的调整保留时间;t(n)′为具有n个碳原子的正构烷烃的调整保留时间;t(n+1)′为具有(n+1)个碳原子的正构烷烃的调整保留时间。
采用面积归一化法对检测出的成分进行简单定量。
2 结果与分析
2.1 萃取纤维的选择
按照聚合物的极性,萃取头的固定相涂层可分为3大类:第1类为极性涂层;第2类为非极性涂层;第3类为中等极性混合型涂层。不同固定相和交联键合方式所构成的萃取头对物质的萃取吸附能力不同,根据美国Supelco公司提供的数据资料,本实验采用75μm Carboxen/PDMS、100μm PDMS、50/30μm DVB/CAR/ PDMS、65μm PDMS/DVB 4种萃取头在相同的吸附条件(55℃吸附60min)和解吸条件(250℃解吸5min)以及GCMS条件进行考察,各萃取头萃取茴香豆中挥发性成分的总离子流图见图1。
从图1可知,75μm Carboxen/PDMS的吸附萃取效果优于其他3个,这主要是因为萃取头涂层的极性不同所致。萃取头对所分析的化合物有选择性,对茴香豆样品而言,75μm Carboxen/PDMS萃取头更适合,不仅分离出的化合物比较全面,而且风味信号强度也很大,色谱分析响应值较高,因而选择75μm Carboxen/ PDMS作为本实验用萃取头。
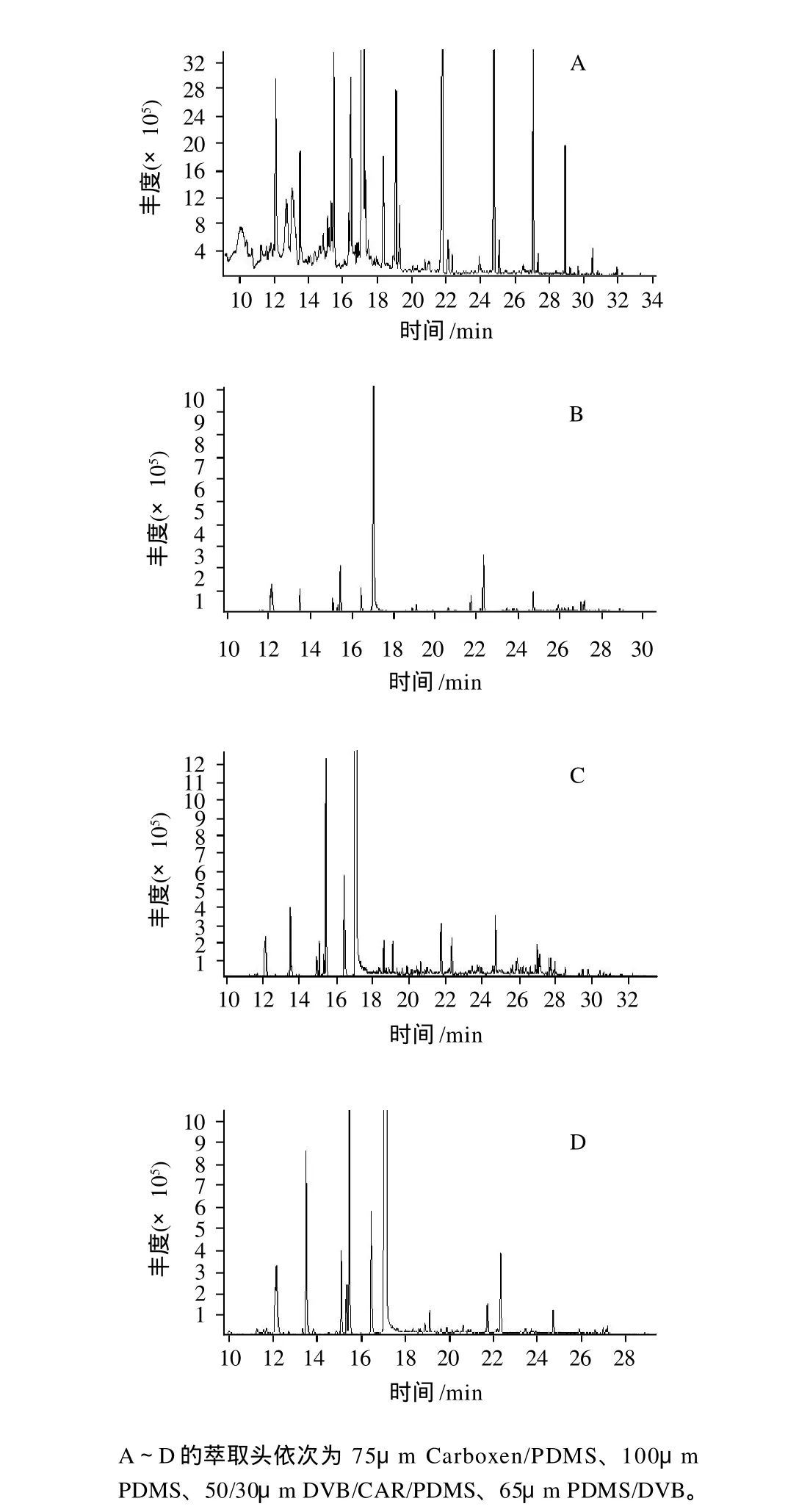
图1 不同萃取头萃取挥发性成分的总离子流色谱图Fig.1 Total ion chromatograms of volatile components from fennel bean using different types of SPME fibers
2.2 萃取时间的选择
顶空固相微萃取法是一种在平衡状态下测定被分析物的方法,萃取头在吸附时存在吸附-解析平衡,萃取达到平衡的时间受样品基质、分配系数、物质的扩散速度等因素影响,故不同样品达到萃取平衡的时间不同,而不同的萃取时间对萃取结果有一定影响。因此本实验以75μm Carboxen/PDMS作为萃取头,在55℃条件下考察萃取时间(20、40、60min)对萃取效果的影响,经气质联机分析,不同时间内检测出峰的个数、 鉴定出峰的个数、总峰面积见表2。

表2 不同萃取时间的萃取效果Table 2 Effect of extraction time on chromatographic peak data
从表2可知,20~60min内萃取效率(检测峰个数、总峰面积)随萃取时间延长而提高,所以将萃取时间确定为60min。
2.3 萃取温度的选择
温度对萃取效果的影响具有两面性:一方面,温度升高加快样品分子运动,有利于萃取吸附;另一方面,温度高又会造成吸附物质的解吸,从而降低萃取头吸附组分的能力。
本实验采用75μm Carboxen/PDMS 萃取头分别在40、55、70℃条件顶空萃取60min,考察温度对萃取的影响,检测分析结果见图2。从图2可见,55℃时检测出峰的个数和萃取量(总峰面积)最大,所以确定较优的萃取温度为55℃。
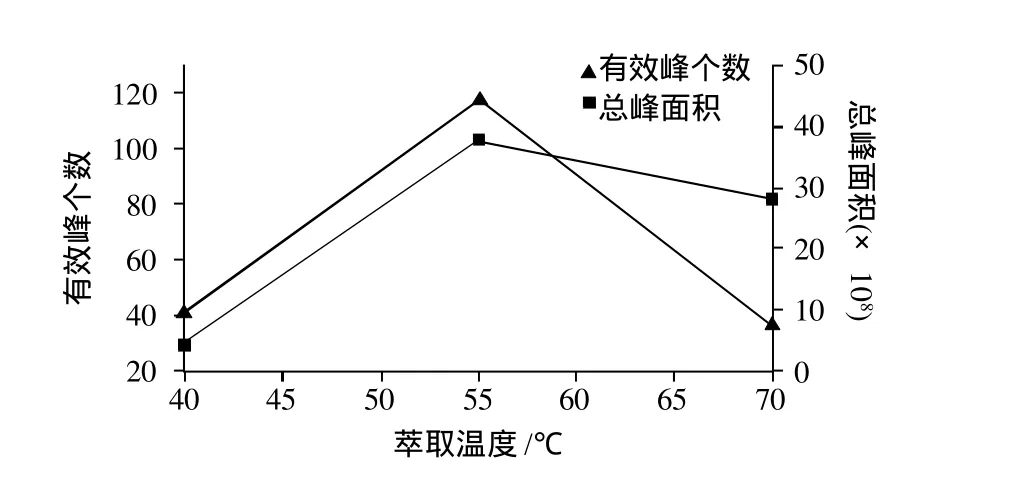
图2 不同萃取温度的萃取效果Fig.2 Effect of extraction temperature on chromatographic peak data
2.4 茴香豆中挥发性成分的鉴定
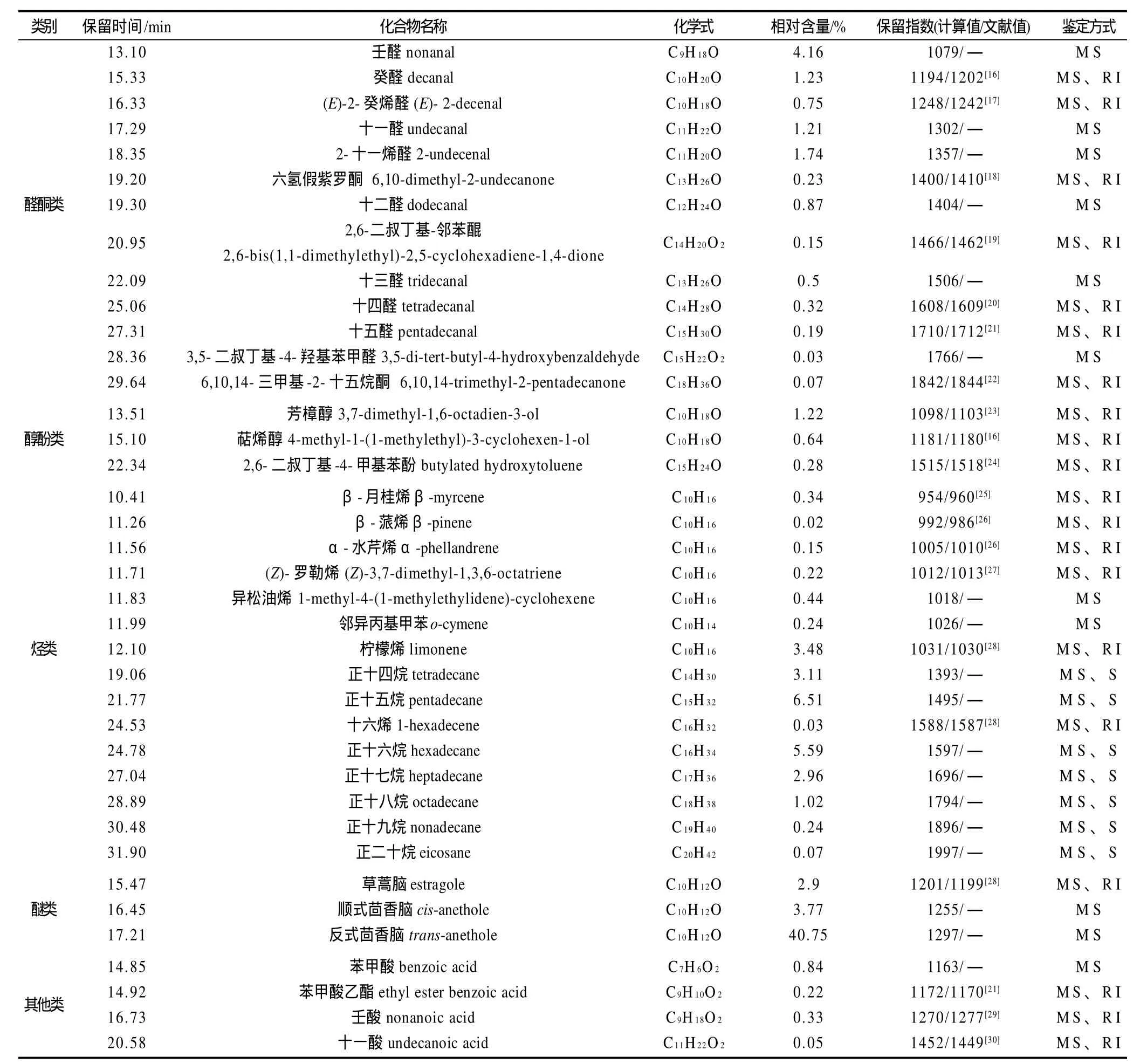
表3 HS-SPME提取茴香豆中挥发性成分的GC-MS分析结果Table 3 Results of GC-MS analysis of volatile components from fennel bean
图3 挥发性成分(A)和正构烷烃(B)的总离子流图Fig.3 Total ion chromatograms of volatiles and normal paraffins from fennel bean
通过单因素试验,可以确定HS-SPME较佳的萃取条件,即萃取头为75μm Carboxen/ PDMS、萃取温度55℃、萃取时间60min。采用上述优化后的固相微萃取条件和GC-MS条件测定了茴香豆中的挥发性成分,并用正构烷烃进行了留指数定性,其中茴香豆挥发性成分和正构烷烃总离子流图如图3所示,分析鉴定结果如表3所示。
经GC-MS分析,结果共检测到118个峰,经Nist 08谱库检索、人工图谱解析结合保留指数,鉴定出38种挥发性成分,占色谱总流出峰相对含量的86.87%。由表3知,鉴定出的挥发性成分包括烃类15种、醛酮类1 3种、醇酚类3种、醚类3种、其他类4种;其中相对含量较高的主要有反式茴香脑(40.75%)、正十五烷(6.51%)、正十六烷(5.59%)、壬醛(4.16%)、顺式茴香脑(3.77%)、柠檬烯(3.48%)、正十四烷(3.11%)、正十七烷(2.96%)、草蒿脑(2.9%)。
茴香豆挥发性香成分中,芳香醚类化合物总含量最高,达47.42%,其中反式茴香脑相对含量最高为40.75%、顺式茴香脑3.77%、草蒿脑、2.9%,大多来自于茴香豆的辅料——茴香,同时也是茴香的主要香成分[12-13]。茴香脑具有茴香的特征香气,草蒿脑具有大茴香醚样甜味、薄荷、药香的香气[31],它们赋予茴香豆茴香醚样特征香气,并且可以使整体香气扩散性好。
醛酮类化合物鉴定出13种,总含量11.45%,其中含量较大的是壬醛4.16%、2-十一烯醛1.74%、癸醛1.23%、十一醛1.21%。这些产物可能为脂肪酸自动氧化、降解的产物。其中壬醛具有强烈的油脂气味和甜橙气息,2-十一烯醛具有醛香、蜡香、柑橘香、脂肪香和青香,癸醛具有蜡香、柑橘香、花香香气,十一醛具有脂肪、花香、柑橘香[31],这些挥发性成分对茴香豆的风味可能有重要贡献,赋予了茴香豆特定的果香、脂肪香。由于醛酮类化合物阈值较低,其他类的醛酮对茴香豆的香气可能也有一定的贡献。
萜类化合物鉴定出8种,包括2种萜醇、6种萜烯,在文献中均有报道[12-13],其中含量较大的是柠檬烯3.48%、芳樟醇1.22%、萜烯醇0.64%。柠檬烯具有甜香、柠檬香;芳樟醇既有紫丁香、铃兰与玫瑰的花香,又有木香、果香气息;萜烯醇具有青香和木香[31],他们也是茴香挥发油的主要成分,虽然含量较低,但它们的存在对茴香豆的香气可能也有一定贡献。
3 结 论
3.1 本实验采用HS-SPME-GC-MS联用技术分析了茴香豆中的挥发性风味成分,优化了HS-SPME的条件——萃取头的选择、萃取时间、萃取温度,得到较佳的HSSPME条件为萃取头75μm Carboxen/PDMS、萃取温度55℃、萃取时间60min。
3.2 在较佳的萃取条件下对茴香豆中香气成分进行分析,结果共鉴定出38种成分,其中烃类15种、醛酮类1 3种、醇酚类3种、醚类3种、其他类4种,相对含量较高的化合物有大茴香脑(40.75%)、正十五烷(6.51%)、正十六烷(5.59%)、壬醛(4.16%)、顺式茴香脑(3.77%)、柠檬烯(3.48%)、正十四烷(3.11%)、正十七烷(2.96%)、草蒿脑(2.9%)等。
3.3 对茴香豆浓郁风味的形成有重要贡献的挥发性成分可能主要来自芳香醚类化合物和醛酮类化合物。但是对于关键性香味物质的确定还需进行一系列探讨和研究,如利用气相色谱- 味觉测量技术(gas chromatographyolfactometry,GC-O),通过香味提取物稀释分析法(aroma extract dilution analysis,AEDA)进行风味稀释(flavor dilution factor,FD)因子和香味活度值(odour activity values,OAVs)的测定等。
[1]中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1998: 269-270.
[2]李爱萍, 郑开斌, 蔡宣梅. 蚕豆的利用价值[J]. 粮油食品科技, 2001, 9(4): 45-46.
[3]杨海涛, 刘军海. 蚕豆蛋白质提取工艺的研究[J]. 食品研究与开发, 2008, 29(2): 76-78.
[4]成训妍. 蚕豆系列食品的开发加工[J]. 现代农业, 2001(1): 26.
[5]李焕荣, 胡瑞兰, 贾静. 蚕豆膨化休闲食品的研制[J]. 食品科学, 2006, 27(11): 627-631.
[6]刘素纯, 林亲录, 尹华, 等. 蚕豆辣酱的研制[J]. 食品科技, 2005(1): 52-55.
[7]胡善美. 孔乙己 下酒的茴香豆[J]. 食品与健康, 1995(1): 10-11.
[8]ENGEL W, BAHR W, SCHIEBERLE P. Solvent-assisted flavor evaporation: a new and versatile technique for the careful and direct isolation of aroma compounds from complex food matrices[J]. Eur Food Res Technol, 1999, 209(3/4): 237-241.
[9]BLANCH G P, TABERA J, HERRAIZ M, et al. Preconcentration of volatile components of foods: optimization of the steam distillationsolvent extraction at normal pressure[J]. J Chrom, 1993, 628(2): 261-268.
[10]田红玉, 孙宝国, 张慧丽. 香成分分析中的样品制备技术[J]. 北京工商大学学报: 自然科学版, 2006, 24(5): 1-5.
[11]YU Ainong, SUN Baoguo, HU Weibing. Top note compounds of Chinese traditional bacteria-fermented soybean[J]. Natural Product Research, 2008, 22(17): 1552-1559.
[12]陆占国, 张怀涛, 李伟. 茴香籽香气成份研究[J]. 中国调味品, 2008 (11): 76-79.
[13]贾春晓, 张西安, 孙晓丽, 等. 顶空-固相微萃取法并气相色谱-质谱法测定八角茴香挥发性成分[J]. 郑州轻工业学院学报: 自然科学版, 2009, 24(2): 21-26.
[14]雷宏杰. 蚕豆酱质量的初步研究[D]. 无锡: 江南大学, 2009.
[15]谢建春. 现代香味分析技术及应用[M]. 北京: 中国标准出版社, 2008: 17-18.
[16]KIM T H, LEE S M, KIM Y S, et al. Aroma dilution method using GC injector split ratio for volatile compounds extracted by headspace solid phase microextractio[J]. Food Chem, 2003, 83(1): 151-158.
[17]PITAROKILI D, TZAKOU O, LOUKIS A, et al. Volatile metabolites fromSalvia fruticosaas antifungal agents in soilborne pathogens[J]. J Agri Food Chem, 2003, 51(11): 3294-3301.
[18]SIDES A, ROBARDS K, HELLIWELL S, et al. Changes in the volatile profile of oats induced by processing[J]. J Agri Food Chem, 2001, 49(5): 2125-2130.
[19]GOMEZ E, LEDBETTER C A, HARTSELL P L. Volatile compounds in apricot, plum, and their interspecific hybrids[J]. J Agri Food Chem, 1993, 41(10): 1669-1676.
[20]FOKIALAKIS N, MELLIOU E, MAGIATIS P, et al. Composition of the steam volatiles of sixEuphorbiaspp. from Greece[J]. Flavour Fragr J, 2003, 18(1): 39-42.
[21]ANSORENA D, GIMENO O, ASTIASARAN I, et al. Analysis of volatile compounds by GC-MS of a dry fermented sausage: chorizo de Pamplona[J]. Food Res Int, 2001, 34(1): 67-75.
[22]FLAMINI G, CIONI P L, MORELLI I. Analysis of the essential oil of the aerial parts ofViola etruscafrom Monte Labbro (South Tuscany, Italy) andin vivoanalysis of flower volatiles using SPME[J]. Flavour Fragr J, 2002, 17(2): 1.4.7-149.
[23]FERNANDO L N, GRUN I U. Headspace-SPME analysis of volatiles of the ridge gourd (Luffa acutangula) and bitter gourd (Momordica charantia) flowers[J]. Flavour Fragr J, 2001, 16(4): 289-293.
[24]LALEL H J D, SINGH Z, CHYE TAN S. Glycosidically-bound aroma volatile compounds in the skin and pulp of ‘Kensington Pride’mango fruit at different stages of maturity[J]. Postharvest Biol Technol, 2003, 29(2): 205-218.
[25]EI-GHORAB A H, MANSOUR A F, EI-MASSRY K F. Effect of extraction methods on the chemical composition and antioxidant activity of Egyptian marjoram (Majorana hortensisMoench)[J]. Flavour Fragr J, 2004, 19(1): 54-61.
[26]CONGIU R, FALCONIERI D, MARONGIU B, et al. Extraction and isolation ofPistacia lentiscusL. essential oil by supercritical CO2[J]. Flavour Fragr J, 2002, 17(4): 239-244.
[27]PITAROLILI D, COULADIS M, PETSIKOS-PANAYOTAROU N, et al. Composition and antifungal activity on soil-borne pathogens of the essential oil ofSalvia sclareafrom Greece[J]. J Agri Food Chem, 2002, 50(23): 6688-6691.
[28]MIMICA-DUKIN, KUJUNDS, SOKOVIM, et al. Essential oil composition and antifungal activity ofFoeniculum vulgareMill. obtained by different distillation conditions[J]. Phytother Res, 2003, 17 (4): 368-371.
[29]COLAHAN-SEDERSTROM P M, PETERSON D G. Inhibition of key aroma compound generated during ultrahigh-temperature processing of bovine milk via epicatechin addition[J]. J Agri Food Chem, 2005, 53 (2): 398-402.
[30]DONNELLY J R, ABDEL-HAMID M S, JETER J L, et al. Application of gas chromatographic retention properties to the identification of environmental contaminants[J]. J Chromatography A, 1993, 642(1/2): 409-415.
[31]孙宝国. 食用调香术[M]. 2版. 北京: 化学工业出版社, 2010.
Analysis of Volatile Components from Fennel Bean
SUN Pei-pei,HUANG Ming-quan*,SUN Bao-guo,LIU Dan
(Beijing Key Labaratory of Flavor Chemistry, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing Technology and Business University, Beijing 100048, China)
The volatile components of fennel bean were extracted by head space solid phase microextraction (HS-SPME) and analyzed by gas chromatography mass spectrometry (GC-MS). The optimum operating conditions for SPME were determined as following: head space adsorption at 55 ℃ for 60 min using a 75 μm Carboxen/PDMS fiber. A total of 38 compounds were identified, representing 86.87% of the total peak area and consisted of 15 hydrocarbons, 13 aldehydes and ketones, 3 alcohols, 3 phenols, 3 ethers and 4 other compounds. The prevailing compounds were 1-methoxy-4-(1-propenyl) benzene (40.75%), nonanal (4.16%), cis-anethole (3.77%), limonene (3.48%), and estragole (2.9%).
fennel bean;head space solid phase microextraction (HS-SPME);gas chromatography-mass spectrometry (GC-MS);volatiles
TS207.3
A
1002-6630(2011)20-0200-06
2011-06-30
“十二五”国家科技支撑计划项目(2011BAD23B01);北京市属高等学校人才强教计划项目(PHR20090504)
孙培培(1985—),女,硕士研究生,研究方向为香料化学。E-mail:zixinsp@163.com
*通信作者:黄明泉(1977—),男,讲师,博士研究生,研究方向为香料化学。E-mail:hmqsir@163.com
