zVAD-fmk 对未成熟树突状细胞诱导初始性CD4+ T 细胞分化为调节性 T 细胞影响的体外研究
2011-10-30骆志清王毅钱坤罗志刚郭军华屈小勇
骆志清 王毅 钱坤 罗志刚 郭军华 屈小勇
Sakaguchi 等[1]于 1995 年在小鼠和体外实验中发现,胸腺来源的CD4+CD25+T 细胞具有免疫无反应性和免疫抑制性两大功能特征。辅助性 T 细胞的诱导和分化主要是幼稚性 T 细胞通过抗原提呈细胞(antigen presenting cell, APC)与 T 细胞表面表达的 TCR 结合产生的。树突状细胞(dendritic cell, DC)是体内最强的抗原提呈细胞,它来源于造血干细胞,广泛分布于淋巴组织和非淋巴组织,能够显著刺激初始状 T 淋巴细胞增殖。DC 与其他抗原呈递细胞相比其最大的特点是能显著刺激初始型 T 细胞增殖,是唯一能活化初始型 T 细胞的抗原呈递细胞。在 T 细胞分化过程中,活化的 T 细胞对 Fas 介导的凋亡信号敏感性增加,部分 APC 亚群可高表达 Fasl(Fas配体),可以致活化的 T 细胞凋亡并诱导特异性免疫耐受[2]。本研究前期已经建立了较为成熟的 DC 体外培养方法,我们通过阻断 T 淋巴细胞凋亡信号通路,以未成熟树突状细胞(immature dendritic cells, imDC)诱导初始性CD4+T 细胞生成调节性T细胞(regulatory T cell,Treg),通过其表面分子的表达,计算初始性 CD4+T 细胞转化为Treg 细胞的转化率,研究 imDC和 Caspase 通路在 Treg 细胞生成中的作用,为临床免疫耐受的研究提供理论依据。
材料和方法
一、材料
RPMI-1640、胎牛血清和淋巴细胞分离液、重组人 IL-4、IL-2、GM-CSF、TNF-α;人 CD4+T细胞阳性分选试剂盒和MPCS磁力架;鼠抗人CDla、CD80、CD83单克隆抗体以及鼠抗人CD4、CD25单克隆抗体;丝裂霉素、DMSO、zVAD-fmk;单克隆抗体-磁珠分离系统(Mini-MACS)。
二、方法
(一) imDC 的体外诱导
取健康成年人肘静脉血约 50 ml 以梯度密度离心法分离人外周血中单个核细胞。通过 6 孔板培养的单核细胞为半贴壁细胞,以 rhIL-4、rhGM-CSF培养5 d,收集imDC,自第7天开始换用带有rhTNF-α、rhGM-CSF的培养基,3 d半量换液,第14天收获成熟的DC(mDC)。
(二)DC的鉴定
流式细胞术( flowcytometry, FCM)检测DC 表面分子。
(三)CD4+ T 细胞的提取
采集平产健康胎儿脐血10 ml,密度梯度离心法 (同上)分离单个核细胞,将上述分装单个核细胞 (4℃)通过免疫磁珠法分选出CD4+T细胞。
(四)实验分组
脐血初始性 CD4+T 细胞均分为5 组:空白组为CD4+T细胞 (1×106/ml)加入等容量的RPMI-1640单独培养。外周静脉血imDC(1×105/ml)与初始性CD4+T细胞 (1×106/ml)混合培养,按不加其他试剂、加入 10 μmol/L、20 μmol/L、30 μmol/L 浓度的 zVAD-fmk 分为 :混合对照组、低浓度zVAD-fmk组、中浓度zVAD-fmk组、高浓度zVAD-fmk组。各组细胞于20 U/ml IL-2,37℃,5﹪CO2培养箱中培养5 d。
(五)T 细胞转化率的测定
取混合培养 5 d 的 T细胞悬液(1×106/ml),加入FITC-CD4和FITC-CD25单克隆抗体,以流式细胞仪检测CD4、CD25分子的表达率。
三、统计学处理
实验数据应用 SPSS 13.0 统计软件处理,表面分子表达结果和细胞转化率检测指标用x±s表示,组间的差异比较采用单向方差分析(One-way ANOVA),判断imDC低、中、高浓度组zVAD-fmk组、imDC不加zVAD-fmk和空白组是否存在差异,采用LSD法两两比较,以P< 0.05为差异有统计学意义。
实验结果
一、流式细胞术检测 DC 表面分子
培养至7d的imDC细胞悬液,加入荧光标记的单克隆抗体PE-CD1a、PE-CD80和PECD83,经FCM检测其细胞表面分子的表达,与培养至14d的成熟DC表面分子CD80、CD83和CD1a比较,P均< 0.05,imDC表面表达的CD80,CD83和CD1a分子明显低于DC的表达,其流式结果见表1及图1~7。
二、CD4+T 细胞转化为 Treg 细胞的转化率的测定
从胎儿脐血提取的 CD4+T 细胞与 imDC 混合培养 5 d 后,加入FITC-CD4和PE-CD25单克隆抗体,以流式细胞仪检测CD4和CD25分子的表达率。
各组间经过均数的两两比较,混合对照组与低浓度zVAD-fmk组之间,以及中浓度zVAD-fmk组与高浓度zVAD-fmk组之间T细胞转化率差异无显著性(P> 0.05),其他各组间转化率差异有统计学意义(P< 0.05)(表2,图8~13)。
表1 imDC 与成熟 DC 表面分子表达的流式细胞仪检测结果(﹪,± s)
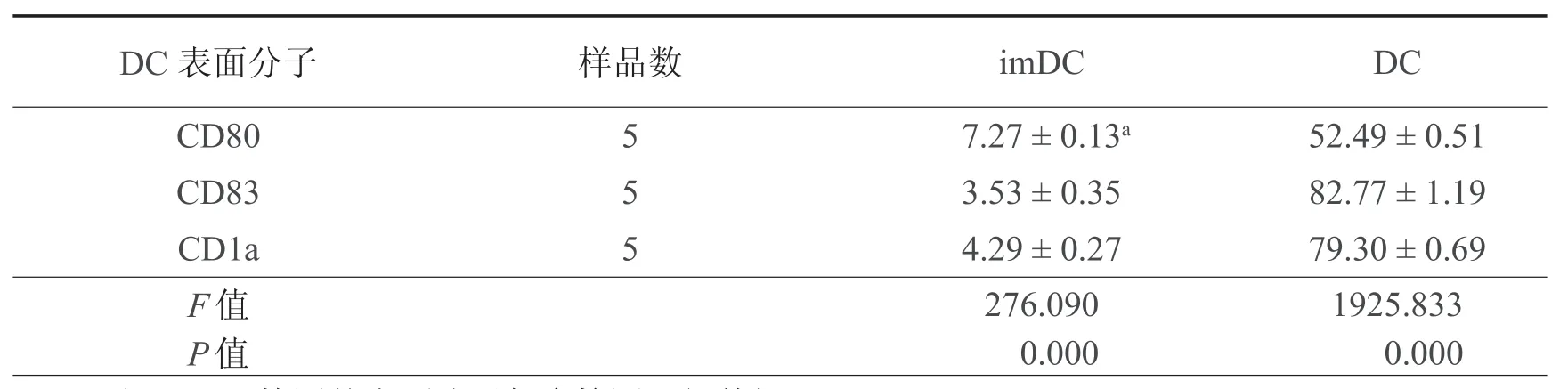
表1 imDC 与成熟 DC 表面分子表达的流式细胞仪检测结果(﹪,± s)
注:aFCM检测的表面分子每个检测5组数据
DC 表面分子 样品数 imDC DC CD80 5 7.27 ± 0.13a 52.49 ± 0.51 CD83 5 3.53 ± 0.35 82.77 ± 1.19 CD1a 5 4.29 ± 0.27 79.30 ± 0.69 F 值 276.090 1925.833 P 值 0.000 0.000

图1 imDC 表面 CD80 表达率流式
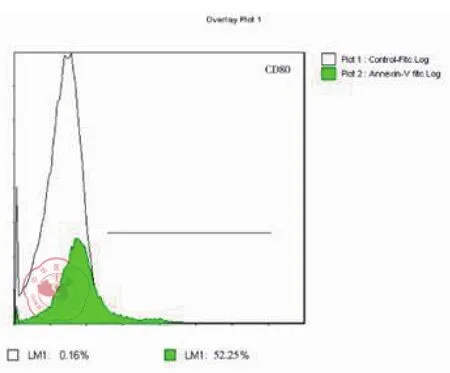
图2 DC 表面 CD80 表达率流式
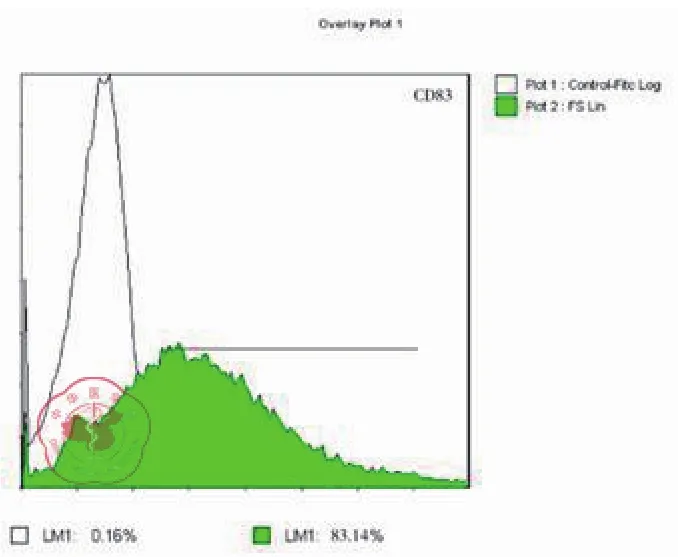
图4 DC 表面 CD83 表达率流式
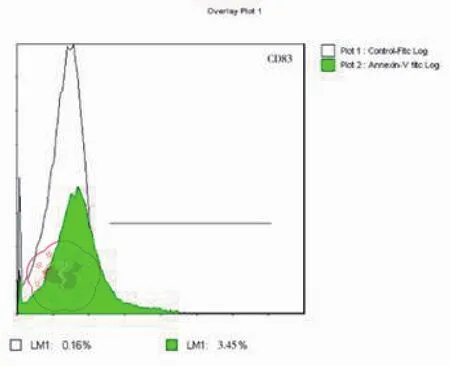
图3 imDC 表面 CD83 表达率流式
图5 imDC 表面 CD1a 表达率流式

图6 DC 表面 CD1a 表达率流式
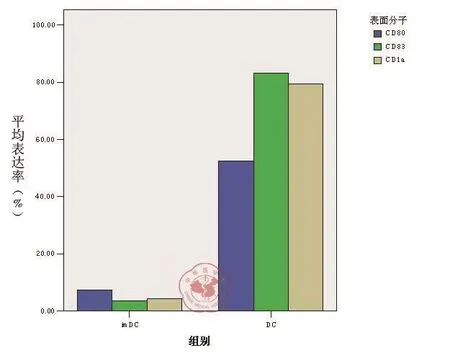
图7 imDC与成熟 DC 表面分子表达的流式细胞仪检测结果

表2 T 细胞转化率的检测结果

图8 空白组 T 细胞转化率流式

图9 混合对照组 T 细胞转化率流式
图10 低浓度组 T 细胞转化率流式
图11 中浓度组 T 细胞转化率流式
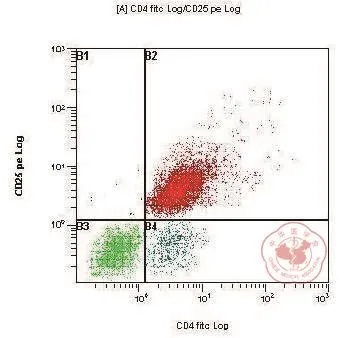
图12 高浓度组 T 细胞转化率流式

图13 T 细胞转化率的检测结果
讨 论
imDC模型和Treg 细胞模型建立是当前移植免疫耐受的研究重点之一,目前已经成功建立起了由人外周血单核细胞分离诱导培养的imDC和由人外周血分离的CD4+T细胞,并且也找到了从imDC诱导初始性T细胞转化为CD4+CD25+T细胞的方法,而CD4+CD25+T细胞具有免疫耐受的功能,因此前述的研究工作对于进一步探讨建立移植免疫耐受奠定了一定的基础。但是imDC诱导CD4+T细胞转化为Treg细胞的机制仍未十分明了,凋亡细胞传导通路在Treg细胞的活化和成熟过程中所起到的作用也未明了。因此本研究通过建立imDC的细胞模型,与初始性CD4+T细胞混合培养,诱导初始性CD4+T细胞转化为Treg细胞,并阻断T细胞的Caspase信号传导通路,以研究该信号通路在CD4+T转化为CD4+CD25+T细胞过程中的作用,为免疫耐受在临床中的应用提供理论依据。
一、imDC 诱导脐血初始性 CD4+T 细胞转化为Treg细胞
本实验的关键在于以 imDC 与脐血初始性CD4+T 细胞进行混合培养,从而诱导其转化为Treg 细胞。已有研究证明,DC 多数由其表面的自身抗原与Treg 细胞表面表达的TCR相互作用,使一些具有高亲和力的或者竞争结合自身抗原的胸腺细胞不被克隆清除而是继续分化,参与 Treg 的阳性选择[3-4]。DC 诱导产生效应性T细胞还是 Treg 细胞在很大程度上取决于其成熟状态,即 DC/imDC 的比例[5]。如果能控制 DC 的成熟状态,就有可能使T细胞在活化阶段发生转化。imDC 诱导 Treg 的机制在于其虽然可以摄取自身抗原,但是其呈递抗原的能力不强,并且 imDC 上缺乏能使 CD4+T 细胞活化为效应性 T细胞的共刺激分子,如前所述的CD80和CD86 等分子,所以当T细胞接受 DC提呈的自身或外周抗原后不能活化为效应性 T细胞,从而产生对此抗原的耐受。但是 imDC 诱导 Treg 的分子机制还不是很清楚。
二、Caspase 信号通路的阻断对诱导 Treg 细胞的影响
zVAD-fmk为caspase阻断剂,能够抑制细胞 AICD 发生过程中多种 Capase酶的活性。zVAD-fmk 是一种细胞可通透性泛 Caspase抑制物,不可逆地结合在 Caspase 蛋白酶的催化位点,可抑制细胞凋亡的诱导[6-7]。本研究在DC与初始性 CD4+T 细胞混合培养时以 zVAD-fmk为阻断剂,阻断初始性CD4+T 细胞凋亡信号传导通路,研究 imDC 细胞诱导 Treg 细胞时是否通过 Caspase 通路起作用,从而促进初始性 CD4+T细胞转化为CD4+CD25+T细胞。
本研究以低浓度的GM-CSF 和 IL-4 诱导出第 7 天的 DC(即imDC)与初始性CD4+T细胞混合培养,各组细胞分别培育5 d后再以 FCM检测初始性 CD4+T细胞转化为 Treg 的转化率。经FITC-CD4抗体和PE-CD25抗体标记的各组 T 细胞,通过流式细胞仪检测其转化率,其结果除混合对照组和低浓度组、中浓度组和高浓度组之间外,各组间差异有统计学意义(P< 0.05)。结果说明:加入zVAD-fmk 并与 imDC 细胞混合培养的 T 细胞转化率相对于未加入阻断剂的T 细胞较低,同时 Caspase 信号通路对 zVAD-fmk 无浓度依赖性,而表现出“全”或“无”的效应。zVAD-fmk 低于阈浓度时,对信号通路无影响,超过阈浓度时,效果不随浓度增高。通过本实验可以提示:人外周血 imDC 可以诱导初始性 CD4+T 细胞转化为CD4+CD25+T 细胞,从而诱导外周免疫耐受。
三、展望
建立移植免疫耐受是解决移植排斥反应的一个可行方法。但是目前对于诱导免疫耐受仅限于体外细胞研究,并且主要集中在 imDC 对免疫耐受的诱导和Treg 细胞在耐受中的作用。DC 作为体内最强的 APC,在其未成熟阶段其表面缺乏共刺激分子,虽然有较强的抗原呈递能力,却不能有效地激活 T 细胞,从而产生耐受。目前,对 Treg 细胞的研究正步入一个新的阶段,已从对其存在的证实转到对其生物学意义的关注,对 Treg 细胞生物学作用的揭示,不但能更好的理解机体免疫耐受的机制,还有助于对感染免疫、肿瘤的发生机理和移植耐受诱导的认识。本实验通过人外周血诱导生成 imDC,由 imDC 与初始性CD4+T细胞混合培养,研究imDC 诱导免疫耐受的机制,并通过阻断 T 细胞 Fas/FasL通路,探讨凋亡信号在 imDC 诱导产生 Treg 细胞中的作用。从信号通路水平对 DC 和 Treg 细胞的研究,本研究探讨了外周免疫耐受的形成机制,对临床器官移植病人的免疫耐受的诱导提供了理论依据。
1 Sakaguchi S, Sakaguchi N, Asano M, et al. Immunological self-tolerance maintained by activated T cells expression IL-2 receptora-chains (CD25):Breakdown of single mechanism of self-tolerance causes various autoimmune disease[J]. Immunol, 1995, 155(3):1151-1164.
2 Suss G, Shortman K. A subclass of dendritic cells kills CD4 T cells via Fas/Fas-ligand-induced apoptosis[J]. Exp Med, 1996, 183(4):1789-1796.
3 Kawahata K, Misaki Y, Yamauchi M, et al. Generation of CD4+CD25+regu1atory T cells from autoreactive T cel1s simultaneously with their negative selection in the thymus and from nonautoreactive T cells by endogenous TCR expression[J]. Immunol, 2002, 168 (9): 4399-4405.
4 Pacholczyk R, Kraj P, lgnatowicz L. Peptide specificity of thymic selection of CD4+CD25+T cells[J]. Immunol,2002, 168 (2): 613-620.
5 Jonuleit H, Schmitt E, Steinbrink K,et al. Dendritic cells as a tool to induce anergic and regulatory T cells[J]. Trends in Immunology, 2001, 22 (7):394-400.
6 Eric A, Atkinson. Michele Barry Cytotoxic T Lymphocyte-assisted Suicide. Caspase-3 activation is primarily the result of the direct action of granzyme B[J]. Biol Chem, 1998, 273(33): 21261-21266.
7 Ella Bossy-Wetzel. Mitochondrial cytochrome c release in apoptosis occurs upstream of DEVD-specific caspase activation and independently of mitochondrial transmembrane depolarization[J]. EMBO,1998, 17(1):37-49.
