乳腺癌细胞肿瘤标记物表达及其与临床病理特征相关性研究
2011-05-06王瑾郑芹杨惠玲
王瑾 郑芹 杨惠玲
乳腺癌细胞肿瘤标记物表达及其与临床病理特征相关性研究
王瑾 郑芹 杨惠玲
目的探讨肿瘤标记物14-3-3σ、Akt和p27Kip1蛋白在乳腺癌中的表达及其与临床病理特征及Her-2的相关性。方法选取43份乳腺癌石蜡标本和10份正常乳腺组织标本,采用免疫组织化学技术( SABC )检测组织中14-3-3σ、Akt和p27Kip1蛋白的表达,结合临床资料和随访资料,进行回顾性研究,作出评估。统计学采用 Wilcoxon 秩和检验或 Kruskal-Wallis 检验,并采用 Kaplan Meier 法进行单因素生存分析。结果14-3-3σ、Akt可表达于细胞胞浆,而p27Kip1蛋白可表达于细胞胞浆或(和)胞核。胞浆14-3-3σ、Akt或p27Kip1蛋白胞浆表达均与淋巴结转移和临床分期呈正相关(P < 0.01或P < 0.05),并提示生存相对较差,p27Kip1蛋白胞浆错误定位的患者预后不良。Her-2蛋白可能对PI3k-Akt和p27Kip1通路参与乳腺癌致病起到一定作用。结论14-3-3σ、Akt或p27Kip1蛋白可作为判断乳腺癌淋巴转移和预后评估的有效指标。
乳腺癌;肿瘤标记物;14-3-3σ 蛋白;Akt 蛋白;p27Kip1蛋白
乳腺癌(breast cancer)是严重威胁妇女健康的一种恶性肿瘤。目前,乳腺癌发病率已跃居我国妇女癌症发病首位[1]。以癌基因( oncogene )或抑癌基因( tumor suppressor gene )作为肿瘤标记物已取得很大进展,它通过检测各种癌基因和突变的抑癌基因及其产物,为肿瘤的诊断和进一步治疗提供依据。14-3-3σ 蛋白是一种分子伴侣,Akt 蛋白是一种蛋白激酶,p27Kip1蛋白是细胞周期负调控因子。不同的研究表明它们的表达与肿瘤的发生发展存在密切关系,并且它们之间有相互调节和(或)制约作用。本研究应用免疫组化法对Akt、p27Kip1及 14-3-3σ 蛋白在乳腺癌组织中的表达情况进行检测,并对其与乳腺癌临床病理特征的关系及生存时间进行分析,以探讨其在乳腺癌的发生和发展中的作用。
资料与方法
一、一般资料
筛查中山大学肿瘤防治中心2002年全年乳腺癌患者的资料,从中选择了43例根治性手术切除的乳腺癌石蜡标本;另外选取10例癌旁正常乳腺组织石蜡切片作对照。病例选取的条件包括:患者术前均未行放、化疗,术后均有明确的病理学诊断;年龄27 ~ 73岁,中位年龄47.0岁。根据2002年国际抗癌联盟 (UICC)的TNM分期法:T1(肿瘤最大径≤2 cm)11例,T2(肿瘤最大径> 2 cm,但≤5 cm)17例,T3(肿瘤最大径> 5 cm)12 例,T4[任何大小肿瘤,直接扩散到胸壁和皮肤(胸壁包括肋骨、肋间肌和前锯肌,不包括胸肌)]3例;N0(无区域淋巴结转移)20例,N1-3(有同侧或对侧区域淋巴结转移)23例;所取标本均无远处转移。Ⅰ期6例,Ⅱ期 (Ⅱa+Ⅱb)26例,Ⅲ期 ( Ⅲa+Ⅲb+Ⅲc )11例。
二、方法
Akt鼠抗人抗体购自 Cell Signaling 公司,p27Kip1兔多抗抗体及14-3-3σ山羊多抗抗体购Santa Cruz 公司,二抗及DAB显色试剂盒购自武汉博士德生物工程有限公司。
标本经4﹪甲醛溶液固定,石蜡包埋,4 μm切片,免疫组化 SABC 法检测实验步骤按说明书进行。抗原采用高温高压修复,用已知的阳性乳腺癌切片作阳性对照,用 PBS 取代一抗作阴性对照。
三、结果判读标准
14-3-3σ、Akt蛋白阳性着色为粗细不一的棕黄颗粒,主要定位于肿瘤细胞胞浆中;p27Kip1定位于肿瘤细胞核和(或)胞浆。染色按阳性细胞数占肿瘤细胞的比例进行分级[2-4]。Akt阳性细胞数 < 10﹪为(-),10﹪ ~ 50﹪为(+),> 50﹪为(+ +);P27Kip1阳性细胞数< 5﹪为(-),5﹪ ~ 50﹪为(+),> 50﹪为(+ +);14-3-3σ 阳性细胞数 < 10﹪为(-),10﹪ ~ 50﹪为(+),50﹪ ~ 75﹪为(+ +),> 75﹪为(+ + +)。
四、统计分析
应用SPSS 13.0软件包进行统计分析。计数资料分析组间相关采用秩和分析,同时进行Kaplan Meier 生存分析。以P < 0.05为差异具有统计学意义
结 果
一、通过采用免疫组织化学方法检测发现与正常乳腺组织相比,在乳腺癌组织中 14-3-3σ、Akt 蛋白过表达,且定位于细胞浆(图1,2);p27Kip1蛋白为细胞核和(或)细胞浆表达(图3,4)。
二、采用 Wilcoxon 秩和检验或 Kruskal-Wallis 检验(表1),分析发现胞浆 14-3-3σ、Akt蛋白或 p27Kip1蛋白胞浆表达均与淋巴结转移和临床分期呈正相关;应用 Kaplan Meier 法进行单因素生存分析并所绘制5年生存曲线结果表明(图5,6)胞浆 14-3-3σ、Akt 蛋白过表达的病人生存期相对较短,p27Kip1蛋白胞浆错误定位的患者预后不良。
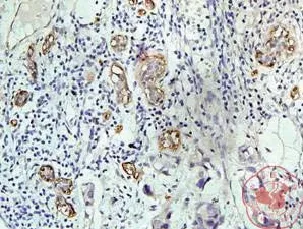
图1 14-3-3σ 蛋白在乳腺癌中表达(×200)
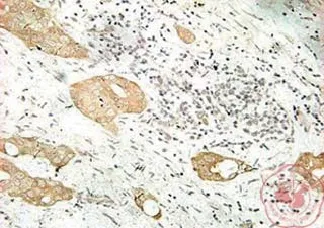
图2 Akt 蛋白在乳腺癌中表达(×200)
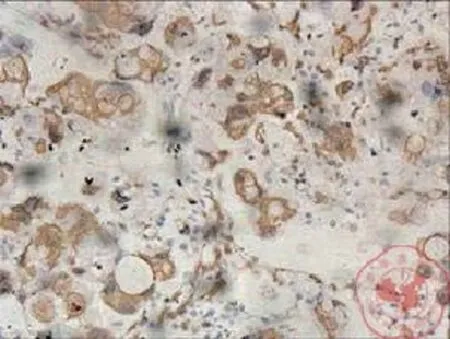
图3 p27Kip1蛋白在乳腺癌细胞浆中表达(×200)

图4 p27Kip1蛋白在乳腺癌细胞核中表达(×400)

表1 14-3-3σ、Akt 和 p27Kip1蛋白表达与乳腺癌临床病理特征相关性分析(例)

图5 14-3-3σ 蛋白表达水平与生存时间( Kaplan-Meier 生存曲线)

图6 Akt 蛋白表达水平与生存时间( Kaplan-Meier 生存曲线)
三、通过比较 14-3-3σ、Akt、p27Kip1蛋白与 Her-2的相关性发现,与 Her-2 阴性组比较,Her-2 阳性组的14-3-3σ、Akt 蛋白表达升高;而胞核 p27Kip1蛋白表达降低,胞浆表达水平升高;
四、Akt 与 ER 呈正相关,胞浆 p27Kip1蛋白表达与 PR 呈正相关,提示 PI3K/Akt 通路可能参与雌激素类蛋白表达,但具体机制仍有待进一步研究。同时,胞浆 Akt 和胞浆 p27Kip1表达水平与 VEGF 呈正相关,提示在 VEGF 促进血管内皮细胞增殖和抗凋亡的功能中,Akt蛋白和 p27Kip1蛋白可能发挥一定的作用。
讨 论
一、14-3-3σ 蛋白,又称人乳腺癌上皮标志物-1(human mammary epithelial marker 1, HEM1)[5],是目前研究的所有14-3-3蛋白各亚型中与肿瘤关系最为密切的亚型[6]。Mong-Hong Lee等[7]在乳腺癌细胞株的研究发现 14-3-3σ 可以与 p53 结合稳定其表达,抑制其降解过程,提高其转录活性,使细胞周期阻滞在G2/M 期,从而抑制肿瘤增殖。
本研究是通过免疫组织化学方法检测 14-3-3σ 在乳腺癌组织中和正常乳腺组织中的表达情况,结果为14-3-3σ 蛋白在乳腺癌组织中表达是过量的。这一结果与多数研究中所报道的 14-3-3σ 蛋白在多种肿瘤中表达下降并不一致,其中有报道认为 14-3-3σ 蛋白在乳腺癌的表达增加[8],而 Moreira 等[9]曾报道 14-3-3σ在乳腺癌表达下调只是偶发事件(表达缺失率3/68)。但多数报道支持由于 14-3-3σ 启动了 CpG 岛甲基化而导致在乳腺癌中该基因沉默[10]。但在此研究中14-3-3σ蛋白在Her-2阳性组织中表达增强,是否提示着14-3-3σ蛋白在Akt蛋白增加而p27Kip1蛋白降低情况下出现代偿性增高作用,14-3-3σ 蛋白的表达与肿瘤淋巴转移,TMN 分期有关,且随临床分期的增高,14-3-3σ 蛋白表达明显增高。这些均提示 14-3-3σ 蛋白在乳腺癌中的表达增多可能是一个预后不佳的潜在因素。生存曲线显示随 14-3-3σ 蛋白表达增强,生存率出现下降趋势。
二、Akt蛋白,又称为蛋白激酶B ( protein kinase B, PKB ),是一种丝氨酸/苏氨酸蛋白激酶,是磷脂酰肌醇-3-激酶( phosphatidylinositol 3-kinase, PI3K )下游的直接靶蛋白,Akt 的活化依赖于 PI3K 对含有肌醇的膜磷脂酰肌醇环上3位羟基的特异磷酸化[11]。Akt 可通过多种途径或作用多种因子促进调亡。例如,Akt 可以作用于下游的凋亡蛋白 Bad,使其磷酸化,抑制其促凋亡作用[12];Akt 磷酸化 Forkhead 蛋白家族,促进 Forkhead 蛋白离开细胞核,从而抑制促凋亡基因转录[13];Akt 可催化 MDM2 的 Ser166 和 Ser188 磷酸化,而磷酸化的 MDM2更有效地转到核内,促使p53降解[14],从而抑制凋亡。此外,Akt 参与多种途径调节细胞周期的进程,如 Akt 可磷酸化细胞周期抑制物P27Kip1使其失活,阻止 P27Kip1进入细胞核从而抑制P27Kip1介导的 G1 期阻滞,促进增殖[15]。
本研究显示乳腺癌中 Akt 蛋白在乳腺癌组织中高表达。此外,本研究对临床病理资料进行分析,Akt 与淋巴结转移和临床分期显著相关。这说明 Akt 可能与乳腺癌的发生发展有关,可用于临床乳腺癌病情和治疗的判断。对于生存分析,生存曲线显示了Akt 过表达的患者5年的生存率低于其表达阴性的患者。
三、p27Kip1蛋白,肿瘤的发生发展与细胞周期调控异常关系密切。细胞周期由正调控因子细胞周期依赖性蛋白激酶(cyclin-dependent kinase, CDK)和负调控因子CDK抑制因子(CDK inhibitor, CKI)共同作用而精切调控。p27Kip1为 CKI 两大家族之一的成员,p27Kip1定位于染色体12p13,主要通过对细胞周期从G1 期到S期的转换抑制来抑制细胞增殖,其主要通过抑制多种 Cyclin-CDKs复合物(如cyclinE/CDK2, cyclinD1/CDK4复合物)的活性来实现其对细胞周期的调控,它可抑制多种 Cyclin-CDKs 复合物的活性,对细胞周期进行负调控,抑制细胞分裂和增殖,促进细胞分化和凋亡[16]。
p27Kip1蛋白发挥活性的区域在细胞核,当 p27Kip1蛋白自身被磷酸化后,磷酸化的 p27Kip1从细胞核转入细胞浆,在细胞浆内通过泛素化-蛋白水解途径水解失活[17]。本研究检测 p27Kip1蛋白在乳腺癌组织的胞核表达率低于正常乳腺组织核表达。同时在胞浆表达丰富,高于正常乳腺组织胞浆表达。由此说明,p27Kip1可在胞浆和胞核表达,但对于肿瘤组织,由于磷酸化的 p27Kip1从胞核泄漏入胞浆,使得胞浆表达增加。实验表明,p27Kip1蛋白与淋巴结转移和临床分期有密切关系,与肿瘤大小无关。p27Kip1蛋白胞核表达降低及胞浆表达增加,可提示 p27Kip1蛋白从核泄入浆的量增多,造成 p27Kip1泛素化失活,从而失去抑制肿瘤的功能。p27Kip1蛋白的核浆定位颠倒可用于提示乳腺癌的发展程度。生存曲线显示了错误的核浆定位可能将不利于乳腺癌的预后。
四、乳腺癌的发生发展是一个多阶段和多步骤的复杂过程,其中涉及众多癌基因和抑癌基因失衡、信号通路传导异常和细胞周期调节的改变等。PI3k-Akt 和 p27Kip1通路参与乳腺癌的发生发展,并在细胞膜Her-2 蛋白参与下发挥作用(图7)。实验表明,在 Her-2 阴性(缺失状态)的乳腺癌组织中 Akt 蛋白的表达水平低于其在 Her-2 阳性组织中,提示 Her-2 存在情况下,Akt 蛋白表达增加,促进肿瘤细胞的增殖。同时 p27Kip1蛋白的胞核表达在 Her-2 阳性乳腺癌组织中也降低,而胞浆组织 p27Kip1蛋白表达水平升高,促进 p27Kip1蛋白从胞核到胞浆的释放和降解,失去抑制肿瘤的作用。以上提示,Her-2 蛋白存在或者缺失可能对 PI3k-Akt 和 p27Kip1通路有直接影响。14-3-3σ 蛋白在 Her-2 阳性组织中表达增强,其水平高于在 Her-2 阴性的乳腺癌组织中。根据以往的研究,14-3-3σ 作为一种抑癌基因可直接抑制Akt的表达,从而增强 p27Kip1蛋白的细胞周期负调控作用;也可以增加 p27Kip1蛋白的稳定性,阻止 p27Kip1蛋白出核发生降解[18]。但在此研究中 14-3-3σ 蛋白在 Her-2 阳性组织中表达增强,是否提示着 14-3-3σ 蛋白在Akt蛋白增加而 p27Kip1蛋白降低情况下出现代偿性增高作用、还是一种异常的反应、或者存在另外的蛋白分子影响其表达?这些需进一步探讨。
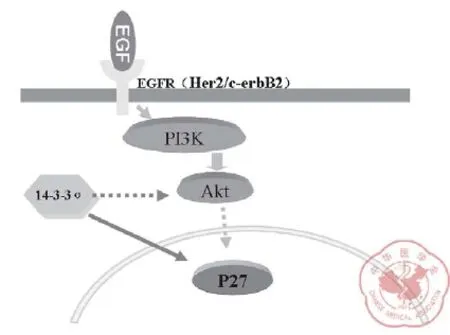
图7 Her-2 与 PI3K-Akt 通路在乳腺癌发病机制中作用
1 Yang L, Parkin DM, Ferlay J, et a1. Estimates of cancer incidence in China for 2000 and projections for 2005[J]. Cancer Epidemiol Biomarkers Prev, 2005, 14(1):243-250.
2 Liang J, Zubovitz J, Petrocelli T, et al. PKB/Akt phosphorylates p27, impairs nuclear import of p27 and opposes p27-mediated G1 arrest[J]. Nat Med, 2002, 8(10):1153-1160.
3 Moreira JM, Ohlsson G, Rank FE, et al. Down-regulation of the tumor suppressor protein 14-3-3sigma is a sporadic event in cancer of the breast[J]. Mol Cell Proteomics, 2005, 4(4):555-569.
4 Motti ML, Califano D, Troncone G, et al. Complex regulation of the cyclin-dependent kinase inhibitor p27Kip1in thyroid cancer cells by the PI3K/AKT pathway: regulation of p27Kip1expression and localization[J]. Am J Pathol, 2005, 166(3):737-749.
5 Prasad GL, Valverius EM, McDuffi e E, et al. Complementary DNA cloning of a novel epithelial cell marker protein, HME1, that may be down-regulated in neoplastic mammary cells[J]. Cell Growth Differ, 1992, 3(8):507-513.
6 HermekingH. The 14-3-3 cancer connection[J]. NatRev Cancer, 2003, 3(12):931-943.
7 Lee MH, Lozano G. Regulation of the p53-MDM2 pathway by 14-3-3σ and other proteinsv[J]. Seminars in Cancer Biology, 2006,16(3):225-234.
8 SimookaH, OyamaT, SanoT, et al. Immuno-histochemicalanalysis of14-3-3 sigma and related proteins in hyperplastic and neoplastic breast lesions, with particular reference to early carcinogenesis [J]. Pathol Int, 2004, 54(8):595-602.
9 Moreira JM, Ohlsson G, Rank FE, et al.Down-regulation of the tumor suppressor protein 14-3-3sigma is a sporadic event in cancer of the breast[J]. Mol Cell Proteomics, 2005, 4(4):555-569.
10 Mhawech P, Benz A, Cerato C, et al. Down regulation of 14-3-3sigma in ovary, prostate and endometrial carcinomas is associated with CpG island methylation[J]. Mod Pathol, 2005,18(3):340-348.
11 Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296(5573):1655-1657.
12 Shimamura H, Terada Y, Okado T, et al. The PI3-kinase-Akt pathway promotes mesangial cell survival and inhibitsapoptosis in vitro via NF-kappa B and Bad[J]. J Am Soc Nephrol, 2003, 14(6):1427-1434.
13 Brownawell AM, Kops GJ, Macara IG, et al. Inhibition of nuclear import by protein kinase B (Akt) regulates the subcellular distribution and activity of the forkhead transcription factor AFX[J]. Mol Cell Biol, 2001, 21(10):3534-3546.
14 Feng J, Tamaskovic R, Yang Z, et al. Stabilization of Mdm2 via decreased ubiquitination is mediated by protein kinase B/Akt-dependent phosphorylation[J]. J Biol Chem, 2004, 279(34):35510-35517.
15 Liang J, Zubovitz J, Petrocelli T, et al. PKB/Akt phosphorylates p27, impairs nuclear import of p27 and opposes p27-mediated G1 arrest[J]. Nat Med, 2002, 8(10):1153-1160.
16 Besson A, Dowdy SF, Roberts JM. CDK inhibitors: cell cycle regulators and beyond[J]. Dev Cell, 2008, 14(2):159-169
17 Pagano M, Tam SW, Theodoras AM, et al. Role of the ubiquitin-proteasome pathway in regulating abundance of the cyclin-dependent kinase inhibitor p27[J]. Science, 1995, 269(5224):682-685.
18 Yang H, Zhang Y, Zhao R, et al. Negative cell cycle regulator 14-3-3σ stabilizes p27Kip1by inhibiting the activity of PKB/Akt[J]. Oncogene, 2006, 25(33): 4585-4594.
Expression of three tumor markers in breast cancer tissue and its association with pathological characteristics
WANG Jin, ZHENG Qin, YANG Hui-ling. Department of Pathophysiology, Medical School, Sun Yat-sen University, GuangZhou 510080, China
YANG Hui-ling, E-mail: yanghl@mail.sysu.edu.cn
ObjectiveTo investigate the expressions of 14-3-3σ, Akt and p27Kip1proteins in breast cancer, and evaluate their relations with clinicopathologic status and Her-2 protein.MethodsExpressions of 14-3-3σ, Akt and p27Kip1proteins were examined by immunohistochemistry (SABC) method and the retrospective analysis was conducted based on clinical data and follow-up.ResultsHigh-level expression of 14-3-3σ.Akt or p27Kip1protein in cytoplasm positively correlated with lymph nodal metastasis and TNM stage (P < 0.01 or P < 0.05), and probably predicted a poor prognosis; Her-2 protein may contribute to tumorigenesis and development of breast cancer mediated by PI3k-Akt and p27Kip1pathway.Conclusion14-3-3σ、Akt and p27Kip1proteins may serve as useful markers to predict lymph nodemetastasis and to evaluate prognosis of patients with breast cancer.
Breast cancer;Tumor marker;14-3-3σ protein;Akt protein;p27Kip1protein
2011-03-07)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2011.01.011
510080 广州,中山大学病理生理学教研室
杨惠玲,E-mail:yanghl@mail.sysu.edu.cn
王瑾,郑芹,杨惠玲.乳腺癌细胞肿瘤标记物表达及其与临床病理特征相关性研究[J/CD]. 中华细胞与干细胞杂志: 电子版, 2011, 1(1): 74-80.
