人脐带间充质干细胞在急性肾小管坏死模型犬的体内分布及趋化性
2011-05-06李芳胡祥贾丹兵赵红梅周燕妮党智杰
李芳 胡祥 贾丹兵 赵红梅 周燕妮 党智杰
人脐带间充质干细胞在急性肾小管坏死模型犬的体内分布及趋化性
李芳 胡祥 贾丹兵 赵红梅 周燕妮 党智杰
目的观察人脐带间充质干细胞在家犬急性肾小管坏死模型的体内分布及归巢。方法健康家犬18只随机分为3组。模型1组:肌注新鲜配制的0.2﹪二氯化汞溶液7 ml/kg建立急性肾小管坏死模型,采用经外周静脉注射法输注体外分离培养并用4′,6-二脒基-2-苯基吲哚( DAPI )标记的人脐带间充质干细胞。模型2组:造模方法同模型1组,采用股动脉介入经左肾动脉直接注射体外分离培养并用 DAPI 标记的人脐带间充质干细胞。对照组:健康家犬,采用股动脉介入经左肾动脉直接注射体外分离培养并用 DAPI 标记的人脐带间充质干细胞。细胞输注后48 h处死动物留取肾脏、心脏、肝脏和胰腺,光镜及荧光显微镜下观察人脐带间充质干细胞植入实验动物体内后的分布及存活情况。结果(1)对照组肾脏未发现人脐带间充质干细胞存在,而模型1组及模型2组在家犬肾脏中均可观察到人脐带间充质干细胞存在;(2)模型1组及模型2组家犬肾脏中均有人脐带间充质干细胞存在,而心脏、胰腺不存在或少量存在人脐带间充质干细胞。结论(1)人脐带间充质干细胞移植后可在急性肾小管坏死肾脏内存活,对正常肾脏无影响;(2)对于急性肾小管坏死家犬,人脐带间充质干细胞选择性存在于肾脏内,对心脏、肝脏及胰腺无影响。
脐带;间充质干细胞移植;趋化性;急性肾小管坏死
急性肾功能衰竭(acute renal failure, ARF)是临床常见的急重症,在过去的几十年里,尽管肾脏替代治疗有了很大的发展,但ARF的发病率和死亡率一直居高不下。急性肾小管坏死(acute tubular necrosis, ATN)是 ARF 的最主要原因, ATN的修复直接关系到ARF的病程和预后。因此人们在不停地探索 ATN 发病及修复的机理,并试图找到促进肾小管上皮修复的新方法。
近年来,随着干细胞研究的不断深入,干细胞治疗方法为急性肾小管坏死患者带来了新的希望。有学者研究发现,骨髓来源的干细胞可以分化成肾小管上皮细胞,参与急性肾小管坏死的修复[1-2];并有研究发现,在肾脏缺血再灌注(ischemia-reperfusion injury, I/R)损伤兔模型中,经右肾动脉灌注移植兔自体骨髓干细胞,观察其对 I/R 损伤肾功能的影响,发现骨髓干细胞移植能较早降低肾脏 I/R 损伤后血清肌酐(serum creatinine, SCr)和尿素氮(blood urea nitrogen, BUN)水平,在一定程度上促进 I/R 损伤后肾功能修复[3];外源性骨髓间充质干细胞(mesenchymal stem cells, MSCs)能够迁移、定居于缺血再灌注损伤后的肾组织中并分化为肾小管上皮细胞,从而恢复肾脏的组织结构和功能[4]。人脐带来源的 MSCs 作为一种新的 MSCs 的来源有着无法比拟的优势:来源广泛、采集方便、无伦理法律限制、扩增迅速、免疫原性低、支持造血和多向分化等,有良好的应用前景[5]。本实验在已有研究基础上,采用人脐带 MSCs 作为研究对象,观察其在急性肾小管坏死家犬体内的分布及趋化性,为人脐带 MSCs 应用于临床肾脏疾病的治疗提供依据。
材料和方法
一、动物
健康家犬18只,体重15.0 ~ 20.0 kg,由哈尔滨医科大学动物中心提供。
二、试剂与仪器
超净工作台(中国苏净集团安泰公司),0.2﹪二氯化汞溶液(姜堰市环球试剂厂),IMDM 培养基(美国 Sigma 公司),胎牛血清(美国 Sigma 公司),4′,6-二乙酰基-2-苯基吲哚( DAPI )美国 Biotium 公司,人脐带 MSCs (深圳市北科细胞工程研究所),eclipseE400 型荧光显微镜( Nikon公司),Olympus CX6光学显微镜,组织切片机 Leica 公司、德国 Sigma 3K18 型台式离心机和SIEMENS 数字血管机( DSA )。
三、方法
(一)MSCs采集
DAPI 标记的人脐带 MSCs 由深圳市北科细胞工程研究所提供。脐带取自足月剖宫产健康孕妇。脐带采集之前产妇需做艾滋病病毒抗体、乙型肝炎病毒抗体、丙型肝炎病毒抗体、梅毒螺旋体抗体、谷丙转氨酶和支原体等检测,全部合格后方可采集,采集经家属同意并已签知情同意书。采集后 4℃ 保存,6 h 内培养,细胞活力≥90﹪,病原菌排查未检出细菌,细胞传代培养至第4代时用 DAPI 标记后用于本实验。先配制 DAPI 液:将无菌的 10 mg DAPI 溶于 200 ml 无血清的 DMEM/F12 培养基中,至终浓度 50 mg/L,避光备用。然后将脐带 MSCs 铺满培养瓶80﹪以上时,消化离心,吸干细胞团上面的培养基,加入已配好的DAPI 液10 ml,37℃,5﹪CO2培养箱中孵育 40 min,D-Hank 液反复洗涤 7 次,以去除未结合的多余的 DAPI,再次离心收集细胞,用 l ml 无血清培养基稀释至移植所需密度,放于冰浴中 1 h 之内进行细胞移植。同时收集最后一次洗涤液,荧光显微镜下 370 nm 荧光激发波长观察证实是否还有DAPI。
(二)实验动物及分组
所有实验动物均饲养于哈尔滨医科大学动物实验中心无特定病原体( SPF )屏障环境。所有动物随机编号,自由饮食,记录体重。随机分为3组:模型1组(6只)、模型 2 组(6只)和对照组(6只)。模型1组及模型 2 组家犬均采用 0.2﹪二氯化汞溶液按 7.0 ml/kg 体重剂量肌肉注射,建立急性肾衰竭模型。由于目前没有狗的急性肾衰竭的诊断标准,我们采用了内科学急性肾衰竭的定义,据此作为试验中急性肾衰竭的诊断标准[6]。对照组家犬照常饲养。观察动物一般情况及死亡情况。造模前及造模后24 、48及72 h分别采血进行血生化指标测定并留取尿液进行尿常规测定,通过血生化指标测定确定 ATN 模型建立成功,造模成功的实验动物进入实验,血肌酐的绝对值每日平均增加 44.2 μmol/L或 88.4 μmol/L;或在24 ~ 72 h内血肌酐值相对增加25﹪ ~ 100﹪[6]。
(三)人脐带 MSCs 移植
将造模成功的模型 1组家犬外周静脉缓慢注射以5 ml DAPI标记的人脐带 MSCs 悬液,细胞总数为1.5 × 107。将造模成功的模型 2 组和对照组家犬分别用 3﹪ 的异戊巴比妥钠,按照 0.15 ml/100 g 体重的剂量静脉麻醉。待麻醉起效后,将家犬仰位四肢固定于 X线下的平板上,于右腹股沟区切开皮肤,钝性分离右股动脉,用充满肝素盐水的硬膜外麻醉导管于右股动脉插入,经腹主动脉进入左肾动脉约0.3 ~ 0.5 cm,暂时压闭腹主动脉,移植组经导管缓慢注射 5 ml 脐带 MSCs 悬液,细胞总数为1.5 × 107,右股动脉切口用无损伤缝合线吻合。所有家犬继续喂养 48 h。
(四)移植细胞存活观察
于细胞移植后48 h,处死动物,取出肾脏、心脏、肝脏和胰腺,PBS 液灌注洗涤,取组织置于中性甲醛(10﹪)固定,常规石蜡包埋、切片,HE 染色,普通光镜检查;并取组织用滴有生理盐水的锡纸包裹于4℃保存下送检,制成冰冻切片进行荧光显微镜观察并摄片,观察移植细胞的存活情况。每组每只动物随机取 30 例免疫荧光照片,肾小球荧光强度为:(+)低倍镜下似乎可见,高倍镜下可见则为1分;(+ +)低倍镜下可见,高倍镜下清晰可见为2分。以此类推,计算每组平均积分为平均荧光强度
四、统计学处理
采用 SPSS11.0 软件进行统计学分析,免疫荧光强度以± s 表示,组间比较采用独立样本样本 t 检验。以 P < 0.05 为差异具有统计学意义。
结 果
本实验结果显示:(1)对照组肾脏无人脐带MSCs 存在,而模型 1 组及模型 2 组家犬肾脏中均有人脐带 MSCs 存在,免疫荧光强度与对照组相比有统计学意义(P < 0.05);(2)模型 1 组及模型 2组家犬肾脏中均有人脐带 MSCs 存在于肾小管细胞,而心脏、肺脏、胰腺不存在或少量存在人脐带 MSCs。
一、每组肾脏病理标本(图1 ~ 3)
经HE染色模型1组显示肾小管出现空泡变性和颗粒变性,模型2组显示肾小管出现空泡变性和颗粒变性,对照组显示正常肾脏组织。
二、每组肾脏免疫荧光标本(图4 ~ 6)
移植术后对照组肾脏几乎无荧光显影,模型1组和模型2组肾小管中均可见绿色荧光。
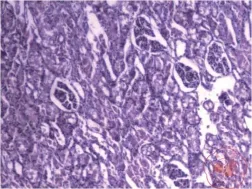
图1 模型 1 组 HE 染色(×200)
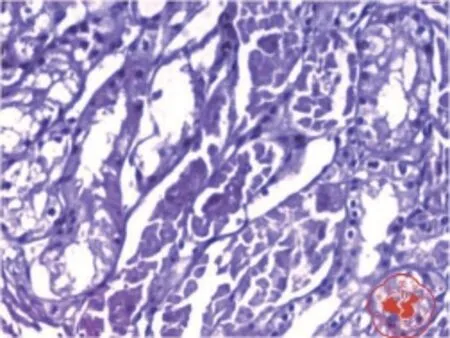
图2 模型 2 组 HE 染色(×200)
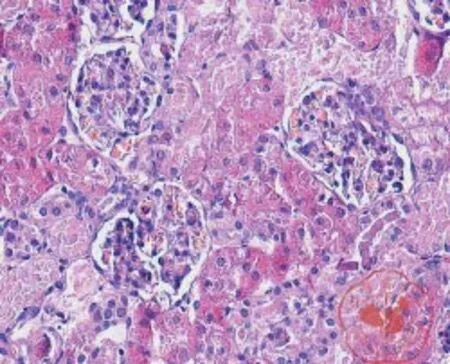
图3 对照组 HE 染色(×200)

图4 对照组移植后肾脏(×40)

图5 模型 1 组移植后肾脏(×40)
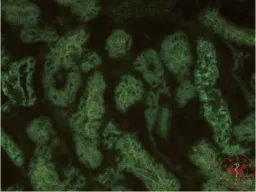
图6 模型 2 组移植后肾脏(×40)
三、模型 1 组及模型 2 组人脐带 MSCs 移植后心脏、肝脏和胰腺免疫荧光标本(图7 ~ 12)移植术后模型1组和模型2组显示心脏及胰腺几乎无荧光显影,肝脏无荧光显影。

图7 模型 1 组移植后心脏(×40)

图8 模型 2 组移植后心脏(×40)

图9 模型 1 组移植后肝脏(×40)

图10 模型 2 组移植后肝脏(×40)

图11 模型 1 组移植后胰腺(×40)

图12 模型 2 组移植后胰腺 (×40)
四、人脐带 MSCs 移植后肾脏免疫荧光强度的比较
人脐带血MSCs移植后肾脏免疫荧光强度测定结果见表1,模型组1、模型组2分别与对照组比较,差异有显著统计学意义(P < 0.05)。

表1 人脐带 MSCs 移植后肾脏免疫荧光强度的比较
讨 论
引起 ATN 肾毒性原因包括部分抗生素、化学毒物、重金属、造影剂和高浓度的内源性毒素。肾功能的恢复依赖于肾小管上皮细胞的再生[7-9]。传统的观念认为,肾小管损伤后,新生小管上皮来源于残存肾小管上皮细胞或肾间质来源的肌纤维母细胞[10]。一旦发生肾小管坏死就只能采用血液净化部分替代肾脏工作,维持机体内环境稳定,以等待肾小管上皮的自我修复,如能发现加速肾组织修复的药物或方法,无疑能缩短急性肾衰病程,早期恢复机体内环境稳定,减少因肾衰导致的并发症,从而减少病死率。
干细胞是一类具有自我更新能力和多向分化潜能的细胞,其处于未定向分化状态并具有增殖能力。在特定条件下,干细胞可以分化成不同类型的具有特征性形态、特异分子标志和特殊功能的成熟细胞。干细胞按来源可分为胚胎干细胞(embryonic stem cells, ESCs)[11]和成体干细胞(adult stem cells, ASCs)[12-13]。胚胎干细胞虽然具有分化的全能性,但由于存在伦理学、免疫排斥以及等问题限制了它在临床上的应用。成体干细胞是存在于人和哺乳动物组织中的具有多向分化潜能的一类细胞,目前许多成体组织(如骨髓、软骨、血液、神经、肌肉、脂肪、皮肤、肝脏和胰腺等)中均有发现。其中,骨髓 MSCs 是实验和临床研究中 MSCs 的主要来源,但骨髓存在有自身局限性。骨髓干细胞取材不易,供体有限,而且骨髓来源的 MSCs 细胞数量及增殖分化潜能随年龄的增大而下降,供体在抽取骨髓时病毒感染率较高[14]。
近年研究报道脐带中富含 MSCs,易于获得,分离成功率高,具有多向分化的能力,渐成为研究的热点。脐带 MSCs 与骨髓 MSCs 相比较有很多优势,如取材方便,来源广泛,易于收集、保存和冷冻,不受伦理、道德及法律方面的争论与限制[15-16];相对纯净,与干细胞输注相关的病毒和病原微生物感染率远低于骨髓移植[17];人脐带 MSCs 含量丰富,较为原始,分化能力强,可在体外进行分离、培养,扩增迅速,且生物性能稳定,多次传代扩增仍能保持旺盛功能[18],可以为实验和临床提供充足的细胞来源;人脐带 MSCs 不表达或低表达免疫排斥相关标记,这是骨髓与脐带MSCs 的共同特点,免疫原性低,是一类低免疫原性细胞,不须经过严格配对使用,异体及异种移植无免疫排斥反应或反应较弱,适宜于不同个体之间的移植。因此本实验选择脐带 MSCs 作为研究对象。
本实验将人脐带 MSCs 分别移植给健康家犬及急性肾小管坏死模型家犬,结果显示健康家犬肾脏无人脐带 MSCs 存在;对于急性肾小管坏死家犬,人脐带 MSCs 选择性存在于肾脏内,对心脏、肝脏及胰腺无影响。说明人脐带 MSCs 移植到受试动物体内后,有明显的趋化性,选择性存在于受损脏器内。已有研究表明,MSCs 在体内可定向分化成肾小管上皮细胞或MSCs 通过促进肾脏局部自分泌和旁分泌生长因子、抗炎因子和抑制炎性因子等,促进肾脏固有的祖细胞向肾小管上皮细胞分化,及存活的 MSCs 向肾小管上皮细胞分化等,以促进损伤肾小管上皮细胞的修复[19-21],而对正常脏器组织无影响。本实验可为临床人脐带 MSCs 在急性肾损伤治疗中的应用提供实验依据,其具体的治疗作用会继续进行研究,人脐带 MSCs 可能会因为其来源广泛、安全和有效等优点而成为一种新的肾脏疾病的替代疗法。
1 Lin F, Cordes K, Li L, et a1. Hematopoietic stem cells contribute to the regeneration of Tenal tubules after renal ischemia-reperfusion injury in mice[J]. J Am Soc Nephrol, 2003, 14(5):1188-1199.
2 张婷, 周云, 张亚, 等. 体外诱导骨髓间充质干细胞向肾小管上皮细胞的分化[J]. 中国组织工程研究与临床康复, 2007, 11(3):478-481.
3 肖丽佳, 李亚洁, 余月明, 等. 兔自体骨髓千细胞移植对缺血再灌注损伤肾功能的影响[J]. 南方医科大学学报, 2006, 26(5):561-563.
4 王共先, 汪泱, 张中华. 骨髓间充质干细胞移植对缺血再灌注损伤的保护作用[J]. 中华泌尿外科杂志, 2005, 26(8):535-538.
5 潘兴华, 张步振, 庞荣清. 干细胞——人类疾病治疗的新希望[M]. 云南:云南科技出版社, 2004:120.
6 钱家麒. 内科学[M]. 6版. 北京:人民卫生出版社, 2004:536-538.
7 Rosenthal N. Youthful prospects for human stem - cell therapy. Inanother few decades,revised attitudes toward stem cells could lead to disease prevention and life extension[J]. EMBO - Rep, 2005, 6:S30 - 34.
8 Poulson R, Allison MR, Cook, et a1. Bone marrow stem cells contribute to healing of the kindney[J].J Am Soc Nephrol, 2003, 14(1):S48-54.
9 Han WK, Bailly V, Abichandani R, et a1. Kidney Injury Molecule-1(KIM-l):a novel biomarker for human renal proximal tubule injury[J]. Kidney Int, 2002, 62(1):237-244.
10 Vercauteren SR, Ysebaert DK, Van Rompay AR, et a1.Acute ischemia/reperfusioninjury after isogeneic kidney transplantation is mitigated in a rat model of chronic renal failure[J]. Am J Transplant, 2003, 3(5):570-580.
11 Jiang W, Shi Y, Zhao D, et al. In vitro derivation of functional insulinproducing cells from human embryonic stem cells[J]. Cell Res, 2007, 17(4):333-344.
12 Chen LB, Jiang XB, Yang L. Differentiation of rat marrow mesenchymal stem cells into pancreatic islet betacells[J]. World Gastroenterol, 2004, 10(20):3016-3020.
13 Sun Y, Chen L, Hou XG, et al. Differentiation of bone marrow–derived mesenchymal stem cells from diabetic patients into insulin-producing cells in vitro[J]. Chin Med J, 2007, 120(9):771-776.
14 Rao MS,Mattson MP.Stem ceils and aging:expanding the possibilities[J]. Mech Ageing Dev, 2001,122(7):713-734.
15 侯克东, 卢世壁, 张莉, 等. 人脐带 Wharton 胶中间充质干细胞的分离、培养与鉴定[J]. 解放军医学杂志, 2008, 33(4):375-378.
16 张彦, 黄平平. 人脐带间充质干细胞的生物学特性及应用前景[J]. 国际移植与血液净化杂志, 2008, 5(4):39-42.
17 沈华. 脐带间充质干细胞的研究进展[J]. 中国美容医学, 2007, 16(8):1158-1160.
18 马廉, 崔冰琳, 冯学永, 等. 人脐带间充质干细胞的生物学特性及向神经样细胞分化的研究[J]. 中华儿科杂志, 2006, 44(7):513-517.
19 Kale S, Karihaloo A, Clark PR, et a1. Bone marrow stem cells contribute to repair of the ischemically injured renaltubule[J]. J Clin Invest, 2003, 112(1):42-49.
20 Morigi M, Jmberti B, Zoja C, et a1. Mesenchymal stem cells are renotropic,helping to repair the kidney and improve function in acute renal fallure[J]. J Am Soc Nephrol, 2004, 15(7):1794-1804.
21 Roufosse C, Cook HT. Stem cells and renal regeneration[J]. Nephron Exp Nephrol, 2008, 109(2):e39-e45.
Distribution of human umbilical cord mesenchymal stem cells in dogs with acute tubular necrosis
LI Fang*, HU Xiang, JIA Dan-bing, ZHAO Hong-mei, ZHOU Yan-ni, DANG Zhi-jie.*The 211 Hospital of PLA, Haerbin 150060, China
LI Fang, E-mail: weizhaohongmei@163.com
Objective To observe the distribution of human umbilical cord-derived mesenchymal stem cells in the dogs with acute tubular necrosis (ATN ).MethodsDog ATN model was established by intramuscularly injecting freshly prepared 0.2﹪ HgCl2, 7 mg/kg. Human umbilical cord derived mesenchymal stem cells were cultured and labeled with DAPI. In the experimental groups, cells were injected either through peripheral vein or left renal artery by transfemoral coronary intervention. Control group received mesenchymal stem cells only through the left renal artery by transfemoral coronary intervention. 48 hours later, all dogs were killed and the specimens from kidneys, hearts, livers, and pancreas were collected. The distribution of human umbilical cord mesenchymal stem cells in the body, especially in the kidney, was observed by lightmicroscope and fl uorescence microscope.ResultsThe human umbilical cord mesenchymal stem cells were found in the kidneys of experimental groups, but not in the hearts, livers and pancreases. In the control group, no human umbilical cord mesenchymal stem cells were found in any of these organs.ConclusionThe injected human umbilical cord mesenchymal stem cells could be attracted to the ATN dogs’ kidneys, which indicates that local cues are important for stem cell homing.
Umbilical;Mesenchymal stem cells transplantation;Chemo taxis;Acute tubular necrosis
2011-01-04)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2011.01.004
150086 哈尔滨,解放军第二一一医院(李芳、贾丹兵、赵红梅、周燕妮、党智杰);深圳市北科细胞工程研究所(胡祥)
李芳,E-mail:weizhaohongmei@163.com
李芳, 胡祥, 贾丹兵, 等. 人脐带间充质干细胞在急性肾小管坏死模型犬的体内分布及趋化性[J/CD]. 中华细胞与干细胞杂志: 电子版, 2011, 1(1): 31-38.
