荔枝肉水溶性多糖提取工艺优化
2011-10-28唐绪明
张 钟,唐绪明,张 玲
(广东石油化工学院化学与生命科学学院,广东 茂名 525000)
荔枝肉水溶性多糖提取工艺优化
张 钟,唐绪明,张 玲
(广东石油化工学院化学与生命科学学院,广东 茂名 525000)
目的:以荔枝肉为原料,采用水溶剂提取技术从荔枝肉中提取水溶性多糖。方法:在单因素试验基础上,通过响应面试验分析方法优化水溶剂提取荔枝肉水溶性多糖的最佳工艺参数,并对多糖含量进行测定。结果:水溶剂提取的最佳工艺参数为荔枝肉与水的比例1:17(g/mL)、提取温度90.5℃、提取时间4.0h。此时的响应值即提取率达到10.06%。提取所得的粗多糖,用苯酚-硫酸法对其含量进行测定,结果多糖平均含量为6.71%。结论:响应面法优化荔枝肉多糖提取工艺参数是可行的。
荔枝肉;水溶性多糖;提取;工艺参数优化
多糖是20多个单糖的聚合体,包括植物多糖、动物多糖和微生物多糖[1],目前,已从天然物质中分离出来300多种多糖。从19世纪60年代,研究者逐渐发现了多糖的生理活性[2],包括抗凝血[3-4]、抗感染[5]、抗肿瘤[6-7]。
关于荔枝多糖提取方法的报道较少,已报道的提取方法主要有传统的热水浸提法、微波提取以及超声波提取[8-10]。多糖是极性大分子化合物,大多采用不同温度的水,稀碱溶液提取。但是由于酸和碱易引起糖苷键的断裂而造成多糖的得率降低。故本实验采用热水浸提荔枝多糖,在浸提参数中温度、固液比和时间均影响多糖的浸提率,要根据需要选择最佳的工艺参数。同时对荔枝多糖的提取条件进行优化。
响应面分析法(response surface methodology,RSM)是由Box等[11]于20世纪50年代提出的一套统计方法。响应面分析法用于确定各因素及其交互作用在加工过程中对非独立变量的影响,精确地表述因素和响应值之间的关系,是一种优化反应条件和加工工艺参数的有效方法[12-13],已经广泛应用于化学化工、生物工程、食品工程等方面[14]。R S M中较有代表性的方法是响应面回归(response surface regression,RSR)优化程序,RSR的原理是用一个多元回归方程(回归函数)拟合多因子与试验结果(响应值)之间的关系,各因子与响应值之间的显著程度用方差分析验证从而确定该分析结果的可信度[15]。RSM软件结合Graph2等绘图软件还能够给出参数与响应值之间的平面图和立体图,直观地提供局部参数值和整体响应面值之间的对应关系,从而获得明确有用的结论[16]。
本实验选用热水作提取溶剂,在单因素试验的基础上用响应面试验分析法对荔枝多糖的热水浸提工艺条件进行优化,以最大限度提高荔枝多糖提取率,以期为后续研究提供参考,为荔枝多糖的开发利用提供借鉴。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料与试剂
荔枝干(黑叶) 自制。从茂名官渡市场购买新鲜黑叶荔枝,去掉枝叶和病、烂、裂果,用100℃热水烫30s,捞起沥干水后置60℃恒温干燥箱中干燥,贮存备用。
葡萄糖、8 0%苯酚、浓硫酸、无水乙醇、9 5%乙醇、氯仿、正丁醇、丙酮、乙醚(以上试剂均为分析纯)、活性炭、木瓜蛋白酶。
1.1.2 仪器与设备
SHZ-D苏泊尔搅拌机 浙江苏泊尔炊具股份有限公司;78HW-1恒温磁力搅拌器 杭州仪表电机厂;722型紫外-可见分光光度计 上海第三分析仪器厂;FA1140电子天平 上海天平仪器厂;EYELAN-1000旋转蒸发仪 日本东京理化器械;TDL-5离心机 上海安亭科学仪器厂。
1.2 方法
1.2.1 荔枝肉水溶性多糖的提取工艺流程
荔枝干→除去壳、核→60℃热水浸泡20min→搅拌机打浆→在热水浴中浸提→浸提液趁热过滤→滤液冷却→离心去渣(5000r/min,15min)→真空浓缩至原体积1/4→用无水乙醇调至溶液乙醇质量分数为80%→置冰箱12h→离心(5000r/min,10min)→沉淀依次用适量80%乙醇、95%乙醇洗涤两遍→恒温箱中干燥至质量恒定→荔枝粗多糖
1.2.2 水溶剂提取的条件
1.2.2.1 多糖的提取率计算

1.2.2.2 水溶剂浸提料液比的选择
准确称取经预处理的荔枝干肉5.0g,称取5组,每组3份,打浆,在70℃条件下,分别以料液比1:5、1:8、1:11、1:14、1:17、1:20(g/mL)浸提 3h。根据多糖的提取率确定水溶剂浸提最佳料液比。
1.2.2.3 水溶剂浸提时间的选择实验
准确称取经预处理的荔枝干肉5.0g,称取5组,每组3份,打浆,加热提取的料液比根据上一实验确定,分别浸提2、3、4、5、6 h,温度是7 0℃。根据多糖的提取率确定水溶剂浸提最佳浸提时间。
1.2.2.4 水溶剂加热浸提温度的选择实验
准确称取经预处理的荔枝干肉5.0g,称取5组,每组3份,打浆,加热提取的料液比和浸提时间根据上一实验确定,分别在温度是60、70、80、90、100℃进行浸提。根据多糖的提取率确定水溶剂浸提最佳温度。
1.2.2.5 响应面试验设计
综合单因素试验给出的信息,以提取温度,时间,料液比作为试验因素,运用SAS 6.1软件程序根据Box-Behnken中心组合实验设计原理,采用3因素3水平的响应面分析法(简称RSM),以荔枝粗多糖提取率为响应值作响应面和等高线图,对提取条件进行优化,试验因素与水平设计见表1。

表1 响应面设计因素与水平Table 1 Factors and levels in response surface analysis
1.3 多糖含量的测定方法
采用苯酚-硫酸法:苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸(或甲苯衍生物)起显色反应,己糖在波长490nm处(戊糖及糖醛酸在波长480nm)有最大吸收,吸收度与含量呈线性关系。
1.3.1 葡萄糖标准曲线的绘制
精密称取105℃干燥至质量恒定的葡萄糖标准品20mg,置于500mL容量瓶中,加蒸馏水稀释至刻度,配成0.04mg/mL的标准溶液。然后精密移取标准溶液0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL,置于具塞试管中,各以蒸馏水补充至2.0mL,然后加入6%重蒸酚1.0mL及浓硫酸5.0mL,静止10min,摇匀,室温放置20min后于波长490nm处测吸光度,以2.0mL水按同样显色操作作为空白,制备标准曲线,再以吸光度(A)对葡萄糖质量浓度(C)做回归处理,得回归方程:A=0.0632C+0.008(r=0.9959)。
1.3.2 样品中荔枝多糖的含量测定
1.3.2.1 样品溶液的制备
将荔枝干肉剪碎,精密称取1.9986g,用体积分数80%的酒精浸泡过夜,滤去废酒精,然后于索氏提取器中用质量分数为80%新酒精回流4h,残渣挥去溶剂后,加17倍的蒸馏水,于98℃浸提3.5h,浸提液趁热过滤,用蒸馏水反复洗滤渣至250mL容量瓶中,定容至刻度,摇匀备用。
1.3.2.2 样品中荔枝多糖含量的测定
精密吸取1.3.2.1节所得样品溶液0.4mL于具塞试管中,按1.3.1节的方法测定吸光度(A),由回归方程计算供试液中葡萄糖浓度(C),按下式计算样品中荔枝多糖含量。
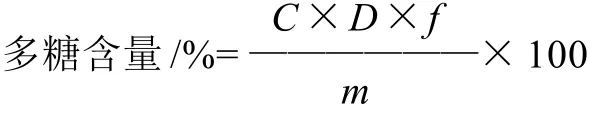
式中:C为供试液中葡萄糖质量浓度/(μg/mL);D为多糖的稀释因子;m为供试荔枝样品的质量/μg;f为换算因子(经实验测定黑叶荔枝多糖f值为2.252[9])。
多糖的稀释因子D的计算:荔枝干碎肉经提取后,用蒸馏水反复洗滤渣至250mL容量瓶中定容,然后取出0.4mL,接着以蒸馏水补充至2.0mL,然后加入6%重蒸酚1.0mL及浓硫酸5.0mL,所以D为5000。
2 结果与分析
2.1 水溶剂提取条件的确定
2.1.1 水溶剂浸提料液比
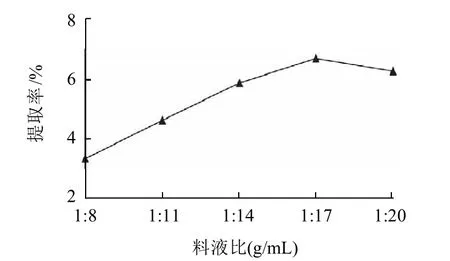
图1 料液比对粗多糖提取率的影响Fig.1 Effect of material-to-liquid ratio on extraction rate of polysaccharides
由图1可以看出,料液比小于1:17时,随着料液的增大,荔枝肉粗多糖的提取率也随着提高;但料液比超过1:17后,粗多糖提取率略有下降,可能是由于料液比增大,在减压浓缩时多糖容易降解,导致最终算出的提取率下降。因此,料液比选1:17为佳。
2.1.2 水溶剂浸提时间

图2 浸提时间对提取率的影响Fig.2 Effect of soaking time on extraction rate of polysaccharides
由图2可以看出,浸提时间小于4h时,随着浸提时间的增加,荔枝肉粗多糖的提取率也随之提高,但当浸提时间大于4h后,随着浸提时间的增加,粗多糖的提取率反而缓慢下降。在4h后随着浸提时间的延长,提取率总体呈下降趋势,部分原因可能是由于浸提时间过长,降低了某些反应的活化能,使多糖分子之间、多糖分子与其他分子之间形成新的作用力,增加分子之间碰撞机会,阻止多糖分子溶出;也可能是由于蛋白变性沉淀后包裹在果肉颗粒表面,导致多糖浸出率下降。因此,浸提时间以4 h为佳。
2.1.3 水溶剂浸提温度
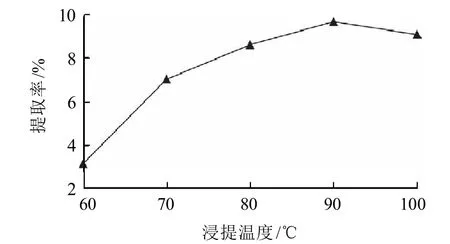
图3 不同浸提温度对提取率的影响Fig.3 Effect of temperature on extraction rate of polysaccharides
由图3可以看出,浸提温度小于90℃时,随着浸提温度的提高,荔枝肉粗多糖的提取率随之提高;但当浸提温度大于90℃后,随着浸提温度的提高,粗多糖的提取率略有所下降,因此浸提温度选90℃为宜。
2.2 水溶剂提取多糖响应面试验
RSM试验采用二次旋转设计得到15个组合试验点,测定每次试验中的结果获得相应的响应面值见表2。将表2响应面值输入计算机,经RSM回归拟合后,得到对X1、X2、X3的回归方程:
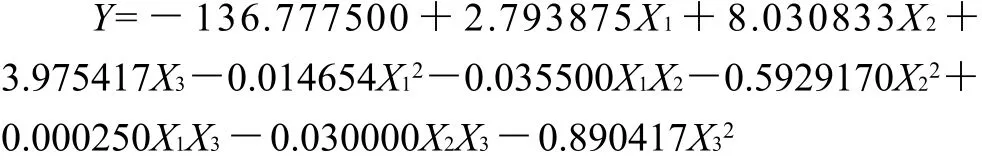

表2 响应面分析方案与结果Table 2 Experimental design and results of response surface analysis

表3 回归方程的方差分析Table 3 Variance analysis for the fitted regression model
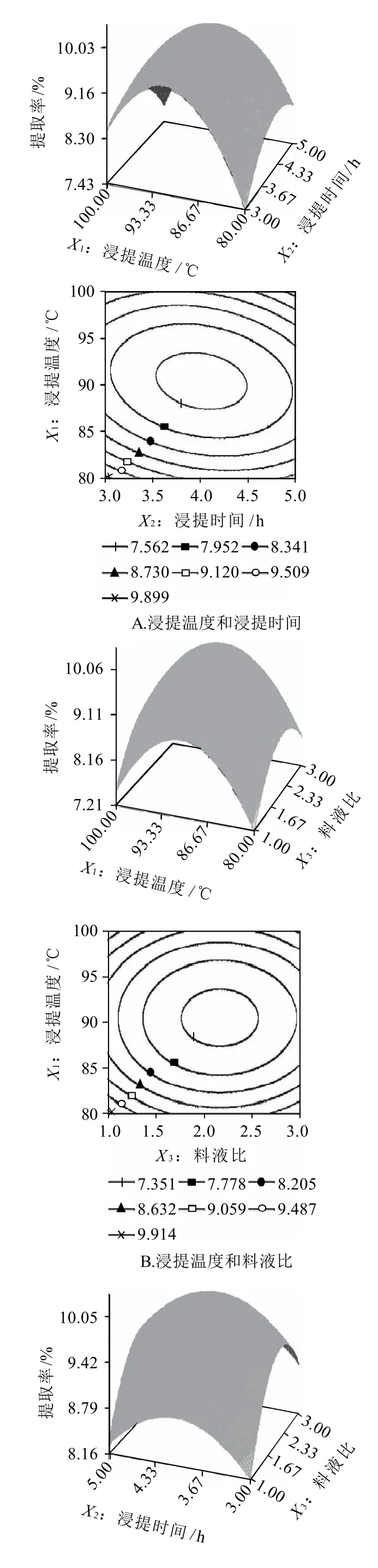

表4 回归系数取值及分析结果Table 4 Regression coefficients and their significance in the fitted regression model
用SAS软件对该多元回归方程进行方差分析,分析结果见表3、4。
从表3、4可看出,二次回归模型的F值为6.690,P<0.05,大于在0.05水平上的F值,而失拟项的F值为0.549,P>0.05,小于0.05水平的F值,该模型的R2=0.9233,说明该模型拟和结果好,自变量与响应值之间线性关系显著,可以用于该试验的理论预测。X1和X12交互作用在0.01水平上对多糖提取有极显著作用,X1和X12在0.05水平上对多糖提取率作用显著。
为了观察某两个因素同时对多糖提取率的影响,对表4的数据进行降维分析,观察在其他因素条件固定不变的情况下,某两因素对多糖提取率的影响,经SAS分析,所得的响应面及其等高线图见图4。
响应曲面图是响应值在各试验因子交互作用下得到的,构成一个三维空间曲面。从图4可以看出,3个因素的交互作用对响应值的影响情况,等高线图越陡峭表示因素的效应越大,能揭示出各因素对多糖提取率影响的显著性。同时,可以看出各交互因素的最佳作用点基本都落在试验范围之内,经SAS软件优化后的各因素最佳试验组合为浸提温度90.5℃、浸提时间4.0h、料液比1:17。三因素的显著程度为:提取温度>浸提时间>料液比。此时的响应值即提取率达到10.06%。

图4 各两因素交互作用对提取率的影响Fig.4 Response surface and contour of any two factors on extraction rate of polysaccharides
唐小俊等[8]用热水提取荔枝多糖,采用正交试验优化出的提取时间是4h,浸提温度是100℃,而本实验溶剂提取法中采用RSR试验优化出的提取时间为4h,浸提温度是90.5℃,比采用正交试验优化出的浸提温度也降低了。
2.3 荔枝多糖的计算
本实验测得黑叶荔枝肉中平均多糖含量为6.71%,RSD为0.47%,说明本测定误差小(表5)。
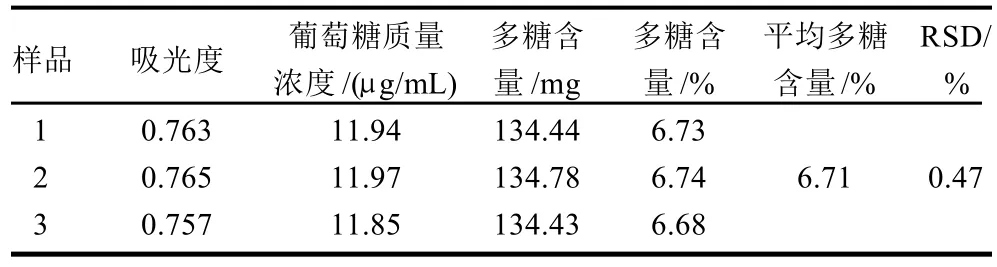
表5 荔枝(黒叶)多糖含量的计算结果Table 5 The content of polysaccharide in litchi flesh
3 结 论
采用水溶剂提取技术从荔枝肉中提取水溶性多糖,在水溶剂提取荔枝肉水溶性多糖的单因素试验基础上,再通过响应面试验分析方法优化了水溶剂提取荔枝肉水溶性多糖的最佳工艺参数。结果表明:水溶剂提取的最佳工艺参数为荔枝肉与水的比例1:17(g/mL)、提取温度90.5℃、提取时间4.0h。三因素的显著程度为提取温度>浸提时间>料液比。本实验用苯酚-硫酸法测定荔枝多糖,测得黑叶荔枝肉中多糖含量为6.71%,RSD为0.47%,说明本测定误差小,测定结果精确。
[1] ZHANG Fengling, SUN Dexian, LI Mingxiu. Preparation of Astraglus polysaccharide and its therapeutic effect on hepatitis[J]. Pharmaceutical Biotechnology, 1995(2): 26-28.
[2] TIAN Gengyuan, FENG Yucheng. Evolution of study on plant polysaccharide[J]. J Chin Tradit Med, 1995, 20(7): 441-445.
[3] SPRINGER G F, WURZEL H A, MCNEAL G M Jr. Isolation of anticoagulant fractions from crude fucoidan[J]. Proc Soc Exp Biol Med,1957, 94(2): 404-409.
[4] PEREIRA M S. Structure and anticoagulant activity of sulfated fucans:Composition between the regulant repetitive and linear fucans from echinoderms with the more heterogeneous and branched polymers from brown algae[J]. Biol Chem, 1994, 274(12): 7656- 7667.
[5] OSSELAER N V, RAMPART M, HERMAN A G. Different inhibition of polymorphonuclear leukocyte recruitment in vivo by dextran sulphate and fucoidan[J]. Mediators Inflam, 1996(5): 246-357.
[6] MANISH S P, SORGIO O, TOWSEND B. A revised structure of fucoidan may explain some of its biological activities[J]. J Biol Chem,1993, 268(13): 21770-21776.
[7] ZHUANG C, ITOH H, MIZUNO T. Antitumor active fucoidan from the brown seaweed, Umitoranoo (Sargassum thunbergii)[J]. Biosci Biotech Biochem, 1995, 59(4): 563-567.
[8] 唐小俊, 池建伟, 张名位, 等. 荔枝多糖的提取条件及含量测定[J].华南师范大学学报: 自然科学版, 2005(2): 27-31.
[9] 董周永, 池建伟, 杨公明, 等. 荔枝多糖微波提取工艺研究[J]. 食品工业科技, 2006(3): 118-121.
[10] 吴雅静, 张名位, 孙远明, 等. 荔枝多糖的超声波辅助提取工艺优化研究[J]. 华南师范大学学报: 自然科学版, 2007(2): 119-124.
[11] BOX G. Some new three lever designs for the study of quantitative variables[J]. Technometrics, 1996(2): 455-476.
[12] LI Quanhong, FU Caili. Application of response surface methodology for extraction optimization of gernfinant pumpkin seeds protein[J]. Food Chemistry, 2005(2): 701-706.
[13] ZHANG Jian, GAO Nianfa. Application of response surface methodology in medium optimization for pyruvic acid production of Torulopsis glabrata TP19 in batch fermentation[J]. Zhe jiang Univ Sci B, 2007, 8(2): 98-104.
[14] 杨晓泉, 李卞生, 曹劲松. 计算机在食品工程中的应用[M]. 广州: 华南理工大学出版社, 1998: 146-151.
[15] 赵思明. 食品科学与工程中的计算机应用[M]. 北京: 化学工业出版社, 2005: 38-46.
[16] DOUGLAS C. Montgomery design and analysis of experiments[M].New York: John Wiley Sons, 1998: 589-623.
Process Optimization for Extraction of Water-soluble Polysaccharides from Litchi Flesh
ZHANG Zhong,TANG Xu-ming,ZHANG Ling
(College of Chemistry and Life Science, Guangdong University of Petrochemical Technology, Maoming 525000, China)
Objective: To explore the optimal extraction parameters for water-soluble polysaccharides from litchi flesh. Methods:A series of single-factor investigations followed by response surface analysis were carried out to optimize conditions for the extraction of water-soluble polysaccharides from litchi fresh. Sulfuric acid-phenol method was used to quantify polysaccharides.Results: The optimal extraction parameters were litchi flesh-to-water ratio of 1:17 (g/mL), extraction temperature of 90.5 ℃, and extraction time of 4.0 h. Under these conditions, the extraction rate was up to 10.06%, and the crude extract obtained showed an average polysaccharide content of 6.71%. Conclusion: It is feasible to optimize extraction parameters of water-soluble polysaccharides from litchi flesh using response surface methodology.
litchi flesh;water-soluble polysaccharides;extraction;optimal parameters
TS255.36
A
1002-6630(2011)10-0070-05
2010-07-29
广东省高等学校人才引进项目(201192);茂名学院人才引进项目(2010r2)
张钟(1962—),男,教授,本科,研究方向为农产品贮藏与加工。E-mail:47108887@qq.com
