磁纳米分子印迹聚合物的制备及性能
2011-10-28刘微波彭池方胥传来
刘微波,陈 伟,彭池方,胥传来*
(江南大学食品学院,江苏 无锡 214122)
磁纳米分子印迹聚合物的制备及性能
刘微波,陈 伟,彭池方,胥传来*
(江南大学食品学院,江苏 无锡 214122)
以牛血清白蛋白为模板分子,四氧化三铁磁性纳米粒子为载体,多巴胺为功能单体制备磁纳米分子印迹聚合物。用制备的磁纳米分子印迹聚合物吸附蛋白,并测定对蛋白的吸附容量。结果表明:随着吸附时间的增加,吸附量增加,一段时间后可达到吸附饱和;在其他条件不变的情况下,模板浓度增加,吸附容量相应增加;印迹聚合物及其非印迹聚合物对牛血清白蛋白、人血红蛋白和牛血红蛋白的选择性吸附表明所制备的磁性分子印迹聚合物对牛血清白蛋白具有特异性吸附效果。
分子印迹;磁性纳米粒子;多巴胺
分子印迹技术(molecularly imprinting technique,MIT)是指制备对某一特定目标分子具有选择性的聚合物技术,又称分子烙印技术、分子印记技术或分子模板技术[1]。分子印迹技术作为一种分离技术,由于具有预定性、识别性、实用性三大特性,在生命科学的研究中发挥着越来越大的作用[2]。磁性纳米粒子(magnetic nanoparticles,MNPs)具有无毒无害、轻便迅速的分离特点,在蛋白质和细胞分离、酶固定化等领域越来越受到关注[3]。制备具有识别生物分子功能的磁纳米分子印迹聚合物,即合成Fe3O4磁性纳米粒子-分子印迹聚合物核壳结构的纳米粒子,可以有效地利用磁纳米粒子的磁性和分子印迹的特异识别性来进行目标分子的快速磁分离。在外加磁场下,含有磁性的核壳结构分子印迹纳米球,可对目标物实现快速磁分离[4-7]。磁纳米分子印迹纳米球复合体系在分子识别方面具有高灵敏、耐用、强记忆效应等特性,特别适合水溶液中生物分子的分离、富集,分子印迹磁性纳米复合体系在生化、医学领域具有潜在的应用前景[8-10]。
本研究先合成具有羧基表面的水溶性磁性纳米粒子,然后尝试在其表面制备分子印迹聚合物,通过不同的表征手段确定所合成的磁纳米分子印迹聚合物成功后,对其性质进行测定,以期建立新型的蛋白质分离纯化方法[11-12]。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白(BSA)、十二烷基硫酸钠 北京拜尔迪生物公司;盐酸多巴胺 美国Sigma公司;无水三氯化铁 上海晶纯试剂有限公司;无水乙酸钠、三羟甲基氨基甲烷 国药集团化学试剂有限公司;考马斯亮蓝G-250 中国医药集团上海化学试剂总公司;Milli-Q超纯水 美国Millipore公司。
1.2 仪器与设备
100mL水热合成反应釜 上海吉众仪器仪表有限公司;1810-B石英自动双重纯水蒸馏器 金坛市荣华仪器制造有限公司;ZD-9556脱色摇床 金坛市盛蓝仪器制造有限公司;Costar96孔8×12可拆酶标板 上海吉泰生物科技有限公司;TGL-40B台式低速离心机 上海安亭科学仪器厂;MPMSX-5T磁性能测量系统 美国Quantum Design公司;NICOLET NEXUS 470傅里叶变换红外光谱仪 美国Thermo Electron公司。
1.3 方法
1.3.1 磁性纳米粒子的制备
在水热合成反应釜内加入1.39g FeCl3、1.24g CH3COONa、14mL蒸馏水,缓慢滴加l0mL 1.0mol/L的NaOH溶液,不断搅拌,反应温度140℃,12h后冷却至室温,得到黑灰色沉淀。经过滤,热水和无水乙醇洗涤,在70℃真空干燥4h,用透射电镜表征,得到400nm准球型多面体Fe3O4纳米晶体,磁产率高于90%。
1.3.2 磁纳米分子印迹聚合物的制备与表征
取4个容量瓶,1、2为实验组,加入模板蛋白,3、4为对照组,不加入模板蛋白。在4个瓶中分别加入200μL Fe3O4磁性纳米粒子(平均粒径为400nm),并在1、2号均加入0.5mg牛血清白蛋白(BSA),4个瓶中都加入预先配制好的Tris缓冲液(pH8.0),摇床振荡2h后,各加入0.4mL盐酸多巴胺(10mg/mL,溶解于pH8.0的Tris缓冲液),继续振荡3h后,用磁铁吸出具有磁性的部分,去除上清液,用乙酸(含0.1g/100mL SDS)振荡洗涤5次,每次洗涤后分别用磁铁分离去上清液,再以去离子水彻底洗涤,1、2号瓶得到的磁性沉淀物即为磁纳米分子印迹聚合物。
将得到的磁纳米分子印迹聚合物进行红外扫描,制样方法为KBr压片法[13-15]。仪器分辨率4cm-1,扫描次数3 2次。
1.3.3 磁纳米分子印迹聚合物对牛血清白蛋白的吸附
将1.3.2节所得的磁纳米分子印迹聚合物各加入2mL 0.1mg/mL BSA(溶于 pH7.5、0.01g/100mL SDS Tris缓冲液)摇床振荡2h,磁分离,考马斯亮蓝G-250测定蛋白质含量。
1.3.4 蛋白含量的分析
采用考马斯亮蓝G-250法测定蛋白质含量[16-17]。考马斯亮蓝G250-蛋白质复合物呈色后,在595nm波长处吸光度与蛋白质含量呈线性关系,故可用于蛋白质浓度的测定。
取6支干净试管,按1、2、3、4、5、6编号并加入试剂。1号试管不加标准蛋白液,加1mL蒸馏水、5mL考马斯亮蓝染液;2号试管加入0.2mL标准蛋白液、0.8mL蒸馏水、5mL考马斯亮蓝染液;3号试管加入0.4mL标准蛋白液、0.6mL蒸馏水、5mL考马斯亮蓝染液;4号试管加入0.6mL标准蛋白液、0.4mL蒸馏水、5mL考马斯亮蓝染液;5号试管加入0.8mL标准蛋白液、0.2mL蒸馏水、5mL考马斯亮蓝染液;6号试管加入1mL标准蛋白液、5mL考马斯亮蓝染液,不加蒸馏水。混匀,室温静置2min,以第一管为空白,于波长595nm处比色,读取吸光度。根据标准溶液的吸光度,在坐标纸上绘制出浓度-吸光度曲线,得到的标准曲线方程为:y = 0.0069x + 0.0082(R2= 0.9941)。
样液测定时另取一干净试管,加入样品1.0mL及考马斯亮蓝染液5.0mL,混匀,室温静置3min,于波长595nm处比色,读取吸光度,由标准曲线方程算出未知液的蛋白质浓度。
2 结果与分析
2.1 磁性纳米粒子的表征

图1 磁性纳米粒子透射电镜图Fig.1 TEM image of MNPs
从图1可以清晰看出,磁性纳米粒子呈粒径均匀的球形,单分散性较好,平均粒径在400nm左右,粒子的表面没有包被物质,较光滑,因此可以在所合成的磁纳米粒子表面制备分子印迹。

图2 磁分离Fig.2 Magnetic separation process
从图2磁分离的过程可以看出,所合成的磁纳米粒子磁性很强,在强磁铁的磁场作用下,分散在水溶液中的磁纳米粒子液相与固相可以迅速分离,在10s左右即可以达到完全分离状态。图中B、C即为磁铁放置在装有磁纳米粒子的瓶子下面和侧面,都可以使磁粒子快速吸出。因此采用所合成的磁性纳米粒子作为载体制备分子印迹聚合物,可以有效地利用其在磁场作用下可快速磁分离这一特征。
2.2 磁纳米分子印迹聚合物的表征
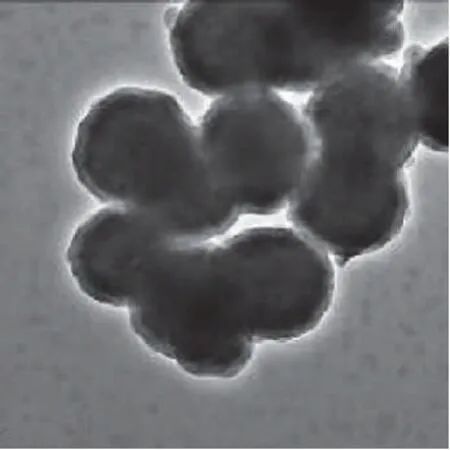
图3 磁性纳米分子印迹聚合物透射电镜图Fig.3 TEM image of molecular imprinted MNPs
从图3磁纳米分子印迹聚合物的透射电镜图可以看出,经过处理的磁纳米粒子外包裹了一层约20nm厚的物质,即为所制备的分子印迹,也就是实验中所需的为了吸附BSA的空间构架。可以看出,分子印迹的制备并没有影响磁纳米粒子本身的特征,与没有包裹的磁粒子相比,包裹一层分子印迹的磁纳米粒子表面颜色较浅,但粒子分布仍然较均匀,此外,由于磁纳米粒子本身粒径较大(400nm),包裹的分子印迹层较薄(20nm),因此对包裹后的磁粒子在磁场中的磁响应速度影响不大,仍然可以有效利用其在磁场中的磁响应性进行目标物的磁分离。
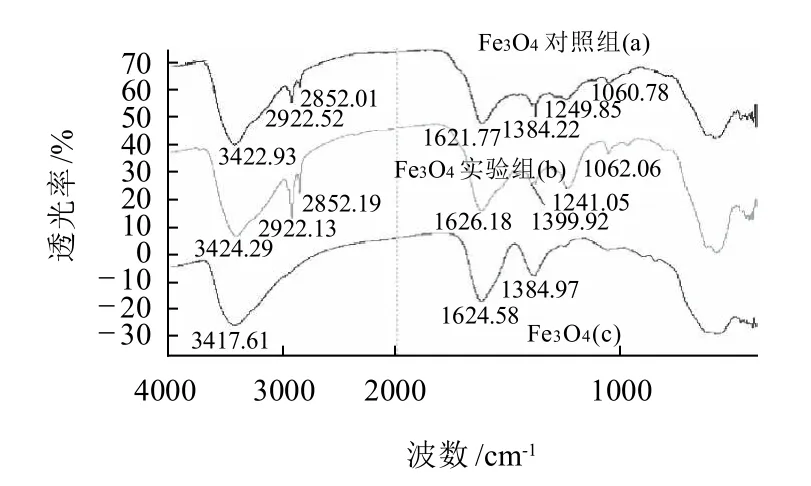
图4 磁纳米分子印迹聚合物的红外扫描图Fig.4 IR image of molecularly imprinted MNPs
由Fe3O4磁性纳米粒子的红外吸收图(图4)可以看出,磁纳米粒子表面有—COOH的存在:1624cm-1、1384cm-1处的吸收峰是C=O和—O—的伸缩振动峰,3417cm-1处的吸收峰是O—H的伸缩振动峰,580cm-1处附近是Fe—O的特征振动峰。这些特征峰说明磁纳米粒子的表面修饰上了羧基,为在其表面制备分子印迹聚合物提供了条件。曲线(b)为实验组,即为加入模板分子的磁纳米分子印迹聚合物,2922cm-1处是C—H伸缩振动,说明了—CH2—的存在;3360cm-1处,可见酚羟基的伸缩振动较弱的信号,为1241cm-1酚羟基的面内变形振动,说明了—OH的存在。曲线(a)为对照组,即为没有加入模板的分子印迹聚合物。从图4磁纳米粒子包裹分子印迹前后的吸收峰变化可以看出,在磁纳米粒子表面制备分子印迹聚合物是成功的。
2.3 模板分子含量对分子印迹粒子吸附性能的影响
各组加入200μL Fe3O4磁性纳米粒子(规格为400nm),各加入0、0.5、1、2、4mg模板BSA(分子牛血清白蛋白),按照1.3.2节所述反应,磁分离,洗涤和吸附后以考马斯亮蓝法测定剩余测定蛋白质量,计算吸附率。

图5 不同模板量对吸附率的影响Fig.5 Effect of template concentration on adsorption rate
由图5可知,在变动范围不大的情况下,随着模板分子质量的增加,选择性结合位点相应增多,吸附性也相应增强,吸附率增大。
吸附性取决于模板分子,功能单体以及交联剂之间的比例。印迹分子与功能单体的用量比对分子印迹过程中识别孔穴的产生具有很大影响,对其比例的适当选择应该依据印迹分子所含有的官能团和制备过程中所用溶剂的性质,一般而言增大功能单体的比例可以充分地预组装印迹分子,但功能单体所占的比例并非越大越好,因为功能单体过量太多可增加由未参与组装的功能单体所产生的非选择性结合位点,而且过大浓度的功能单体有可能引起自身的聚合而减少选择性结合位点数。功能单体和交联剂的比例对MIPs的性能也有很大的影响。
2.4 分子印迹粒子的吸附容量曲线
取5组,分别加入200μL Fe3O4磁性纳米粒子(400nm,10mg),加入4mg模板BSA参照1.3.2节制备分子印迹聚合物。配制质量浓度分别为10、50、100、150、200μg/mL BSA,分别取2mL,加入分子印记聚合物进行吸附反应2h,以考马斯亮蓝法测定上清液蛋白质质量,计算吸附容量。
由图6可以看出,随着牛血清白蛋白初始质量浓度的增大,印迹聚合物和非印迹聚合物的吸附容量也随之增大。在200μg/mL时,印迹聚合物吸附容量为7.8mg/g,而非印迹聚合物的吸附容量为5.4mg/g。在相同条件下印迹聚合物对模板分子的吸附容量明显高于非印迹聚合物对模板分子的吸附容量,说明印迹聚合物具有比较强的印迹效应,对牛血清白蛋白具有较好的选择性吸附,这是由于制备过程中使配体进行了有序排列,聚合物内部形成了形状与官能团位置均与牛血清白蛋白相配合的空腔,正是由于这些空腔的存在,使MIP对模板物质具有良好的选择性结合能力。
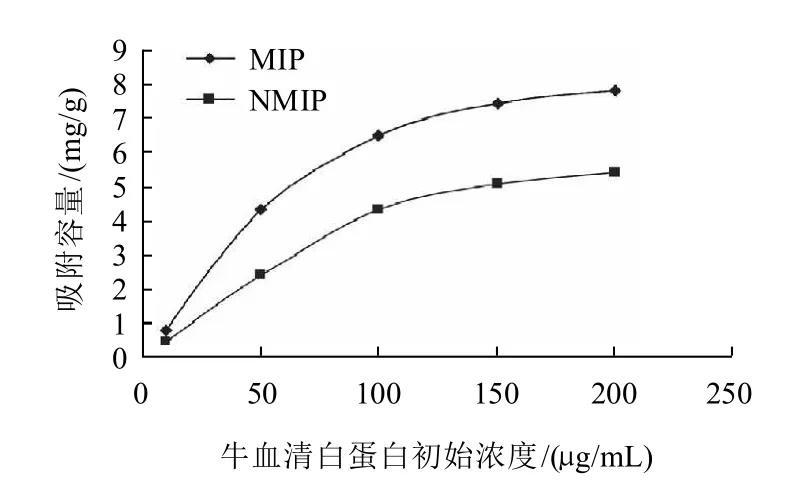
图6 分子印迹粒子的吸附容量曲线Fig.6 Adsorption capacity curve of molecularly imprinted MNPs
2.5 分子印迹粒子的的吸附动力学实验
200 μ L Fe3O4磁性纳米粒子(规格为400nm),加入4mg模板BSA(牛血清白蛋白)制备分子印迹聚合物,配制质量浓度为200μg/mL BSA,分别取2mL,加入分子印记聚合物进行吸附反应,在5、30、60、120min取液相,以考马斯亮蓝法剩余测定蛋白质量,计算吸附率。

图7 分子印迹聚合物吸附动力学实验Fig.7 Dynamic adsorption curve of molecular imprinted MNPs
图7表明,制备的印迹聚合物具有高的吸附速度,吸附5min达到吸附容量(初始质量浓度为0.1mg/mL)的22.3%,吸附30min之后吸附率为31.5%左右,60min之后吸附基本达到平衡。当降低初始溶液的质量浓度时,将在更短的时间内内达到吸附平衡。
2.6 分子印迹粒子的选择性分析
取3组200μL Fe3O4磁性纳米粒子(平均粒径为400nm),分别加入4mg人血红蛋白、牛血红蛋白、牛血清白蛋白,作为模板,参照1.3.2节制备分子印迹聚合物,其他条件相同在5、30、60、120min取液相,以考马斯亮蓝法剩余测定蛋白质量,计算吸附率。

图8 印迹和非印迹聚合物对人血红蛋白(1)、牛血红蛋白(2)、牛血清白蛋白(3)的选择性吸附Fig.8 Selective adsorption of molecularly printed and non-printed MNPs towards human hemoglobin, bovine hemoglobin and bovine serum albumin
图8表明,NMIP(非印迹聚合物)对3种底物的静态分离因子相差很小,因为在它的内部没有经过排列的选择性结合位点,主要依靠聚合物表面非选择性结合作用吸附底物分子,对底物无法进行有效的分离与识别。而印迹聚合物MIP对3种底物的分离因子相差相对较大,说明MIP对模板分子牛血清白蛋白有高度的选择性和识别能力,对其他两种底物的选择性和识别能力则较差。
3 结 论
以牛血清白蛋白为模板分子,四氧化三铁纳米粒子为载体,多巴胺为功能单体制备磁纳米分子印迹聚合物。吸附平衡曲线随着吸附时间的增加,吸附量增加,结果一段时间后即达到吸附饱和;在其他条件不变的情况下,模板浓度增加,吸附容量相应增加;印迹聚合物及其非印迹聚合物对牛血清白蛋白、人血红蛋白、牛血红蛋白的选择性吸附表明,聚合物对牛血清白蛋白具有显著吸附效果。
[1] 陈长宝, 周杰, 吴春辉. 分子印迹技术研究进展[J]. 化学研究与应用,2006, 18(8): 86-89.
[2] JOSHI V P, KARODE S K, KULKARNI M G, et a1. Novel separation strategies based on molecularly imprinted adsor-bents[J]. Chemical Engineering Science, 1998, 53(13): 2271-2284.
[3] 赖家平, 何锡文, 郭洪声, 等. 分子印迹技术的回顾、现状与展望[J]. 分析化学, 2001, 29(7): 836-844.
[4] 周文辉, 林黎明, 郭秀春, 等. 三聚氰胺分子印迹聚合物的制备及奶制品中三聚氰胺的分离[J]. 分析测试学报, 2009, 28(6): 687-691.
[5] COSIMINO M, ILARIO L, PIER G Z. Molecularly imprinted electrosynthesized polymers: new materials for biomimetic sensors[J].Analytical Chemistry, 1999, 71(7): 1366-1370.
[6] LELE B S, KULKARNI M G, MASHELKAR R A. Molecularly imprinted polymer mimics of chymotrypsin: 1. Cooperative effects and substrate specificity[J]. Reactive and Functional Polymers, 1999, 39(1):37-52.
[7] 张立永, 成国祥. 分子印迹聚合物微球的制备及应用研究进展[J]. 功能高分子学报, 2002, 15(2): 214-218.
[8] ZHANG Liyong, CHENG Guoxiang, FU Cong. Molecular selectivity of tyrosine-imprinted polymers prepared by seed swelling and suspension polymerization[J]. Polymer International, 2002, 51(8): 687-692.
[9] EKBERG B, MOSBACH K. Molecular imprinting: a technique for producing specific separation materials[J]. Trends in Biotechnology,1989, 7(4): 92-96.
[10] DICKERT F I, I IEBERZEIT P, TORTSCHANOFF M. Molecular imprints as artificial antibodies-a new generation of chemical sensors[J].Sensors and Actuators, B: Chemical, 2000, 65(1): 186-189.
[11] MEDINA-CASTILLO A L, MISTLBERGER G, FERNANDEZSANCHEZ J F, et al. Novel strategy to design magnetic, molecular imprinted polymers with well-controlled structure for the application in optical sensors[J]. Macromolecules, 2010, 43(1): 55-61.
[12] TAN C J, CHUA H G, KER K H, et al. Preparation of bovine serum albumin surface-imprinted submicrometer particles with magnetic susceptibility through core-shell miniemulsion polymerization[J]. Analytical Chemistry, 2008, 80(3): 683-692.
[13] YAN Hao, ZHANG Jiancheng, YOU Chenxia, et al. Surface modification of Fe3O4nanoparticles and their magnetic properties[J]. International Journal of Minerals, Metallurgy and Materials, 2009, 16(2): 226-229.
[14] HONG Ruoyu, LI Jianhua, LI Hongzhong, et al. Synthesis of Fe3O4nanoparticles without inert gas protection used as precursors of magnetic fluids[J]. Journal of Magnetism and Magnetic Materials, 2008, 320(9):1605-1614.
[15] WANG Zhifei, GUO Huishi, YU Yinglei, et al. Synthesis and characterization of a novel magnetic carrier with its composition of Fe3O4/carbon using hydrothermal reaction[J]. Journal of Magnetism and Magnetic Materials, 2006, 302(2): 397-404.
[16] 冯昕, 王吉中, 尧俊英, 等. 考马斯亮蓝法测定乳与乳制品中蛋白质含量[J]. 粮食与食品工业, 2010, 7(3): 57-59.
[17] 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工,2009, 23(3): 40-41.
Preparation and Properties of Molecularly Imprinted Polymer Based on Magnetic Nanoparticles
LIU Wei-bo,CHEN Wei,PENG Chi-fang,XU Chuan-lai*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
A molecular imprinted polymer was prepared using bovine serum albumin as the template molecule, iron oxide magnetic nanoparticles as the carriers and dopamine as the functional monomer. The prepared magnetic molecularly imprinted polymer nanoparticles (MNP-MIPs) were applied to adsorb protein and the protein adsorption capacity was measured. The results indicated that the adsorption capacity towards protein exhibited an increase up to the saturation level with prolonged adsorption time. Similarly, the adsorption capacity also revealed an increase trend as the template concentration rose and other conditions were kept unchanged. Moreover, bovine serum albumin could be specifically adsorbed by MNP-MIPs.
molecular imprinting;magnetic nanoparticle;dopamine
O635.2
A
1002-6630(2011)10-0061-05
2010-07-19
刘微波(1986—),女,硕士研究生,研究方向为残留物检测。E-mail:liuweibo@126.com
*通信作者:胥传来(1965—),男,教授,博士,研究方向为食品安全。E-mail:xcl@jiangnan.edu.cn
