毛囊干细胞在毛发生长发育中的作用
2011-10-26王媛魏红中国医科大学附属盛京医院辽宁沈阳
王媛 魏红 中国医科大学附属盛京医院, 辽宁沈阳
毛囊干细胞在毛发生长发育中的作用
王媛 魏红 中国医科大学附属盛京医院, 辽宁沈阳
毛发是由毛囊隆突区的毛囊干细胞分化而来的。在这个分化过程中,毛囊干细胞会受到一些信号的调节,进而影响毛发的生长发育或再生。本文大致介绍了影响毛囊干细胞的一些信号是如何影响了这个过程,从而导致了毛发数量的改变。
毛囊干细胞;毛发生长发育;Wnt;TERT;E-cadherin;TGF—β
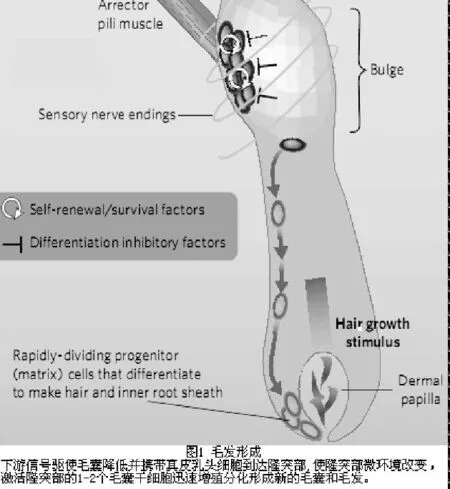
一、毛发形成
成熟毛囊由属于上皮部分的外根鞘(outer root sheath,ORS)与内根鞘(inner root sheath,IRS)和属于真皮部分的毛乳头(dermal papilla)与真皮鞘组成。在毛囊的隆突区(Bulge)有一个干细胞池,是角质形成细胞、黑素细胞和间质真皮细胞的干细胞库。毛发的再生和之后进入循环周期就是由此开始的。毛囊下段结构退化、破坏后,下游信号驱使毛囊降低并携带真皮乳头细胞到达隆突部,使隆突部的微环境改变,激活隆突部的1-2个毛囊干细胞迅速增殖分化形成新的毛囊和毛发[1]。(图1)
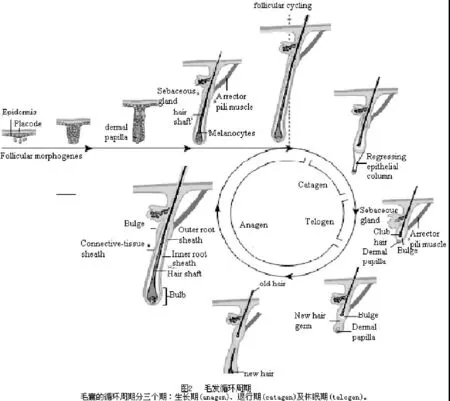
二、毛发循环周期(图2)
毛囊是人体少有的一生都具有退化和再生能力的器官。毛囊的循环周期分三个期:生长期(毛发生长初期anagen)、退行期(毛发生长中期catagen)及休眠期(毛发生长末期telogen)。基质细胞有时又被称为移行增殖(transit-amplifying)细胞,因为它们只存活于生长期。在对小鼠的研究中发现,出生后两周的小鼠,其最初供应的基质细胞已经有所减少,发轴和IRS的分化速度减慢,毛囊进入退行期[2]。在这段大约维持3~4天的时间里,毛囊因细胞凋亡而形成表皮strand。这使真皮乳头上移至上部永远没有周期循环的毛囊附近,进入休眠期。[1]
三、影响毛发生长发育的因素
(一)Wnt信号通路[1]
皮肤间质细胞与重叠的上皮细胞相互作用,可诱导毛发基板的生成。外胚层的Wnt信号在基板形成过程中起主导作用。Wnt信号与早期真皮信号联合,诱使表皮细胞向下移行形成新生毛发或基板。这些早期真皮信号包括成纤维细胞生长因子(fibroblast growth factors ,FGFs)[3][4],骨形态蛋白(bone morphogenetic proteins ,BMPs)抑制因子[5][6]等。当BMP过度表达或缺少BMP抑制物noggin或FGF10/FGF7受体FGFRⅢb时,毛囊密度有所下降[4][7][8]。隆突细胞对Wnt应答,证据是这些细胞表达TCF3、TCF4和一些Wnt受体蛋白(FZDs)。隆突部高水平的Wnt信号有助于毛囊干细胞发育成毛发结构,当抑制Wnt信号时毛囊干细胞就会向皮脂腺和表皮分化。

在毛发发育的过程中,角蛋白是最主要的结构蛋白,角蛋白家族在毛囊的不同细胞层中有不同的表达。在研究其原因的过程中研究者发现,发轴Ha/Hb角蛋白基因是真正的Wnt靶基因,而且Wnt信号在沿着发轴的基质细胞的分化中起着重要作用[9]。激活的β-连环蛋白(β-catenin)起着非常关键的毛囊发育起始诱导作用,可在人和老鼠身上导致pilomatricoma—毛发肿瘤[10][11]。而位于其下游的分泌型蛋白Sonichedgehog(Shh)在表皮一间质信号中起主要作用,调节毛囊表皮增生和进一步向间质生长及毛乳头形成。重要的发轴转录调节蛋白HOXC13和FOXN1发生突变时可导致毛发缺陷[12][13]。相反的,编码GATA-结合因子(Gata-3)和CCAATdisplacement蛋白(Cdp)发生突变会导致原发性内根鞘(IRS)缺陷,进而导致发轴的改变[14][15]。(图3)

(二)E-cadherin
毛囊发育过程中关键的一步是上皮干细胞的重排。通过两条信号传导通路Wnt和noggin的相互作用,从而减少一种介导细胞之间连接的粘连蛋白—E-cadherin的生成,在此过程中起了重要的作用[6]。(图4)毛囊干细胞要分化形成毛囊,首先要打破与相邻细胞和基质的连接,然后干细胞重排,形成胚芽。调节基因表达的转录因子,特别是Lef1转录复合物诱导了毛囊干细胞胚芽的形成[17-19]。过度表达Lef1的小鼠身上长出了多余的毛囊,即使本来少毛的组织也是如此;相反的,未表达Lef1的小鼠则出现毛发生成受损的情况。Wnt通路通过稳定Lef1激活蛋白—β-catenin来作用于Lef1[18],之后Lef1转录复合物下调E-cadherin在胚芽的表达[20]。毛囊发育需要许多蛋白家族的协同作用,包括FGF,BMP,Shh和Notch家族以及一些转录因子[17]。然而,当编码BMP抑制物的noggin基因被敲除时,毛发的生长发育严重受损。[21]
(三)有条件的端粒酶诱导毛囊干细胞增殖[22]
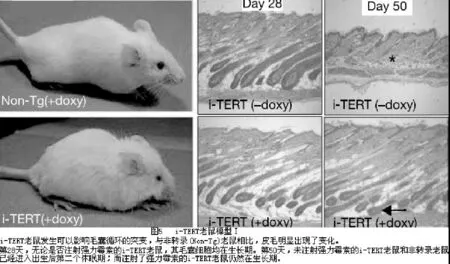
TERT,端粒酶中维持端粒功能的蛋白质[23][24],在90%的人类癌症中有再激活现象;它也可以表达于正常组织中的干细胞和祖细胞(基质细胞)[25]。研究发现,在小鼠皮肤上皮有条件的转化的TERT可使毛发从毛发生长后期(休眠期)迅速进入毛发生长初期,因而促进针毛的生长。TERT的过度表达通过引起毛囊隆突区干细胞增殖从而促进了毛发的生长。TERT的这一功能不需要端粒酶RNA的参与,因此是通过一种不依赖合成端粒重复序列活性的机制。TERT通过一种非常规的通路促进休眠干细胞的增殖。
为了测定TERT是否可以调节成人组织中干细胞和祖细胞的功能,KavitaY.Sarin等人以小鼠为实验对象用四环素调节的方法[26]建立了一个有条件的TERT转录的模型。这种老鼠被称为被诱导的TERT(i-TERT)老鼠。为了诱导TERT的表达,i-TERT老鼠被注射含有四环素类似物多西环素(doxycycline)的饮用水。经过几周的多西环素注射,i-TERT老鼠发生可以影响毛囊循环的突变,皮毛明显出现了变化。为了进一步测定在毛囊循环中发生的异常是否影响毛发表型的改变,研究者在实验开始21天后分析了皮肤切片。第28天,无论是否注射多西环素的i-TERT老鼠,其毛囊细胞均在生长期。第50天,未注射多西环素的i-TERT老鼠和非转录老鼠已经进入出生后第二个休眠期;而注射了多西环素的i-TERT老鼠仍然在生长期。这个结果具有多西环素依赖性,且发生率100%。实验结果证明有条件诱导的TERT可以促进毛囊进入生长期(图5)。
为了测定TERT的表达是否足够诱导毛囊从休眠期进入生长期,然后使毛发生长,研究者又作了进一步的实验。i-TERT老鼠在第45天注射含多西环素的饮用水,在第55天拔毛。拔毛后14天,注射有多西环素的i-TERT老鼠有明显的毛发生长现象,而未注射多西环素的i-TERT老鼠和非转录老鼠此时均没有长出毛发。实验结果证明,诱导的TERT有足够能力促使休眠期的毛囊进入生长期,促进新生毛发生长。(图6)

(四)转化生长因子(TGF)—β超家族
转化生长因子(TGF)—β超家族对调控毛囊的形态学发生和周期性循环起着非常重要的作用。
1、形态学发生
在表皮中过度表达TGF-β1的转基因小鼠,出生时毛囊数量减少约70%,提示TGF-β1抑制毛囊的形态学发生[27]。Foitzik K[28]等人通过对敲除了TGF-β基因的小鼠模型的研究发现,TGF-β1敲除的小鼠毛囊形态学发生明显延迟,毛囊数量减少50% ,TGF-β2敲除的小鼠毛囊轻微增加。在胚胎小鼠皮肤体外培养时,加入TGF-β2可以诱导毛囊的形态学发生, 而TGF-β1则抑制毛囊的形态学发生。研究提示,TGF-β2对毛囊的形态学发生有促进作用,而TGF-β1对毛囊的形态学发生有双向作用。
2、周期性循环
TGF-β1敲除的小鼠生长期向退行期的转变明显延迟[29],给小鼠背部皮肤局部注射TGF-β1,毛囊提前进入退行期,因此TGF-β1通过抑制细胞增殖和促进细胞凋亡而诱导小鼠毛囊由生长期向退行期转变。雄激素能够上调共培养的毛乳头细胞合成与分泌TGF-β1,而且TGF-β1的中和性抗体能够对抗雄激素对共培养的角质形成细胞的生长抑制作用。所以,在雄激素脱发中,雄激素通过诱导毛乳头细胞表达TGF-β1而抑制了毛囊角质形成细胞的增殖。即TGF-β1可能参与了雄激素性脱发的发生。[30]
TGF-β2可以抑制体外培养的人头皮毛囊毛干的延长,诱导毛囊发生退行期样的形态学改变[31][32],它可能通过活化半胱天冬酶(caspase)网络而诱导毛囊上皮细胞发生凋亡[33]。
由于TGF-β1和TGF-β2能够诱导毛囊由生长期向退行期转变,因此如果局部应用TGF-β1、TGF-β2或TGF-β受体拮抗剂将有望治疗雄激素性脱发等与退行期提前发生有关的毛发疾病。相反,应用其激动剂则可以治疗多毛症等一些与生长期延长有关的毛发疾病。[35]
(五)影响毛发循环周期的其他物质
有一些分子调节物质参与了毛发的周期调控。最近被发现的物质是K17[35]。K17与一个依赖肿瘤坏死因子受体1(TNFR1)信号的死亡配体(death adaptor)蛋白结合,诱导细胞凋亡进入退化期。在对相关基因的研究中发现一个包含了维生素D-类维生素A的X受体-α转录因子(vitamin D-retinoid X receptor- transcription factor)和共同作用的抑制蛋白hairless的转录复合物。当这个复合物有缺陷时,就会减弱毛发生长中期在上皮strand中的相关缺陷,隔开真皮乳头,阻碍新的毛发生长[36]。
环孢素A(cyclosporin A)是另一种刺激毛发生长的物质,他可以促进毛发生长初期,抑制毛发生长中期[2][36][37]。鉴于βcatenin的稳定同样具有促进毛发生长初期,因此推断cyclosporin A的作用方式可能是使β-catenin稳定,而Wnt受体的活性主要反映了β-catenin/LEF/TCF调节基因的活化。[1]
参考资料
[1]Elaine Fuchs. Scratching the surface of skin development. NATURE. 2007; 445: 834-842.
[2]Schmidt-Ullrich, R. & Paus, R. Molecular principles of hair follicle induction and morphogenesis.Bio Essays. 2005; 27: 247-261.
[3]Davidson, D. The mechanism of feather pattern development in the chick. II. Control of the sequence of pattern formation. J. Embryol. Exp. Morphol.1983; 74: 261-273.
[4]Petiot, A. et al. A crucial role for Fgfr2-IIIb signalling in epidermal development and hair follicle patterning. Development. 2003; 130: 5493-5501.
[5]Jung, H. S. et al. Local inhibitory action of BMPs and their relationships with activators in feather formation: implications for periodic patterning. Dev Biol. 1998; 196: 11-23.
通过以上文献分析,笔者认为,在兰克韦尔德(Lankveld,2016)等人得出的教师个体的增值感、与其他教师的关联感、自我胜任感、对教育的承诺感和对未来职业道路的想象这五个教师专业身份发展过程中,教师个体的增值感、胜任感和与其他教师的关联感,可归于教师自我效能与教师工作满意度的范畴,而教师的承诺感和对未来职业道路的想象,可归于教师教学动机和教师职业承诺的范畴,因而,本文认为,教师的教学动机、自我效能、工作满意度和职业承诺是教师专业身份发展的重要环节,也是判定教师专业身份形成的指标,四者之间相互关联相互影响。
[6]Noramly, S. & Morgan, B. A. BMPs mediate lateral inhibition at successive stages in feather tract development. Development. 1998; 125: 3775-3787.
[7]Botchkarev, V. A. et al. Noggin is a mesenchymally derived stimulator of hair-follicle induction. Nature Cell Biol. 1999; 1: 158-164.
[8]Mou, C. et al. Generation of the primary hair follicle pattern. Proc. Natl Acad. Sci. USA. 2006;103: 9075-9080.
[9]Merrill,B.J. et al. Tcf3 and Lef1 regulate lineage differentiation of multipotent stem cells in skin. Genes Dev. 2001; 15.
[10]Gat, U. et al. De novo hair follicle morphogenesis and hair tumors in mice expressing a truncated -catenin in skin. Cell. 1998; 95; 605-614.
[11]Chan, E. F. et al. A common human skin tumour is caused by activating mutations in -catenin. Nature Genet. 1999; 21: 410-413.
[12]Godwin, A. R. & Capecchi, M. R. Hoxc13 mutant mice lack external hair. Genes Dev. 1998;12: 11-20.
[14] Ellis, T. et al. The transcriptional repressor CDP(Cutl1) is essential for epithelial cell differentiation of the lung and the hair follicle. Genes Dev. 2001; 15:2307-2319.
[15] Kaufman, C. K. et al. GATA-3: an unexpected regulator of cell lineage determination in skin. Genes Dev. 2003; 17: 2108-2122.
[16]Yann Barrandon. A hairy situation. NATURE.2003; 422: 272-273.
[17]Fuchs, E. & Raghavan, S. Nature Rev.Genet. 2002; 3: 199-209.
[18]Eastman, Q. & Grosschedl, R. Curr. Opin. Cell Biol. 1999; 11: 233-240.
[19]Huelsken, J. et al. Cell. 2001; 105: 533-545.
[20]Jamora, C. et al. Nature. 2003; 422: 317-322.
[21]Botchkarev, V. A. et al. Nature Cell Biol.1999; 1: 158-164.
[22]KavitaY.Sarin, et al. Conditional telomerase induction causes proliferation of hair follicle stem cells.NATURE. 2005; 436: 1048-1052.
[23]Blackburn,E.H. Switching and signalling at the telomere. Cell. 2001; 106: 661-673.
[24]Smogorzewska,A. & DeLange,T. Regulation of telomerase by telomeric proteins. Annu.Rev.Biochem.2004; 73: 177-208.
[25]Morrison,S.J. et al. Telomerase activity in hematopoietic cells is associated with self-renewal potential. Immunity. 1996; 5: 207-216.
[26]Gossen,M. & Bujard,H. Tight control of gene expression in mammalian cells by tetracyclineresponsive promoters. Proc.Natl Acad.Sci.USA. 1992;89: 5547-5551.
[27]Sellheyer,K. et al. Inhibition of skin development by overexpression of transforming growth factor eta 1 in the epidermis of transgenic mice[J]. Proc Natl Acad Sci USA. 1993; 90 (11): 5237-5241.
[28]Foitzik K et al. The TGF--β2 isoform is both a required and sufficient inducer of murine hair follicle morphogenesis. Dev Biol. 1999; 212(2).
[29]Foitzik,K. et al. Control of murine hair follicle
regression (catagen) by TGF-beta1 in vivo[J].FASEB J. 2000; 14(5): 752-760.
[30]Inui, S. et al. Androgen-inducible TGF-β1 from balding dermal papilla cells inhibits epithelial cell growth: a clue to understand paradoxical effects of androgen on human hair growth. FASEB J. 2002;16(14): 1967-1969.
[31]Soma,T. et al. Involvement of transforming growth factor-beta2 in catagen induction during the human hair cycle [J]. J Invest Dermatol. 2002;118(6): 993-997.
[32]Soma,T. et al. Analysis of apoptotic cell death in human hair follicles in vivo and in vitro [J]. J Invest Dermatol. 1998; 111(6): 948-954.
[33]Tsuji,Y. et al. Apotential suppressor of TGF-beta delays catagen progression in hair follicles [J]. J Investig Dermatol Symp Proc. 2003; 8(1): 65-68.
[34]周乃慧,范卫新. 转化生长因子-β在毛囊生物学中的研究进展. 临床皮肤科杂志 2008; 37(1): 63-65.
[35] Tong, X. &Coulombe, P. A. Keratin 17 modulates hair follicle cycling in a TNF-dependent fashion. Genes Dev. 2006; 20.
[36] Potter, G. B. et al. The hairless gene mutated in congenital hair loss disorders encodes a novel nuclear receptor corepressor. Genes Dev. 2001; 15:2687-2701.
[37] Langbein, L. & Schweizer, J. Keratins of the human hair follicle. Int. Rev. Cytol. 2005; 243:1-78.
10.3969/j.issn.1001-8972.2011.07.130
