豌豆皮膳食纤维吸附性质和抗氧化性质的研究
2011-10-24邵娟娟马晓军
邵娟娟,马晓军
(江南大学食品学院,江苏无锡 214122)
豌豆皮膳食纤维吸附性质和抗氧化性质的研究
邵娟娟,马晓军*
(江南大学食品学院,江苏无锡 214122)
比较了三种通过不同方法制备的豌豆皮膳食纤维PIDF(豌豆皮不溶性膳食纤维)、PSDF1(木聚糖酶制得的豌豆皮水溶性膳食纤维)、PSDF2(纤维素酶制得的豌豆皮水溶性膳食纤维)的吸附性质和抗氧化能力,豌豆皮水溶性膳食纤维对脂肪、胆酸钠、胆固醇的吸附能力明显高于豌豆皮水不溶性膳食纤维,而PSDF1对脂肪和胆固醇的吸附能力高于PSDF2的吸附能力;在抗氧化能力方面,豌豆皮水溶性膳食纤维抗氧化能力也明显高于豌豆皮不溶性膳食纤维,而且PSDF2清除DPPH·、·OH自由基能力高于PSDF1,但是PSDF1的还原能力、螯合铁离子能力高于PSDF2。
豌豆皮膳食纤维,吸附性质,抗氧化
膳食纤维(dietary fiber,DF)是植物的可食部分或类似的碳水化合物,在人类的小肠中难以消化吸收,在大肠中会全部发酵分解[1],按溶解性可分为水溶性膳食纤维(SDF)和水不溶性膳食纤维(IDF)两大类[2]。大量研究表明,膳食纤维虽不具有营养价值,但与人体的营养和疾病有着密切关系,据文献记载[3],膳食纤维具有降低血液中胆固醇含量、预防心脏疾病、控制血糖、预防糖尿病、促进肠胃蠕动、预防便秘、清除人体内有害物的作用。叶静[4]等对江蓠藻膳食纤维吸附脂肪、胆固醇和胆酸钠的作用进行了研究,陶颜娟[5]对麦麸膳食纤维的抗氧化性质进行了研究。豌豆是我国重要的食用豆之一,工业上一般用来作为生产粉丝的原料,豌豆皮加工的副产物大多粉碎后作为动物饲料,附加值低。因此,将豌豆皮加工制作成豌豆皮膳食纤维可以提高豌豆的综合利用价值。目前还没有关于豌豆皮膳食纤维的文献报道,因此本文拟比较通过不同方法得到的豌豆皮膳食纤维的吸附性质和抗氧化性质,以期为其在食品工业生产中的应用奠定良好的理论基础。
1 材料与方法
1.1 材料与仪器
豌豆皮 烟台东方蛋白有限公司提供;新鲜鸡蛋、大豆油 市售;猪油 自制;胆固醇、胆酸钠、邻苯二甲醛、无水乙醇、冰醋酸、硫酸、糠醛、DPPH、铁氰化钾、抗坏血酸、EDTA 国药集团化学试剂有限公司。
WFZ UV-2100型紫外可见分光光度计 尤尼科(上海)仪器有限公司;TDL-5低速大容量离心机
上海安亭科学仪器厂;AB204-N型分析天平 梅特勒-托利多仪器有限公司;HWS24型电热数显恒温水浴锅 上海一恒科技有限公司;旋涡混合器常州市国立实验设备研究所;DELTA320型pH计上海分析仪器厂。
1.2 实验方法
1.2.1 豌豆皮水不溶性膳食纤维和水溶性膳食纤维的制备 豌豆皮水不溶性膳食纤维的制备工艺:豌豆皮预处理去除泥沙、杂质等→以料液比1∶20的比例加入pH10的缓冲溶液→加入碱性蛋白酶(250U/g豌豆皮)→60℃水浴酶解30min→升温至100℃→加入高温淀粉酶(100U/g豌豆皮)→沸水浴20min→冷却、离心弃去上清液→干燥,粉碎过60目筛即得豌豆皮水不溶性膳食纤维(PIDF)
豌豆皮水溶性膳食纤维的制备工艺:上述制得的PIDF→以1∶15的料液比加入0.05mol/L pH5的柠檬酸缓冲溶液→以100U/g PIDF的比例加入木聚糖酶(纤维素酶)→60℃水浴酶解4h→离心,保留上清液→旋转蒸发→浓缩后样品以1∶4的比例加入95%乙醇(V/V),沉淀12h,弃去上清液→冷冻干燥,粉碎即得PSDF1(PSDF2)
1.2.2 膳食纤维吸附能力的测定
1.2.2.1 膳食纤维对脂肪吸附能力的测定[6]膳食纤维对不饱和脂肪吸附作用的测定:称取3.0g膳食纤维于50m L离心管中,加入食用大豆油25g,搅匀,37℃静止1h,离心(4000 r/min,20m in),去上层油,滤纸吸干游离的大豆油,称重,吸油量按式(1)计算:
吸油量=(吸油后膳食纤维的质量-膳食纤维的质量)/膳食纤维的质量 式(1)
膳食纤维对饱和脂肪吸附作用的测定:称取3.0g膳食纤维与50m L离心管中,加入猪油25g,搅匀,37℃静止 1h,离心(4000r/min,20m in),去上层油,滤纸吸干游离的大豆油,称重,吸油量按式(2)计算:
吸油量=(吸油后膳食纤维质量-膳食纤维质量)/膳食纤维质量 式(2)1.2.2.2 膳食纤维对胆酸钠吸附能力的测定[7]在250m L锥形瓶中加入含0.2g胆酸钠的0.15mol/L NaCl溶液100m L,调节体系pH至2(模拟胃环境)和7(模拟小肠环境),分别加入膳食纤维0.5g,搅拌均匀,37℃ 振荡后,离心(4000 r/m in,20min),准确取1m L上清液测定残留胆酸钠含量,根据反应前后的浓度差计算吸附量,同时做空白实验。胆酸钠的测定方法采用糠醛比色法测定。膳食纤维对胆酸钠的吸附量按式(3)计算:
吸附量=(初始加入胆酸钠的质量-残余胆酸钠的质量)/膳食纤维的质量 式(3)1.2.2.3 膳食纤维对胆固醇吸附能力的测定[8]取鲜鸡蛋蛋黄,用9倍量蒸馏水充分搅打成乳液。称取1.0g膳食纤维于250m L的三角瓶中,加入50g稀释蛋黄液,搅拌均匀,调节体系pH至2(模拟胃环境)和 7(模拟小肠环境),37℃ 振荡 2h,离心(4000 r/m in,20m in),准确吸取0.04m L上清液测定残留胆固醇含量,根据反应前后的浓度差计算吸附量,同时做空白实验。胆固醇的测定方法采用邻苯二甲醛法测定。膳食纤维对胆固醇的吸附量按式(4)计算:

1.2.3 膳食纤维的抗氧化能力
表2结果表明,非生育期覆膜能够大幅度提高向日葵各生育阶段的保苗率。上年秋覆膜出苗期、现蕾期、花期和灌浆期分别较常规播前覆膜保苗率提高8,14,13,18百分点;早春覆膜出苗期、现蕾期、花期和灌浆期分别较常规播前覆膜保苗率提高4,9,11,16 百分点。
1.2.3.1 清除DPPH·能力 按照Shimada等[9]的方法并略做改进。准确称取DPPH标准品2.56mg,用无水甲醇定容到100m L容量瓶中,使最终浓度为6.5×10-5mol/L。取2m L待测液依次与2m L DPPH溶液避光反应40m in后,以2m L双蒸水加2m L无水乙醇的混合物为空白,在517nm处读取其吸光度,以2m L双蒸水+2m L DPPH溶液混合物的吸光度为对照,样品管相比对照管吸光值下降的百分比反映其对DPPH·清除能力,结果表示为清除μmol/g样品。1.2.3.2 清除·OH能力 采用2-脱氧核糖的方法[10]。在磨口具塞试管中依次加入20mmol/L pH7.4的KH2PO4缓冲液0.4m L,待测液0.1m L,1.04mmol/L的 EDTA 0.1m L,1mmol/L 的 FeCl30.1m L,10mmol/L H2O20.1m L,60mmol/L的脱氧核糖0.1m L(空白不加,加等量双蒸水),2mmol/L的 VC0.1m L。混匀后置37℃恒温水浴反应1h,取出迅速加入 1m L 20%TCA,1m L 1%TBA溶液混匀,沸水浴10m in后取出,用流水迅速冷却,在532nm比色,读取吸光值。样品管相比对照管吸光值下降的百分比反映其对·OH清除能力,结果表示为清除μmol/g样品。
1.2.3.3 还原能力 采用 Oyaizu[11]的方法,略做改动。取0.4m L的待测液(空白加等体积双蒸水),加入2.5m L 0.2mol/L pH6.6的磷酸缓冲液溶解,2.5m L 1%铁氰化钾,置于50℃水浴中反应20min,加入2.5m L 10%TCA,,混合后以2000 r/min离心10min。取上清液2.5m L,加入2.5m L蒸馏水和0.5m L 0.1%氯化铁,混合均匀,静置10m in后,测定其在700nm的吸光值。以VC作为参照物,制作标准曲线。将待测物质的还原能力与VC的还原能力相对比,确定相对还原能力,单位为 VERC(VCEquivalent Reducing Capacity,VC当量),即1g待测物质相当于 VC的还原力。
1.2.3.4 螯合铁离子的能力 采用Carter[12]的方法,取5m L待测液,加入0.1m L 2mmol/L的FeSO4溶液,再加入0.2m L 5mmol/L菲洛嗪溶液(空白加等体积双蒸水),混合液在漩涡振荡器上振动30s,于室温条件下静置10m in,在562nm测定吸光值,对照组用双蒸水代替样品,样品管相比对照管吸光值下降的百分比反映其对 Fe2+的螯合能力。用不同浓度的EDTA做标准曲线,样品对Fe2+的螯合能力与EDTA相对比,结果表示为μmolEDTA/g样品。
1.3 数据统计
所有测定重复三次,采用Excel进行统计分析。
2 结果与讨论
2.1 膳食纤维吸附能力的测定

表1 豌豆皮膳食纤维对脂肪的吸附能力(g/g)
2.1.2 膳食纤维对胆酸钠的吸附能力 由表2可知,豌豆皮膳食纤维对胆酸钠有吸附作用,吸附能力与膳食纤维种类和反应体系pH有关,在反应体系pH相同的情况下,水溶性膳食纤维要比水不溶性膳食纤维对胆酸钠的吸附能力好;并且体系的酸碱度对膳食纤维吸附胆酸钠的能力有较大的影响,在中性条件下(模拟小肠环境)膳食纤维对胆酸钠的吸附能力要高于酸性条件下(模拟胃环境)的吸附力,PSDF1对胆酸钠的吸附能力低于PSDF2的吸附能力。豌豆皮膳食纤维可以在溶液中展开成网络状结构,从而产生类似交换树脂的作用,可以束缚胆酸。胆汁酸及其盐类物质与膳食纤维在小肠内结合,随粪便排出体外。这样需要有额外的胆固醇被转化成胆酸以补偿那些被排掉的部分,体内胆固醇因此减少,从而达到降低血脂水平的目的。

表2 豌豆皮膳食纤维对胆酸钠的吸附能力(mg/g)
2.1.3 膳食纤维对胆固醇的吸附能力 由表3可知,豌豆皮膳食纤维对胆固醇有吸附作用,豌豆皮水溶性膳食纤维对胆固醇的吸附能力大于水不溶性膳食纤维,并且膳食纤维的吸附能力受反应体系酸碱性影响,在中性条件下(模拟小肠环境),膳食纤维对胆固醇的吸附能力要高于酸性条件下(模拟胃环境)的吸附力,PSDF1对胆固醇的吸附能力明显高于PSDF2的吸附能力。胆固醇的过量摄入与动脉粥样硬化和冠心病等疾病的发病率呈明显正相关[14]。本实验证明豌豆皮膳食纤维对胆固醇有吸附作用,从而降低发生心血管疾病的风险。
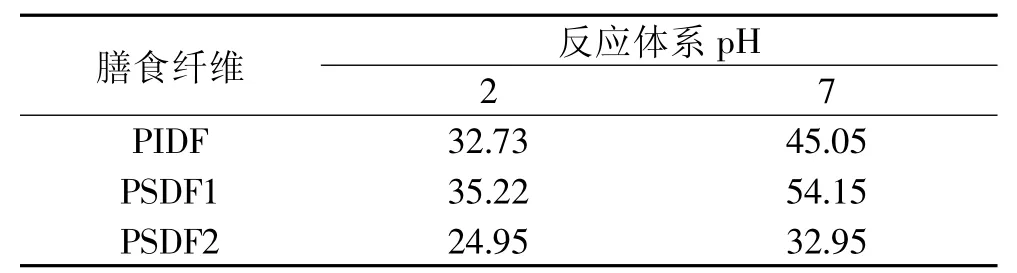
表3 豌豆皮膳食纤维对胆固醇的吸附能力(mg/g)
2.2 膳食纤维的抗氧化能力
2.2.1 清除DPPH·和·OH的能力 大多数自由基反应活性较强而寿命短暂,DPPH·是为数不多的即使在室温条件下也能保持稳定的自由基,当抗氧化剂或供氢体出现时,稳定的自由基变成DPPH-H,颜色深度下降,下降的程度随时间增大。样品清除DPPH·的能力如表4所示。PSDF2对DPPH·的清除最有效,约是VC的三分之一,是PSDF1的两倍多,是PIDF的三倍。
·OH是活性最强的活性氧,它的大量产生是中毒的重要特征,因此清除·OH是机体最有效的预防各种疾病的途径。样品清除·OH的能力如表4所示,PSDF1与PSDF2的清除能力相当,约为VC的三分之一,PIDF的清除能力约为VC的五分之一,因此可见豌豆皮可溶性膳食纤维是一种良好的·OH清除剂。
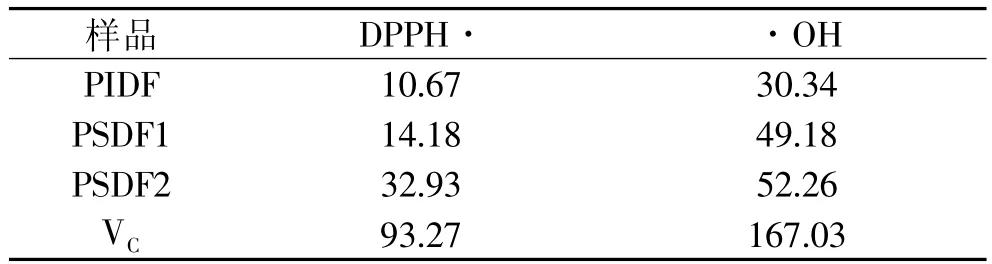
表4 膳食纤维清除DPPH·,·OH的能力(μmol/g)
2.2.2 还原能力 还原能力是表示抗氧化物质提供电子能力的重要指标,还原能力大的样品是良好的电子供体,可以通过提供电子使自由基变为稳定的物质,以中断自由基的连锁反应[15]。许多研究已证实抗氧化活性同还原力之间呈正相关关系[16]。用铁氰化钾还原法测得的膳食纤维产品的还原力如表4所示。PIDF的还原能力最弱,仅8.11μmol VC当量·g-1,PSDF1 的还原能力最强,为17.35μmol VC当量·g-1,是PIDF的两倍多,PSDF2的还原能力居中。

表5 膳食纤维的还原能力和螯合铁离子的能力
2.2.3 螯合铁离子能力 体内的许多氧化过程都是在过渡金属离子的参与下进行的。铁离子能够催化Haber Weiss反应,该反应能够利用由酶产生的活性较小的过氧化物和过氧化氢等,产生毒性更强的自由基[17],因此螯合铁离子的能力可以反应重要的抗氧化信息。用铁-菲洛嗪法测得的膳食纤维产品的螯合能力结果如表5所示。PSDF1螯合铁离子的能力最强,而PIDF的能力最弱,仅有1.18μmol EDTA当量·g-1。
3 结论
本实验比较了从豌豆皮中采用不同的方法提取的膳食纤维的吸附能力和氧化能力,得出豌豆皮水溶性膳食纤维对脂肪、胆酸钠、胆固醇的吸附能力明显高于豌豆皮水不溶性膳食纤维,而通过木聚糖酶法制得的PSDF1在脂肪和胆固醇的吸附能力方面高于通过纤维素酶法制得的PSDF2;在抗氧化能力方面,豌豆皮水溶性膳食纤维的抗氧化能力也明显高于豌豆皮水不溶性膳食纤维,通过木聚糖酶法制得的PSDF1清除DPPH·、·OH能力低于通过纤维素酶法制得的PSDF2,但是PSDF1的还原能力、螯合铁离子能力高于PSDF2。本研究为今后豌豆皮膳食纤维的开发和利用提供了一定的理论依据。
[1]魏红,徐宏伟,肿红舰,等.膳食纤维的应用及检测方法[J].海峡预防医学,2004,10(2):25-27.
[2]郑建仙.功能性膳食纤维[M].北京:化工工业出版社,2005:9-11.
[3]卢宏科,王琴,区子牟,等.膳食纤维的功能与应用[J].广东农业科学,2007,4(3):67-70.
[4]叶静,肖美添,汤须崇.江蓠藻膳食纤维吸附脂肪、胆固醇和胆酸钠的研究[J].食品与机械,2010,26(1):92-94.
[5]陶颜娟.小麦麸皮膳食纤维的改性及应用研究[D].江南大学,2008:23-26.
[6]Sangnark A,Noomhorm A.Effect of particle sizes on functional properties of dietary fiber prepared from sugarcane bagasse[J].Food Chemistry,2003,80:221-229.
[7]胡国华,黄绍华.米糠膳食纤维对胆酸钠吸附作用的研究[J].中国食品添加剂,2001(2):10-12.
[8]欧仕益,郑妍,刘子力,等.酵解和酶解麦麸吸附脂肪和胆固醇的研究[J].食品科技,2005(1):91-93.
[9]Shimada K,Fijikawa K,Yahara K,et al.Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin[J].Journalof Agriculture and Food Chemistry,1992,40:945-948.
[10]Marklund S,Marklund.Involvement of the superoxide anion radical in the antoxidation of pyrogallol and a convenientassay for superoxide dismutase[J].Europe Journal of Biochemistry,1974,47:469-474.
[11]Oyaizu M.Studies on products of browning reaction:antioxidative activities of products of browning reaction prepared from glucosa mine[J].Japanese Journal of Nutrition,1986,44:307-315.
[12]Carter P.Spectrophotometric deter mination of serum iron at the submicrogram level with a new reagent(ferozine)[J].Analytical Biochemistry,1971,40:450-458.
[13]田向阳,李玉清,韩梅,等.北京市小学生与肥胖相关知识、态度、行为的现况调查[J].中国健康教育,2004,20(5):393-395.
[14]张钟,王德生.玉米膳食纤维对实验性高脂血症小鼠降脂作用的影响[J].中国粮油学报,2005,20(5):120-123.
[15]饶家麟,柯文庆.鲣鱼蒸煮液蛋白质水解物之抗氧化活性[J].台湾农业化学与食品科学,2001,39(5):363-369.
[16]荣建华,李小定,等.大豆多肽抗氧化研究效果[J].食品科学,2002,23(11):118-120.
[17]Kehrer J P.The Haber-Weiss reaction and mechanisms of toxicity[J].Toxicology,2000,149:43-50.
Study on adsorption and anti-oxidation properties of pea hull dietary fiber
SHAO Juan-juan,MA Xiao-jun*
(School of Food Science and Technology,Jiangnan University,Wuxi214122,China)
The comparison of the adsorption properties and anti-oxidation abilities of PDF(Pea hull dietary fiber)prepared in three different ways,such as:PIDF(pea hull insoluble dietary fiber),PSDF1(pea hull soluble dietary fiber obtained with xylanase)and PSDF2(pea hull soluble dietary fiber obtained with cellulase)were carried out.In the adsorption to fat,sodiumtaurocholate and cholesterol,the adsorptivity of PSDF were distinctly higher than PIDF,then the adsorptivity to fat and cholesterol of PSDF1 were also higher than PSDF2.In addition,the antioxidation abilities of PSDFwere significantly higher than PIDF as well,and the scavenging ability to DPPH· and·OH of PSDF1 were inferior to PSDF2,while reducing ability and chelating ability of PSDF1 on iron ions were both much better than PSDF2.
pea hull dietary fiber;adsorption;anti-oxidation
TS255.1
A
1002-0306(2011)08-0157-04
2010-08-12 *通讯联系人
邵娟娟(1984-),女,在读硕士,研究方向:谷物化学。
