褐藻胶裂解酶的研究进展
2011-10-24陈俊帆范红玲赵聪聪程永强
陈俊帆,石 波,范红玲,赵聪聪,程永强,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;
2.中国农业科学研究院饲料研究所,北京 100081)
褐藻胶裂解酶的研究进展
陈俊帆1,石 波2,范红玲1,赵聪聪1,程永强1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;
2.中国农业科学研究院饲料研究所,北京 100081)
褐藻胶是一种由L-古罗糖醛酸和其C5差向异构体D-甘露糖醛酸结合而成的线性高分子多糖。褐藻胶裂解酶能够通过β消去机制催化褐藻胶降解产生具有多种生物活性的褐藻胶寡糖。对于酶的鉴定分析将会拓展酶和寡糖在食品、农业等领域的应用范围。因此本文简要阐述了酶的分类、测定方法、构效关系以及生物学功能,并就其应用的最新进展进行了展望。
褐藻胶,褐藻胶裂解酶,褐藻胶寡糖
褐藻胶是一种由α-L-古罗糖醛酸(G)和其C5差向异构体α-D-甘露糖醛酸(M)随机结合而成的线性高分子多糖,聚合方式包括三种:聚古罗糖醛酸(polyG)、聚甘露糖醛酸(polyM)和异聚 MG段(polyMG),其化学结构见图1[1]。褐藻胶来源丰富,以其螯合金属离子、溶液高黏性、凝胶性等特点被广泛用于食品、纺织、印染、医疗、化工等行业[2]。研究证明褐藻胶寡糖具有抗癌、抗肿瘤、促进植物生长等多种生理功能。褐藻胶裂解酶作为生产褐藻胶寡糖的工具酶,反应效率高,反应条件温和,可控性强,便于定向制备褐藻胶寡糖,其研究具有深远理论意义和应用前景。
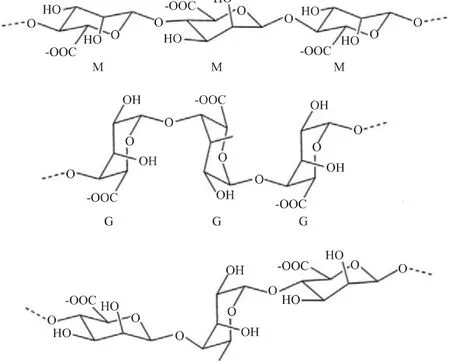
图1 褐藻胶的化学结构
1 褐藻胶裂解酶分类
根据降解褐藻胶上M段和G段(底物专一性)的不同可分为甘露糖醛酸裂解酶EC4.2.2.3((1→4)-α-D-甘露糖醛酸裂解酶)和古罗糖醛酸裂解酶EC4.2.2.11((1→4)-α-L-古罗糖醛酸裂解酶)。酶的特异性可能取决于产生褐藻胶裂解酶的生存环境。迄今为止发现的褐藻胶裂解酶多数具有M特异性,只有少数具有G特异性的酶被发现和分离。一些粗酶提取物常表现为多种底物特异性,可能因为此种生物产生多种褐藻胶裂解酶或此酶具有多种底物特异性[2-3]。
不管是甘露糖醛酸裂解酶还是古罗糖醛酸裂解酶,多表现出内切酶活性,但也有一些外切酶从菌株Sphingomonas sp.和鲍鱼中分离出来。
根据酶分子量大小可以分为三类:25~30kDa,40kDa左右和60kDa左右。40kDa左右的酶多具有M底物特异性,25~30kDa类酶具有多种底物特异性[4]。
根据酶的初级结构,褐藻胶裂解酶被划分为七种多糖裂解酶(polysaccharide lyase,PL)族:5、6、7、14、15、17 和 18[5],与其它多糖裂解酶相比具有广泛多样性。大多数的褐藻胶裂解酶为 PL-5和PL-7。前者多具有polyM底物特异性,后者多具有polyG底物特异性[6]。鲍鱼和小球藻病毒的褐藻胶裂解酶属于PL-14,而Sphingomonas sp.A1菌株基因转录合成的褐藻胶裂解酶 A1-IV 属于 PL-15[7]。
2 褐藻胶裂解酶作用方式
目前发现的能够降解褐藻胶的酶均为裂解酶,尚未发现水解酶。褐藻胶裂解酶通过β消去机制催化褐藻胶降解,其作用位点是1→4糖苷键。在水解糖苷键所在的糖环的C4和C5位置间形成双键,形成了4-脱氧-L-erythro-hex-4-烯醇式吡喃糖醛酸的非还原末端,在235nm处有特征性强吸收。
Gacesa[8]提出一种褐藻胶裂解酶的催化机制,这种机制包括三步反应:a.通过盐桥的中和作用移去羧基阴离子上的负电荷;b.从5位碳上获得质子的基质催化反应;c.羧基基团提供电子在C4与C5之间形成双键,导致发生在4-O糖苷键上的β消去反应。
3 褐藻胶裂解酶的结构
PL-5(Sphingomonas sp.A1-III),PL-7(Corynebacterium sp.ALY-1),PL-14(Chlorella virus,vAL-1)和 PL-18(Alteromonas sp.272)族褐藻胶裂解酶的三维结构目前已被阐述清楚。尽管PL-7的β夹板结构与PL-5的α/α套筒结构很不同,但发现色氨酸、组氨酸、天冬酰胺(谷氨酰胺)和精氨酸几乎出现在PL-5和PL-7催化位点的同一位置,说明这几种氨基酸参与了酶的催化反应[9]。
PL-5族褐藻胶裂解酶A1-III的三维结构中具有大量螺旋,在α6/α5套筒结构中有隧道型裂口,与葡萄糖淀粉酶和纤维素酶的套筒结构相似,如图2所示[10]。
PL-7的褐藻胶裂解酶,如Corynebacterium sp.的G 段裂解酶ALY-1,Sphingomonas sp.A1 的 A1-II'和Pseudomonas aeruginosa的M段降解酶PA1167,都有β夹板结构作为底座,其中有作为催化中心的裂口。PL-7褐藻胶裂解酶的活性中心根据其底物特异性高度保守[5]。其中,A1-II'具有广泛底物特异性,能够裂解polyG、polyM和polyMG。A1-II'β夹板结构中作为催化中心的裂口上覆盖着两个可伸缩的盖环。盖环的柔韧性使得底物可以灵活进入,并决定了酶广泛的底物结合和催化特性[11]。
Yamamoto等[9]通过点突变置换了 PL-14 族HdAly上一些保守序列的残基,结果发现,置换Lys95导致HdAly完全失活,置换Arg92,Arg110和Arg119导致了65%甚至更多的失活。说明从Arg92到Arg119的序列与 HdAly的催化活性密切相关。PL-14族裂解酶vAL-1具有葡萄糖醛酸裂解活性,同时在碱性条件下具有褐藻胶酶裂解活性。其催化组分vAL-1(S)在pH7.0时降解褐藻胶释放双糖至己糖,pH 10.0时主要释放双糖。说明此酶的外切和内切作用方式依赖于pH。vAL-1(S)的立体结构具有两条逆向平行的β夹板,其上有裂口作为催化中心,如图 2[12]所示。
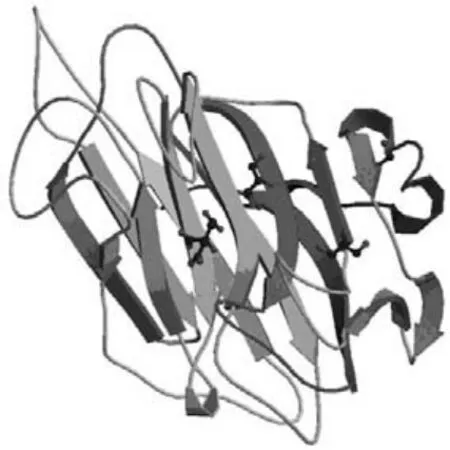
图2 vAL-1的立体结构
4 褐藻胶裂解酶酶活测定方法
褐藻胶裂解酶酶活测定方法包括定性测定和定量测定两种方式。
定性测定主要采用唯一碳源生长法或平板鉴定法。唯一碳源生长法是使用含有褐藻胶、M嵌段或者G嵌段作为唯一碳源的培养基,通过观察微生物的生长和液体培养基粘稠度的降低初步确定酶的活性。更加灵敏的测定方法则使用95%乙醇、饱和氯仿蒸汽或者钌红试剂等处理有微生物生长的培养皿,在一定的背景下观察水解圈的大小[13]。
定量测定方法有很多,其中苔黑酚法(Orcinol Assay)、硫代巴比妥酸法(Thiobarbituric Acid Assay)、紫外吸收法(Ultraviolet Absorption Assay)、黏度法(Viscometry Assay)等是较为常用的方法。
苔黑酚法是根据未降解褐藻胶在热碱性溶液中短暂处理的稳定性,中间产物还原性寡糖和终产物单糖几乎不发生苔黑酚反应。硫代巴比妥酸法的原理是4-脱氧-5-酮糖醛酸和作为中间产物的不饱和糖醛酸经高碘酸氧化处理后产生β-甲酰丙酮酸,而未降解的褐藻胶不发生反应[14]。紫外吸收法最为简单方便,根据酶解产生的不饱和糖醛酸在235nm处具有强烈吸收的特点直接进行比色测定。褐藻胶在降解过程中溶液黏度下降,黏度法测定的灵敏度高但操作较为困难[2]。此外,还有还原糖法等。在实际酶活测定中,常同时测定黏度、还原糖和吸光值等指标综合反映酶的降解特性[15]。
5 褐藻胶裂解酶来源
目前已有50多种褐藻胶裂解酶从藻类、海洋软体动物以及海洋和土壤细菌中分离出来。Lin等[16]从海洋褐藻Fucus gardneri silva中分离提纯出褐藻酸酶。Davidson等[17]以海藻酸钠作为唯一碳源,分离出一株能降解褐藻胶的假单胞菌,该菌所产褐藻胶裂解酶分子量约为50000,特异性降解 polyG段。Suzuki等[18]从鲍鱼 Haliotis discus hannai中分离出褐藻胶裂解酶HdAly,偏好裂解polyM段。之后他们又从此种鲍鱼中分离出新型寡褐藻胶酶HdAlex,可以外切褐藻胶产生二糖[7]。此外,Suda 等[19]发现小球藻病毒能够转录合成褐藻胶裂解酶,此褐藻胶裂解酶最适pH 10.5,酶活性依赖于Ca2+的存在。
6 褐藻胶裂解酶的生物学功能
6.1 褐藻胶裂解酶在不产褐藻胶生物体中的功能
产褐藻胶裂解酶的微生物能利用褐藻胶为初级碳源或次级碳源,采用褐藻胶作为唯一碳源的培养基上可以筛选得到这些微生物。Sphingomonas sp.A1能够产生四种褐藻胶裂解酶:A1-I、A1-II,A1-III和A1-IV。A1-I,A1-II和 A1 -III是内切酶,降解褐藻胶形成不饱和二糖、三糖和四糖。A1-IV具有外切酶活性,能够断开不同聚合度褐藻胶非还原末端的糖苷键,产生不饱和单糖。Sphingomonas sp.A1可以通过糖酵解途径利用这种单糖作为碳源[20]。
食草性软体动物如海螺、鲍鱼等摄入海藻,其体内分泌的褐藻胶裂解酶协同纤维素酶能有效降解藻类中的细胞壁。如鲍鱼Haliotis discus hannai产生褐藻胶裂解酶HdAly和HdAlex,HdA ly能够降解M段丰富的褐藻胶,却不能降解DP<4的不饱和寡甘露糖醛酸。HdA lex可以降解不饱和三糖产生二糖和单糖[6]。
6.2 褐藻胶裂解酶在产褐藻胶生物体中的功能
从肺囊性纤维化(cystic fibrosis,CF)病人肺部获得的条件致病菌Pseudomonas aeruginosa会分泌丰富的褐藻胶,褐藻胶与蛋白形成的复合物相互粘连将细菌包裹其中形成膜状物。这种生物被膜帮助假单胞菌粘附在腔道表面,并对抗生素等产生抗药性。但同时Pseudomonas aeruginosa也能产生褐藻胶裂解酶,此酶与其它蛋白组成多重蛋白分泌复合体,为异构酶、聚合酶催化甘露糖醛酸合成褐藻胶提供接触场所,并引导褐藻胶通过外周胞质进入外层膜[21-22]。当褐藻胶阻塞在外周胞质中不能被运到细胞外时,褐藻胶裂解酶降解褐藻胶,防止高浓度的褐藻胶对细胞产生毒害[23]。
7 褐藻胶裂解酶的应用
褐藻胶裂解酶的应用包括制备褐藻胶寡糖、原生质体分离、治疗肺囊性纤维化病和进行褐藻胶结构微细化研究等。
褐藻胶寡糖分子量小,具有多种生物活性,比如抑制人皮肤中胶原质合成,刺激内皮细胞和角化细胞生长,促进双歧杆菌生长繁殖,促进植物根系伸长等[24]。褐藻胶寡糖的制备方式包括酸水解、热解和酶解等。酸水解和热解制得的寡糖非还原末端为饱和糖醛酸,而酶解制得的寡糖在末端形成不饱和糖醛酸[25]。尽管褐藻胶寡糖分子具有生物活性的根本机理尚不清楚,但研究发现,褐藻胶寡糖的活性与其分子量、分子组成(M/G比)、MG排列顺序等结构信息密切相关。Iwamoto等[26]比较了酸解和酶解制得的褐藻胶寡糖对肿瘤坏死因子TNF-α的诱导活性。发现老鼠巨噬细胞分泌TNF-α依赖于寡糖的结构,酶解得寡糖具有诱导活性,而酸解制得寡糖几乎没有,说明寡糖末端的不饱和结构对于TNF-α的诱导具有关键意义。
采用原生质体融合和基因操作等细胞工程手段可以提高褐藻品质,增加褐藻商业价值。其中原生质体的制备方法已经成熟。采用纤维素酶和褐藻胶酶混合的方法可以降解褐藻细胞壁,释放原生质体[27]。
褐藻胶裂解酶能够配合一些抗生素降解肺囊性纤维化病人肺中病原菌产生的褐藻胶,使病原菌细胞壁通透性增强,利于抗生素发挥抑制作用[28]。
8 展望
褐藻胶裂解酶具有广泛的应用前景,由于褐藻胶及其寡糖所具有的生理活性,酶选择性降解褐藻胶的性质使其成为寡糖工业生产中潜在的重要工具酶。除了可以利用酸解法、化学氧化法等方法获得褐藻胶单体产物,也可以利用褐藻胶裂解酶与D-甘露糖醛酸C5异构酶,以不同褐藻胶为原料生产预期结构的新型褐藻胶片段。通过红外光谱、质谱、核磁共振等手段获得酶切产物的结构信息,如M/G比值、聚合度、单糖连接顺序、糖苷键位置等,从而推断出每种褐藻胶裂解酶的酶切方式。同时,通过对每种特定结构寡糖的抗肿瘤、促进根系生长等生理活性的分析,进而确定要生产某种特定用途的寡糖可以利用何种褐藻胶裂解酶以何种方式生产。
虽然目前对于褐藻胶裂解酶的作用方式和酶切产物的研究十分广泛,但对于某一种菌株及其褐藻胶裂解酶进行持续深入的系统化研究比较少。因此,通过深入研究达到定向利用褐藻胶裂解酶的目的是未来重要的研究趋势。
此外,褐藻胶裂解酶的生产中普遍存在酶活性较低,酶与产物结合紧密、分离困难的问题,因此酶产率低,限制了酶的推广应用,迄今没有一种褐藻胶裂解酶用于工业化生产。所以探索新型的酶制备生产技术,提高酶的产量,创新酶的应用模式也成为必要。基因工程是解决这一问题的重要工程手段,目前已有20多种褐藻胶裂解酶基因被克隆。Sphingomonas sp.A1的 A1-IV,Klebsiella pneumoniae的褐藻胶裂解酶,Pseudomonas sp.OS-ALG-9和P.elyakovii IAM在Escherichia coli细胞中表达。A1-IV在E.coli中的表达酶活是在A1细胞中的270倍。纯化出的酶的最适pH、最适温度和耐热性与纯化自A1的酶相似[29]。而在工程化生产的过程中,可以尝试利用新的高效表达系统进行重组表达和纯化,使用多种突变技术,进行基因改造等进一步提高酶的产出率。
一些褐藻胶裂解酶产生菌是病原菌,如Vibrio sp.QY101,因此不适合大规模生产褐藻胶裂解酶。Liu等[30]利用微生物细胞表面展示技术(microbial cell surface disp lay,MCSD),将褐藻胶裂解酶定位表达在酵母菌Yarrowia lipolytica表面,无需对褐藻胶裂解酶进行分离纯化,可以直接利用细胞悬浮液进行酶解。这些基因工程、细胞工程的手段突破了酶的应用限制,提高了酶的产量、利用率,对于未来酶的广泛应用奠定了坚实的技术基础,预示着未来酶应用中的技术革新,会越来越多地应用于褐藻胶裂解酶的生产。
[1]Baldursdóttir SG,Nyström B,Kjøniksen A L,etal.Riboflavin-Sensitized Photochemical Changes in Aqueous Solutions of Alginate[J].Rheological Studies,Biomacromolecules,2003(4):429-436.
[2]Wong T Y,Preston L A,Schiller N L.Alginate lyase:review of major sources and enzyme characteristics,structure-function analysis,biological roles,and applications[J].Annual Review of Microbiology,2000,54:289-340.
[3]宋凯.海洋弧菌Vibrio sp.QY101褐藻胶裂解酶的研究[D].中国海洋大学,2004.
[4]Osawa T,Matsubara Y,Muramatsu T,et al.Crystal structure of the alginate(poly- α-L-guluronate)lyase from Corynebacterium sp.at 1.2 Å resolution[J].Journal of Molecular Biology,2005,345:1111-1118.
[5]KobaAgariyashi T,Uchimura K,Miyazaki M,et al.A new high-alkaline alginate lyase from a deep-sea bacterium Agarivorans sp.[J].Extremophiles,2009,13:121-129.
[6]Miyake O,Ochiai A,Hashimoto W,et al.Origin and Diversity of Alginate Lyases of Families PL-5 and-7 in Sphingomonas sp.Strain A1[J].Journal of Bacteriology,2004,186:2891-2896.
[7]Suzuki H,Suzuki K,Inoue A,et al.A novel oligoalginate lyase from abalone,Haliotis discus hannai, that releases disaccharide from alginate polymer in an exolytic manner[J].Carbohydrate Research,2006,341:1809-1819.
[8]Gacesa P.Alginate modifying enzymes:A proposed unified mechanism of action for the lyases and epimerases[J].FEBS Letters,1987,212:199-202.
[9]Yamamotoa S,Saharab T,Sato D.Catalytically important amino-acid residues of abalone alginate lyase HdAly assessed by site-directed mutagenesis[J].Enzyme and Microbial Technology,2008,43:396-402.
[10]Yoon H J,Mikami B,Hashimoto W,et al.Crystal structure of alginate lyase A1-III from Sphingomonas species A1 at 1.78Å resolution[J].Journal of Molecular Biology,1999,290:505-514.
[11]Ogural K,Yamasaki M,Mikami B,et al.Substrate recognition by family 7 alginate lyase from Sphingomonas sp.A1[J].Journal of Molecular Biology,2008,380:373-385.
[12]Ogura K,Yamasaki M,Yamada T,et al.Crystal Structure of Family 14 Polysaccharide Lyase with pH-dependent Modes of Action[J].Journal of Biological Chemistry,2009,51:35572-35579.
[13]韩文君.褐藻胶生物转化的分子生物学基础研究[D].中国海洋大学,2003.
[14]Preiss J,Ashwell G.Alginic acid metabolism in bacteria.I.Enzymatic formation of unsaturated oligosac-charides and 4-deoxy-L-erythro-5-hexoseulose uronic acid[J].Journal of Biological Chemistry,1962,237:309-316.
[15]An Q D,Zhang gL,Wu H T,et al.Production and partial properties of alginase from newly isolated Flavobacterium sp.LXA[J].Process Biochemistry,2008,43:842-847.
[16]Lin Y T,Hassid W Z.Pathway of alginic acid synthesis in the marine brown algae,Fucus gardneri silva[J].Journal of Biological Chemistry,1966,241:5284-5297.
[17]Davidson IW,Sutherland IW,Lawson C J.Purification and properties of an alginate lyase from a marine bacterium[J].Biochemical Journal,1976,159(3):707-713.
[18]Shimizu E,Ojima T,Nishita K.cDNA cloning of an alginate lyase from abalone,Haliotis discus hannai[J].Carbohydrate Research,2003,338:2841-2852.
[19]Suda K,Tanji Y,Hori K,et al.Evidence for a novel Chlorlla virus-encoded alginate lyase[J].FEMS Microbiology Letters,1999,180:45-53.
[20]Hashimotoa W,Miyakea O,Ochiai A,et al.Molecular identification of Sphingomonas sp.A1 alginate lyase(A1-IV')as a member of novel polysaccharide lyase family 15 and implications in alginate lyase evolution[J].Journal of Bioscience and Bioengineering,2005,99:48-54.
[21]Jain1 S,Ohman D E.Role of an alginate lyase for alginate transport in mucoid Pseudomonas aeruginosa[J].Infection and Immunity,2005,73:6429-6436.
[22]AlbrechtM T,Schiller N L.Alginate lyase(algL)activity is required for alginate biosynthesis in Pseudomonasaeruginosa[J].Journal of Bacteriology,2005,187:3869-3872.
[23]Bakkevig K,Sletta H,Gimmestad M.Role of the Pseudomonas fluorescens alginate lyase(AlgL)in clearing the periplasm of alginates not exported to the extracellular environment[J].Journal of Bacteriology,2005,187:8375-8384.
[24]Yamamoto Y,Kurachi M,Yamaguchi K,et al.Stimulation of multiple cytokine production in mice by alginate oligosaccharides following intraperitoneal administration[J].Carbohydrate Research,2007,342:1133-1137.
[25]An Q D,Zhang Q L,Wu H T,et al.Alginate-deriving oligosaccharide production by alginase from newly isolated Flavobacterium sp.LXA and its potential application in protection against pathogens[J].Journal of Applied Microbiology,2009,106:161-170.
[26]Iwamotoa M,Kurachi M,Nakashimaa T,et al.Structureactivity relationship of alginate oligosaccharides in the induction of cytokine production from RAW264.7 cells[J].FEBS Letters,2005,579:4423-4429.
[27]Inoue A,Kagaya M,Ojima T.Preparation of protoplasts from Laminaria japonica using native and recombinantabalone alginate lyases[J].Journal of Applied Phycology,2008,20:633-640.
[28]Alkawash mA,Soothill J S,Schiller N L.Alginate lyase enhances antibiotic killing of mucoid Pseudomonas aeruginosa in biofilms[J].APMIS,2006,114:131-138.
[29]Ma L Y,Chi Z M,Li J,et al.Over expression of alginate lyase of Pseudoalteromonas elyakovii in Escherichia coli,purification,and characterization of the recombinant alginate lyase[J].World Journal of Microbiology and Biotechnology,2008,24:89-96.
[30]Liu G,Yue L,Chi Z,etal.The surface display of the alginate lyase on the cells of Yarrowia Lipolytica for hydrolysis of alginate[J].Marine Biotechnology,2009(11):619-626.
The latest progress of alginate lyase
CHEN Jun-fan1,SHIBo2,FAN Hong-ling1,ZHAO Cong-cong1,CHENG Yong-qiang1,*
(1.College of Food Science & Nutritional Engineering,China Agricultural University,Beijing 100083,China;
2.Feed Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Alginate lyases catalyze the degradation of alginate,a complex copolymer of L-guluronate and its C5 epimer D-mannuronate with β-elimination mechanism,yielding oligosaccharides with special bioactivities.Characterization of alginate lyases will expand the potentialuse of novel oligosaccharides in various industrial and agricultural fields.The methods for analyzing these enzymes,the structure-function relationship of these lyases,as well as their biological roles were cataloged.The applications and future prospects of this important enzyme were also explored.
alginate;alginate lyase;alginate oligosaccharides
TS254.1
A
1002-0306(2011)08-0428-04
2010-07-05 *通讯联系人
陈俊帆(1988-),女,硕士研究生,研究方向:食品科学。
国家自然科学基金(30972286);“十一五”科技支撑计划项目(2007BAD83B03);教育部“新世纪优秀人才支持计划”。
