绿色木霉产内切壳聚糖酶的鉴定及酶学性质的研究
2011-10-24祁兴普夏文水
刘 萍,刘 靖,祁兴普,夏文水
(1.江苏省畜产品深加工工程技术研究开发中心,江苏畜牧兽医职业技术学院,江苏泰州 225300; 2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
绿色木霉产内切壳聚糖酶的鉴定及酶学性质的研究
刘 萍1,刘 靖1,祁兴普1,夏文水2
(1.江苏省畜产品深加工工程技术研究开发中心,江苏畜牧兽医职业技术学院,江苏泰州 225300; 2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
以实验室前期从Trichoderma virideXW01微晶纤维素诱导的发酵液中分离纯化的一种新壳聚糖酶组分Csn为对象,采用SDS-PAGE分析、不同反应时间水解产物的粘度测定和薄层层析(TLC)分析、还原糖含量的测定等手段对壳聚糖酶Csn进行了初步鉴定及酶学性质研究,结果显示:Csn的分子量为45ku,最适作用温度和最适pH分别为60℃和pH5.0,在低于50℃、pH4.8~7.5范围内非常稳定;脱乙酰度DD对Csn的催化速率影响显著,其对83%DD的壳聚糖的催化活力最高;金属离子Mn2+、Mg2+、Ca2+、Zn2+对该酶有明显的促进作用,而Fe3+、Cu2+和Hg2+则对该酶有强烈的抑制作用;该酶的米氏常数为1.10mg/mL,最大反应速度为7.15μmol/mL·min;该酶以内切方式作用于壳聚糖,主要水解GlcNAc-GlcN和GlcN-GlcN之间的糖苷键,水解产物以四糖以上的壳寡糖为主。
绿色木霉,壳聚糖酶,酶学性质,作用模式
壳聚糖(chitosan)是一种从海洋水生甲壳类动物外壳或真菌细胞壁中提取的天然多糖,它是由氨基葡萄糖(GlcN)和少量乙酰氨基葡萄糖(GlcNAC)通过β-1,4键连接而成的天然线性高分子聚合物,壳聚糖为含氮多糖类生物活性物质,具有对人体十分重要的生理功能。但由于壳聚糖分子量大,水溶性差,在人体内不易吸收,使其应用受到限制;而经壳聚糖降解得到的壳寡聚糖不仅具有水溶性好、易吸收等优点,近年来更发现其还具有许多独特的生理活性和功能性质[1],其应用前景在食品、医药、保健品方面倍受瞩目。因而如何制备壳寡糖成为人们研究的热门课题。绿色木霉是生产商品纤维素酶的主要丝状真菌之一,近十年来很多研究者发现其发酵产物同时可以降解壳聚糖,国内外已经在实验室范围内广为利用绿色木霉发酵制备甲壳低聚糖[2-5]。但是目前为止,对绿色木霉在纤维素类碳源或壳聚糖碳源诱导条件下产壳聚糖酶组分的分离鉴定尚不完全,除了夏文水等人分离鉴定的具有氨基葡萄糖苷酶活性的CBHI酶(66ku)[6]以及赵玉萍等人分离的内切壳聚糖酶组分(51ku)[7]外,尚未有其它报道。本研究对从绿色木霉(Trichoderma virideXW-01)经微晶纤维素诱导的发酵产物中分离提取出一个新壳聚糖酶组分Csn,通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、薄层层析(TLC)、还原糖含量分析(DNS)等方法对其水解壳聚糖的作用模式及酶学性质进行了分析,为利用绿色木霉这一潜在优良壳聚糖酶源发酵制备壳寡糖提供了一定的数据参考。
1 材料与方法
1.1 材料与仪器
纯化酶Csn冻干粉 经DEAE-sepharose CL6B、phenyl sepharose CL4B和 sephadex G75柱层析纯化后冷冻干燥制得,活力为5.96U/mg;壳聚糖Ⅰ 脱乙酰度71.75%、相对分子质量6.03×105;壳聚糖Ⅱ脱乙酰度83%、相对分子质量5.21×105;壳聚糖Ⅲ
脱乙酰度91%、相对分子质量8.8×105;壳聚糖Ⅳ
脱乙酰度92.7%、相对分子质量5.12×105;壳聚糖Ⅴ 脱乙酰度96.7%、相对分子质量4.3×105,均为实验室由蟹壳经碱处理制得;壳寡糖标样(GlcN)2-6
日本烧津水产化学株式会社;丙烯酰胺(Acr)、N,N″-亚甲基双丙烯酰胺 Fluka公司,电泳级;四甲基乙二胺(TEMED) Amersham公司;β-巯基乙醇
Janssen Chimica公司;氨基葡萄糖盐酸盐、考马斯亮兰R-250 Sigma公司,分析纯;低分子量蛋白质marker 碧云天生物技术有限公司,生化试剂;薄层层析用硅胶G 青岛海洋化工有限公司生产;其它试剂均为国产分析纯。
Mini型蛋白质电泳仪 0.75mm厚度制胶板,美国BioRad公司;UV-754紫外分光光度计 上海菁华科技仪器有限公司;HHS-11-2电热式恒温水浴锅 江苏金坛宏凯仪器厂;TGL-16C台式高速离心机 上海安亭科学仪器厂;FA2004电子天平 上海天平仪器厂;NDJ-7型旋转式粘度计 上海精密科学仪器有限公司;ELS20实验室pH计 瑞士梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 壳聚糖酶Csn的SDS-PAGE分析 参照文献[8],分离胶浓度为10%,浓缩胶浓度为5%,电泳采用pH8.3的 Tris-甘氨酸缓冲体系,考马斯亮蓝R-250染色。
1.2.2 壳聚糖酶酶活力测定方法 DNS法[9]。壳聚糖酶活力单位定义:在最适温度和最适pH下酶与底物反应,每分钟形成1μmol氨基葡萄糖所需要的酶量。
1.2.3 温度对Csn酶活性和稳定性的影响 分别移取适当稀释的酶液0.5mL,加入1.5mL不同的底物溶液中,摇匀,在20、30、40、45、50、55、60、70、80℃下反应30min测定酶活,以确定最适反应温度;此外,预先将壳聚糖酶Csn在以上各温度中保温30min,然后按照酶活力测定方法测定残余酶活力。以各温度下初始酶活力为各温度下的对照(100%),研究温度对壳聚糖酶Csn稳定性的影响。底物条件为:浓度均为0.5%,壳聚糖溶液pH为5.2。
1.2.4 pH对Csn酶活性和稳定性的影响 分别用0.2mol/L的不同pH的醋酸-醋酸钠(pH3.6~5.8)、磷酸盐(pH6.0~7.5)的缓冲溶液配制0.5%壳聚糖溶液,加入0.5mL酶液,60℃反应30min,按照酶活力测定方法测定酶活力,以活力最高者为100%对照,确定酶最适反应pH。
预先将壳聚糖酶Csn与以上各pH缓冲液等体积混合,置于4℃保存6h,然后按照酶活力测定方法测定残余酶活力。以各pH条件下初始酶活力为各自对照(100%),研究pH对壳聚糖酶Csn稳定性的影响。
1.2.5 底物特异性测定 将不同脱乙酰度和不同相对分子质量的壳聚糖分别配制成浓度为0.5%(w/v)和pH为5.0的壳聚糖溶液,各取1.5mL底物与0.5mL酶液在60℃反应30min,测定壳聚糖活力大小,以活力最高者为100%,计算不同壳聚糖作底物时的相对活力。
1.2.6 壳聚糖酶Csn的动力学分析 分别配制pH为5.0的不同浓度的壳聚糖底物溶液,并使其1/[S]成等差级数,依次分别为0.2、0.4、0.5、0.8、1.0、1.25、2、2.5、5mg/mL,分别移取 Csn酶液 0.5mL,加入1.5mL不同浓度的底物溶液中,摇匀,分别于60℃反应30min,测定其壳聚糖酶活力。采用双倒数法(Lineweaver-Burk)[10]来测定Csn酶的Km、Vmax。
1.2.7 金属离子对Csn酶活力的影响 将不同的无机盐溶液以及EDTA溶液与等量酶液混合,并使混合液中的无机盐及EDTA的最终浓度达到0.5mmol/L,按1.2.2的方法测定酶活力,设不加金属离子组为对照组,测定金属离子对Csn酶活力的影响。
1.2.8 壳聚糖经Csn水解过程中的粘度变化 用pH5.0的醋酸缓冲液配制50mL0.5%的壳聚糖溶液,加入1%的壳聚糖酶溶液(酶底比),在50℃反应,每隔一段时间用快速粘度测定法[7]测定反应体系的粘度,绘制粘度随时间变化的曲线。
1.2.9 Csn作用壳聚糖的水解模式分析 在0.5% (w/v)、pH5.0的壳聚糖溶液中加入1%的粗酶液和Csn酶液,50℃恒温水浴中分别水解24h和48h,沸水浴灭酶后取等量水解产物点样于硅胶薄板,用1mg/mL的氨基葡萄糖和壳寡糖标样做对照。置于层析缸中在展开剂(异丙醇∶水∶氨水=70∶30∶1,V/V/V)中上行展开,展开完毕后,在100℃的烘箱中烘干,再用0.5%的茚三酮乙醇溶液(w/v)作为显色剂,在105℃干燥箱中显色20min[6]。
2 结果与分析
2.1 壳聚糖酶Csn的SDS-PAGE分析
SDS-PAGE被广泛应用于蛋白质纯度的鉴定和相对分子质量的测定[11]。将粗酶和纯化壳聚糖酶Csn进行SDS-PAGE电泳,以初步鉴定Csn酶组分的纯度和相对分子量,结果见图1。
由图1可以看出,粗酶(泳道1)中蛋白条带较多,经离子交换层析和疏水层析等一系列柱层析纯化后,得到一条45ku大小的条带(泳道2),表明壳聚糖酶Csn已达到电泳纯,结合前期的凝胶层析结果证实该酶为单亚基蛋白,SDS-PAGE法测得的分子量大小约为45ku。
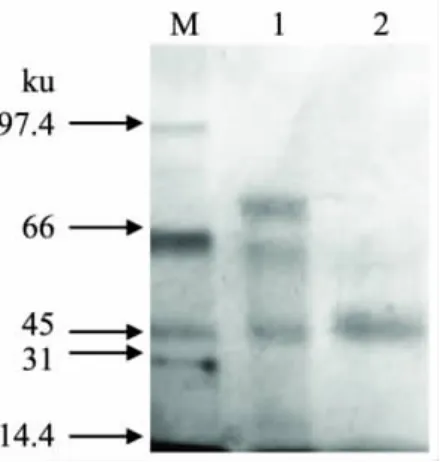
图1 壳聚糖酶Csn的SDS-PAGE电泳图谱注:1为纤维素酶粗酶液;2为纯化后的
2.2 壳聚糖酶Csn的最适反应温度及热稳定性分析
以壳聚糖Ⅱ为底物,研究温度对壳聚糖酶Csn的酶活力和稳定性的影响,结果见图2。
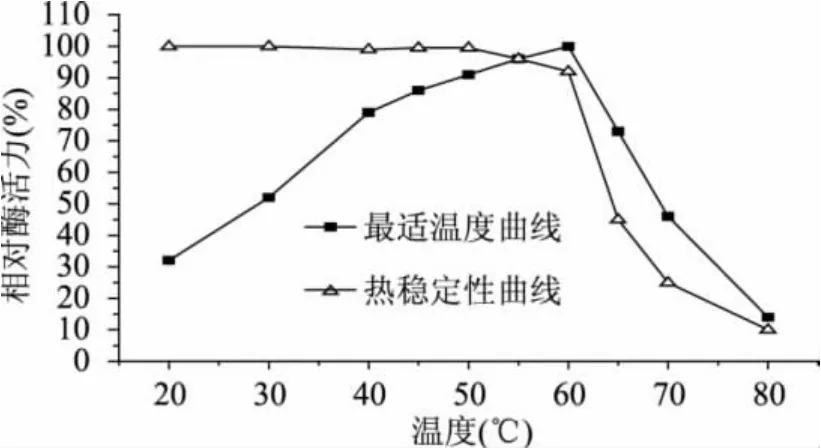
图2 温度对壳聚糖酶Csn的酶活力和稳定性的影响
由图2可以看出,该壳聚糖酶Csn在45~60℃之间活性较强,温度低于60℃时酶活力随着温度的升高而增强,在60℃过后随着温度的升高酶活力急剧下降,由此可以看出壳聚糖酶Csn的最适反应温度为60℃,这与赵玉萍等人已报道的绿色木霉在壳聚糖诱导条件下产生的内切壳聚糖酶[7]并不相符,由此可初步推测:绿色木霉在纤维素类碳源和壳聚糖类碳源中诱导产生的壳聚糖降解组分并不完全相同,这有待深入探究。
从壳聚糖酶Csn的热稳定性曲线可知,壳聚糖酶Csn在20~50℃之间稳定性很好,保温30min其壳聚糖酶活性基本保持不变;当温度升至50~60℃之间时,其壳聚糖酶活力缓慢下降,但仍保留有90%以上的活力,初步表明壳聚糖酶Csn非常稳定;当温度超过60℃时,酶高温失活,导致残余酶活力急剧下降。
2.3 pH对壳聚糖酶Csn酶活力及稳定性的影响
pH对壳聚糖酶Csn酶活力及稳定性的影响见图3。
由图3可知,pH对壳聚糖酶Csn的酶活力的影响呈倒V型,Csn的最适反应pH为5.0,且在pH4.5~5.5的范围内具有较高的酶活力(80%以上)。pH<5.0时,随着pH的上升Csn酶活力近似呈线性增加,而pH>5.0时酶活力则急剧下降;这是因为在pH< 4.0的强酸条件下,酶蛋白结构变性失活;而当pH>5.5时壳聚糖因为溶解性下降而出现絮状沉淀,酶和底物不能接触从而导致酶活力急剧下降。
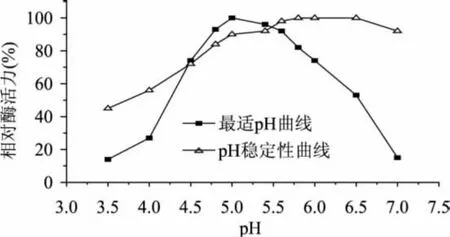
图3 pH对壳聚糖酶Csn的酶活力和稳定性的影响
图3的pH稳定性曲线表明,壳聚糖酶Csn活性在pH4.8~7.5之间有较好的稳定性,孵育6h残余酶活力仍维持在80%以上的初始酶活力;而在pH4.0~4.8范围内酶活力损失较大,结合最适反应pH曲线: Csn在pH4.5~5.5的范围内具有较高的酶活力,可初步推测Csn的等电点在pH4.0~4.8范围内[11]。
2.4 壳聚糖酶Csn的底物特异性分析
选择五种不同脱乙酰度和粘均分子量的壳聚糖作为底物,在壳聚糖酶Csn催化下进行水解,其结果见表1。
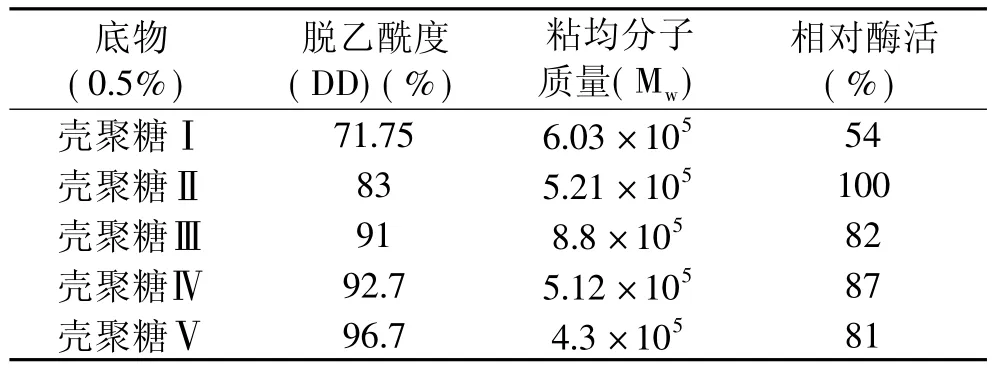
表1 Csn的底物特异性
由表1可知,壳聚糖的脱乙酰度对酶催化能力影响较粘均分子量更为显著,Csn对于脱乙酰度(DD)为83%的壳聚糖显示了最强的活力,将该活力定为100%。从Csn对壳聚糖Ⅱ和壳聚糖Ⅳ两个粘均分子质量相近的底物的水解能力看,当DD>83%时,脱乙酰度小的壳聚糖底物更易被Csn水解,由此可以推测该酶主要水解GlcNAc-GlcN之间的糖苷键;同时Csn酶对DD90%以上的壳聚糖也具有较高的降解能力,表明Csn酶还可以降解GlcN-GlcN之间的糖苷键;且当脱乙酰度相近时(壳聚糖Ⅲ和壳聚糖Ⅳ),粘均分子量越小,Csn酶的催化能力越强。Csn酶对71.75%DD的壳聚糖的降解活力很低,表明该酶不能水解GlcN-GlcNAc和GlcNAc-GlcNAc之间的糖苷键。
已知壳聚糖酶根据底物特异性被分为三类:壳聚糖酶Ⅰ可以同时切割GlcNAc-GlcN和GlcN-GlcN键;壳聚糖酶Ⅱ只能切割GlcN-GlcN键;而壳聚糖酶Ⅲ能切割GlcN-GlcN和GlcN-GlcNAc之间的糖苷键[12],由此可初步推测Csn酶属于壳聚糖酶I类。
2.5 壳聚糖酶Csn的动力学常数测定
以不同浓度的壳聚糖溶液作为反应底物,按照酶活力测定方法,进行反应30min,测定壳聚糖酶的酶活力。壳聚糖浓度的倒数为横坐标,以壳聚糖酶活力作为纵坐标,根据Lineweaver-Burk作图,结果见图4。壳聚糖酶Csn的酶促反应动力学遵循米氏方程,经曲线拟合,计算出Csn的壳聚糖的米氏常数Km和Vmax分别为1.10mg/mL和7.15μmol/mL·min。
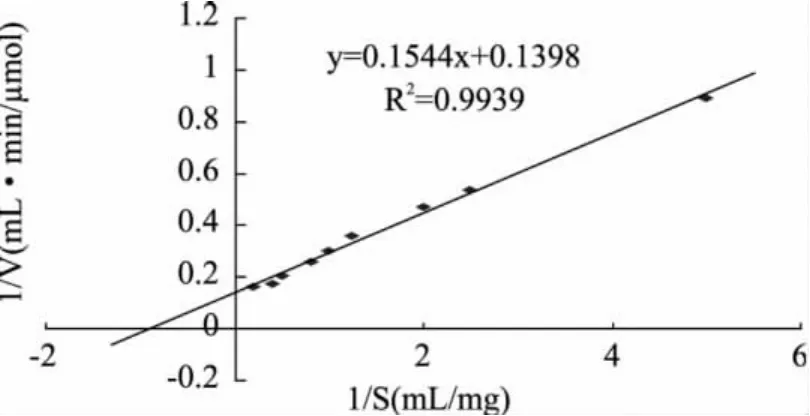
图4 壳聚糖酶Csn动力学曲线
2.6 金属离子对Csn酶活性的影响
金属离子对壳聚糖酶Csn酶活力影响见表2。金属离子Mn2+、Mg2+、Ca2+、Zn2+对酶Csn有一定的激活作用,尤其以Mn2+和Mg2+为最;而Fe3+、Cu2+和Hg2+则对酶有强烈的抑制作用,这与已报道的壳聚糖酶性质基本一致[13]。在酶反应体系中加入金属螯合剂EDTA,没有观察到对酶活性的抑制作用,表明Csn酶的活性中心没有金属离子的参与。
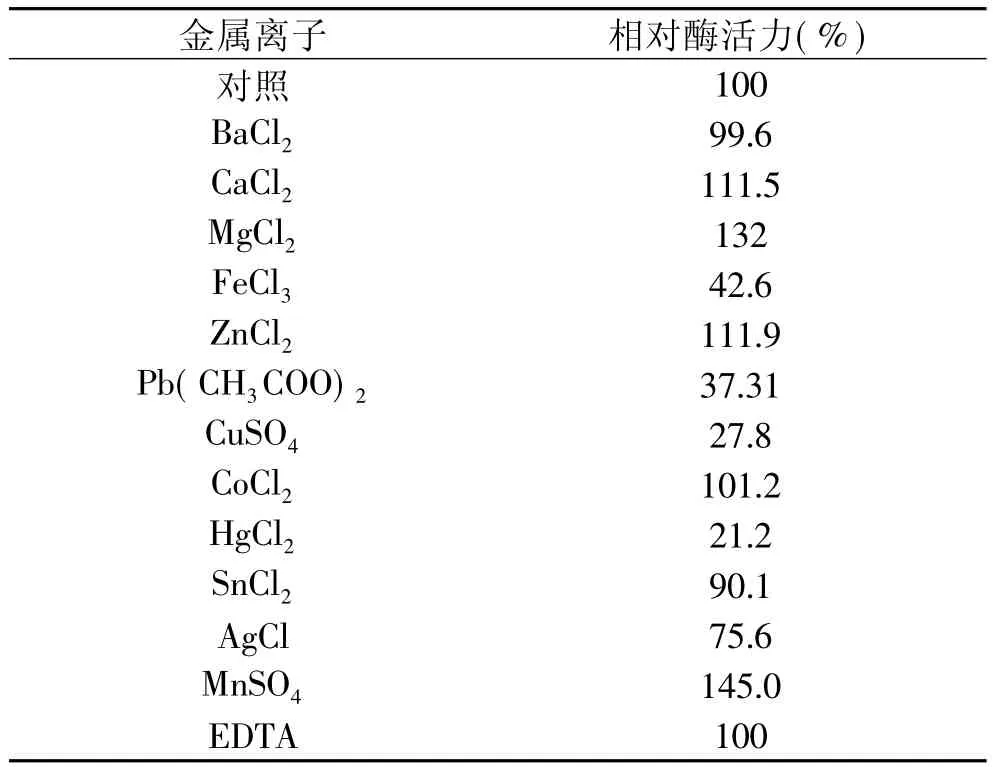
表2 金属离子对Csn酶活力的影响
2.7 壳聚糖酶降解反应体系粘度的变化
不同反应时间粗酶制剂及酶Csn水解壳聚糖反应体系的粘度变化曲线如图5所示。在加酶量相同的条件下,粗酶和Csn两个反应体系的粘度在反应初始阶段均呈现迅速下降趋势,但是酶Csn水解液的粘度下降更迅速,反应1h以后,其粘度下降趋于平稳,粘度降低87.5%;而粗酶反应1h后粘度下降62%,在反应2h后粘度下降趋于平稳。这一结果表明Csn酶以内切方式作用于壳聚糖,也是粗酶制剂中导致壳聚糖溶液粘度下降的关键组分。加酶量相等条件下,粗酶催化壳聚糖能力低于纯酶Csn,这是因为粗酶中含有多种酶蛋白组分,如2种外切氨基葡萄糖苷酶组分[14]、多种纤维素酶组分等[15],阻碍了酶与壳聚糖底物的有效接触,因此酶的水解速率也随之被降低。
2.8 Csn酶作用壳聚糖水解产物的TLC分析
壳聚糖Ⅱ经粗酶和Csn酶降解后的产物经薄层层析分析,结果如图6所示。
从图6可以看出,尽管Csn纯酶和粗酶的水解产物均以低聚糖为主,但其作用方式与产物和粗酶并不完全相同,粗酶的水解产物中除含有寡糖外,尚含有少量的氨基葡萄糖单糖,这和我们前期报道纤维素酶粗酶制剂中含有双功能的β-1,4-氨基葡萄糖苷酶相一致[6];而壳聚糖经Csn酶水解24h和48h的水解产物中均不含氨基葡萄糖单糖,壳寡糖含量达到95%以上,且以四糖以上的寡糖为主,这与水解产物的粘度变化趋势相一致,再次表明纯酶Csn以内切方式作用于壳聚糖,属于内切壳聚糖酶类。
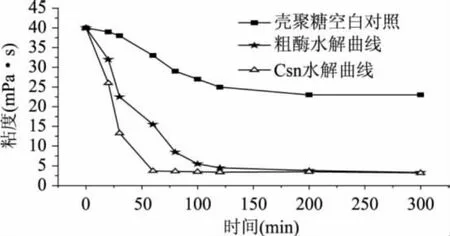
图5 壳聚糖酶降解反应粘度曲线
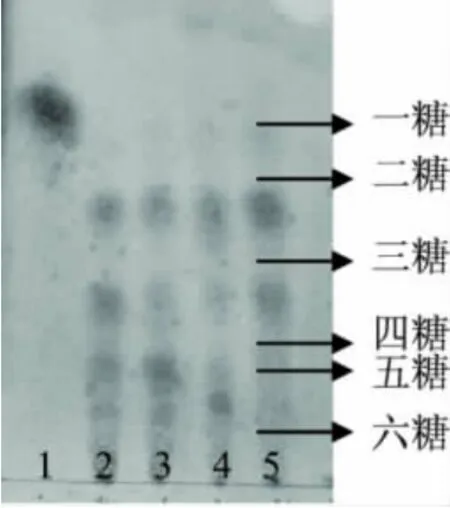
图6 壳聚糖的Csn水解产物的薄层层析分析
3 结论
3.1 绿色木霉在纤维素类碳源诱导下所产生的内切壳聚糖酶组分与壳聚糖诱导条件下并不完全相同,SDS-PAGE显示Csn酶为单亚基蛋白,相对分子质量为45ku。
3.2 对壳聚糖酶Csn的酶学性质研究显示:Csn酶作用壳聚糖的最适温度和pH分别为60℃和pH5.0,在低于50℃、pH4.8~7.5范围内稳定性较好;金属离子Mn2+、Mg2+、Ca2+、Zn2+对该酶有明显的促进作用,而Fe3+、Cu2+和Hg2+则对该酶有强烈的抑制作用;该酶的米氏常数为 1.10mg/mL,最大反应速度为7.15μmol/mL·min。
3.3 底物脱乙酰度对Csn催化速率的影响大于底物的粘均分子质量,该酶对83%DD的壳聚糖的催化活力最高;以内切方式作用于壳聚糖,主要水解GlcNAc-GlcN和GlcN-GlcN之间的糖苷键,属于壳聚糖酶I,水解产物以四糖以上的壳寡糖为主。
[1]Zhang JL,Xia WS,Liu P,et al.Chitosan Modification and Pharmaceutical/Biomedical Applications[J].Marine Drugs,2010 (8):1962-1987.
[2]Qin CQ,Zhou B,Zeng LT,et al.The physicochemical properties and antitumor activity of cellulase-treated chitosan[J].Food Chemistry,2004,84(1):107-115.
[3]Xie Y,Wei Y,Hu J.Depolymerization of chitosan with a crude cellulase preparation from Aspergillus niger[J].Appl Biochem Biotechnol,2010,160(4):1074-83.
[4]刘羿君,蒋英,封云芳,等.特种纤维素酶催化水解壳聚糖及壳寡糖的制备研究[J].功能高分子学报,2005,18(2):325-329.
[5]谢宇,胡立明.非专一性酶纤维素酶降解壳聚糖的研究[J].河南工业大学学报,2008,29(3):49-50.
[6]刘靖.纤维素酶降解壳聚糖的机制研究[D].无锡:江南大学食品学院,2006.
[7]赵玉萍,钱红梅.绿色木霉产壳聚糖酶的分离纯化及酶学性质[J].中国粮油学报,2009,24(4):144-147.
[8]Laemmli U K.Cleavage of structural proteins during the assembly of the head of Bacteriophage T4[J].Nature,1970,227: 680-685.
[9]Miller GL.Use of dinitrolicylic acid regent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[10]Lineweaver H,Burk D.The determination of enzyme dissociation constants[J].J Am Chem Soc,1934,56:658-666.
[11]夏其昌.蛋白质化学研究技术与进展[M].北京:科学出版社,1999.
[12]Kim P,Tae KH,Chung KJ,et al.Purification f a constitutive chitosanase produced by Bacillus sp.MET 1299 with loning and expression of the gene[J].FEMS Microbiol Lett,2004,240: 31-39.
[13]Xia WS,Liu P,Liu J.Advance in chitosan hydrolysis by nonspecific cellulases[J].Bioresource Technology,2008,99 (15):6751-6762.
[14]刘萍.绿色木霉产双功能酶的结构与功能研究[D].无锡:江南大学食品学院,2009.
[15]刘北东.绿色木霉纤维素酶系基因克隆表达及特性研究[D].哈尔滨:哈尔滨工业大学生命科学与工程系,2004.
Purification and properties of endo-chitosanase secreted by Trichoderma viride
LIU Ping1,LIU Jing1,QI Xing-pu1,XIA Wen-shui2
(1.Jiangsu Engineering Research Center for Livestock Product Processing Technology,Jiangsu Animal Husbandry&Veterinary College,Taizhou 225300,China;2.Jiangnan University,School of Food Science and Technology,State Key Lab of Food Science and Technology,Wuxi 214122,China)
In our previous study,a novel chitosanase Csn was purified from the fermented solution of Trichoderma viride WX01 with the induction of microcrystalline cellulose.The characteristics of the Csn toward chitosan were studied in detail.SDS-PAGE analysis showed that the enzyme Csn was a mono subunit and the molecular weight was estimated as 45ku.Csn was stable below 50℃and within the pH range from 4.8~7.5.The optimal temperature for the enzyme was 60℃ and optimal pH was 5.0.Mn2+,Mg2+,Ca2+,Zn2+enhanced the enzyme activity,whereas Fe3+,Cu2+and Hg2+inhibited the enzyme activity significantly.Kinetic parameter Km was 1.10mg/mL,Vmaxwas 7.15μmol/mL·min.Substrate specificity study showed that the effect of deacetylation of chitosan on the activity was evident.Csn exhibited the highest activity toward 83%DD chitosan.The hydrolysates of Csn toward 83%DD chitosan were analysis by TLC and viscosity changing.The results indicated that Csn could split GlcNAc-GlcN as well as GlcN-GlcN,with the main product of hydrolysis showing the degrees of polymerization more than four.
Trichoderma viride;chitosanase;enzymatic properties;action mode
TS201.2
A
1002-0306(2011)12-0254-05
2011-08-31
刘萍(1982-),女,博士,讲师,研究方向:食品生物技术。
国家自然科学基金(20876068);江苏省自然科学基金项目(BK2009734);院级课题(YB201003)。
