固定化HRP/H2O2/ACAC酶促体系引发下降解淀粉接枝丙烯酰胺共聚物的合成与表征
2011-10-22闫小亮吕生华侯明明
闫小亮,吕生华,侯明明,弓 瑞
(陕西科技大学资源与环境学院,陕西 西安 710021)
研究开发
固定化HRP/H2O2/ACAC酶促体系引发下降解淀粉接枝丙烯酰胺共聚物的合成与表征
闫小亮,吕生华,侯明明,弓 瑞
(陕西科技大学资源与环境学院,陕西 西安 710021)
以壳聚糖为载体、戊二醛为交联剂制备固定化辣根过氧化物酶(HRP),采用固定化 HRP/H2O2/乙酰丙酮(ACAC)酶促体系制备降解淀粉-丙烯酰胺接枝共聚物(St-g-PAM),通过红外光谱、紫外光谱、核磁共振和电镜扫描等手段对接枝共聚产物进行了结构分析。结果表明,丙烯酰胺成功接枝在降解淀粉上。共聚物用做皮革复鞣剂进行了应用实验,应用结果表明复鞣后的革柔软、纤维分散好和选择填充性强。
固定化辣根过氧化物酶;酶促聚合;接枝共聚;鞣剂
淀粉接枝丙烯酰胺共聚物是聚丙烯酰胺(PAM)具有重要价值的改性产品,它不仅具有聚丙烯酰胺的良好性能,而且降低了原料成本,改善了其适应介质的能力,提高了储存稳定性和热稳定性,扩展了应用领域,在废水处理、石油开采等领域有着广泛的应用。目前对淀粉接枝丙烯酰胺共聚物的研究在水溶液聚合中主要是采用硝酸铈铵、过硫酸盐、高锰酸钾和双氧水等作为引发剂,但这些方法都有一些缺点,例如铈盐作为引发剂,反应工艺条件控制要求严,价格昂贵;过硫酸铵、H2O2作为引发剂,均聚物多,接枝效率低;高锰酸钾作为引发剂,需严格控制酸的浓度,避免淀粉的酸水解,使用时还需注意接枝淀粉的颜色变化[1-2]。近些年,辣根过氧化物酶(HRP)与 H2O2和β-二酮组成的酶促体系可引发乙烯基单体的自由基聚合,成为当今生物催化聚合的研究热点之一[3]。酶催化聚合反应具有反应温和、活性可控、高效、绿色等优点,将其应用到淀粉的改性具有广阔的开发前景,且符合绿色化学的发展方向,对于淀粉基接枝共聚物的进一步发展和应用具有重要意义[4]。但直接使用HRP引发体系的缺点是HRP无法重复使用,价格高,生产成本大,因此限制了HRP在工业化生产中的应用。酶的固定化技术可以提高酶的利用效率,在保持酶引发的高效、专一及温和等特性的同时,使酶可以回收、多次重复使用,降低生产成本,有助于实现生产工艺和检验操作的连续化和工业化。固定化酶载体的选择是关键,其中壳聚糖具有原料易得,价格低廉,力学性能良好,化学性能稳定等优点,近年来成为研究热门的固定化材料之一[5-9]。
本研究对原淀粉进行酶降解,降低其聚合度,增加其水溶性和渗透性;然后在固定化HRP/H2O2/ACAC体系下制备降解淀粉-丙烯酰胺接枝共聚物,并对接枝共聚物进行表征。
1 实验部分
1.1 主要试剂
辣根过氧化物酶(HRP),酶活力330 U/mg,上海雪满生物科技有限公司;耐高温α-淀粉酶,酶活力10 000 U/mL,山东安克生物工程有限公司;玉米淀粉,西安淀粉厂;30%过氧化氢、丙烯酰胺、乙酰丙酮、无水乙醇、壳聚糖、戊二醛、碳酸氢钠、盐酸,AR,西安三浦精细化工厂。
1.2 实验步骤
1.2.1 壳聚糖固定化HRP
称取1.0 g壳聚糖溶于质量浓度为l%冰乙酸中,加入2 mol/L NaOH水溶液,使其产生白色絮状沉淀,水洗至中性,抽滤制成纯化壳聚糖。将 0.5 g壳聚糖加到10 mL质量分数为25%的戊二醛溶液中,在25 ℃水浴摇床上振荡6 h,洗去多余的戊二醛,抽滤,加入pH值为6.9的混合磷酸盐缓冲液调节好的20 mL浓度为0.5 mg/mL的HRP溶液,在35 ℃水浴摇床上振荡8 h,于冰箱中(4 ℃)静置过夜,用上述混合磷酸盐缓冲液洗涤,抽滤,直到滤液中检测不到HRP,制得固定化HRP[10-12]。
1.2.2 降解淀粉的制备
在250 mL三口烧瓶中加入36 g淀粉、204 g去离子水和0.03 g耐高温α-淀粉酶,在95 ℃反应1.5 h,然后在106 ℃灭活10 min,最终制得质量分数为15%的酶降解淀粉[13]。
1.2.3 淀粉接枝共聚物的制备
在150 mL三口烧瓶中加入50 g上述降解淀粉和6.6 g丙烯酰胺,用碳酸氢钠调节反应体系的pH值为8,通氮气15 min以除去溶液中的溶解氧,加入1.2 g乙酰丙酮和0.3 g壳聚糖固定化HRP,滴加4.7 mL质量分数为30%的H2O2,控制滴加时间为1 h,然后在35 ℃下反应4 h[14-17]。
反应结束后,将产物用乙醇洗涤,离心分离,在 50 ℃下真空干燥,得到去除单体的粗产物质量W1。粗产物用乙二醇/冰乙酸(体积比 60∶40)的混合液在索式萃取器中萃取8 h,去除均聚物得纯产品质量W2。采用式(1)和式(2)计算反应的接枝率(GP)和接枝效率(GE)[18-19]:

式中,W1为去除单体的粗产物质量;W2为纯接枝共聚物的质量;W0为淀粉的质量。
1.3 分析检测
1.3.1 酶的负载率测定
测定HRP溶液在402 nm处的吸光度值,本实验条件下酶的负载率按式(3)计算。

式中,A1、A2为固定化前、后 HRP溶液的紫外吸收值。
1.3.2 固定化酶比活力测定
在pH值为6.0的缓冲溶液中,以联苯三酚为底物,分别以游离酶和固定化酶作为催化剂,用H2O2引发反应,5 min后用UV分光光度计测定在430 nm(催化产物红培酚的特征峰)处的吸收值,按式(4)计算固定化酶的比活力。

式中,AF、AS为游离酶和固定化酶为催化剂时的吸收值。
1.3.3 结构表征
用EQUINOX-55傅里叶变换红外光谱仪测定产物的红外吸收光谱,用 UV1900双光束紫外分光光度计测定产物紫外吸收光谱,用INOVA-400MHz超导核磁共振仪分别测定产物的1H NMR和13C NMR谱图,用TM-1000 Tabletop型SEM观察样品的微观结构。
1.3.4 皮革性能测试
利用MSW-YD4型数字式皮革收缩温度测定仪测定复鞣革前后的收缩温度(Ts)。使用拉力机(TS2000-S型)对复鞣后成品革进行力学性能检测,主要测定抗张强度、撕裂强度和断裂伸长率。
1.3.5 皮革厚度测量
从背脊线到腹部选定A、B、C 3处,每处测3次或者3次以上,取其平均值作为该处的厚度。采用式(5)计算皮革的增厚率(E)。

式中,d2为复鞣后皮革厚度,mm;d1为复鞣前皮革厚度,mm。
1.4 鞣剂应用工艺
所得合成产物进行复鞣实验,实验方法按照文献[17]介绍进行。
2 结果与讨论
2.1 酶的负载率、比活力及储存稳定性
HRP溶液的紫外特征吸收波长为402 nm,测得402 nm处0.5 mg/mL的HRP溶液的吸收值为0.96;固定化酶后,剩余酶溶液的吸收值降低为0.40。根据式(3)计算得到酶的负载率为58.3%。经固定化酶催化后,测定反应液在 430 nm处的吸收值为0.39,用游离酶催化的吸收值为0.56,根据式(4)计算固定化酶的比活力为69.6%。将固定化HRP置于冰箱中存放20天后,结果显示依然能有效催化降解淀粉与AM进行接枝共聚合反应,表明酶的储存稳定性较好。
2.2 降解淀粉与丙烯酰胺接枝共聚物结构表征
2.2.1 FTIR分析
图1为St-g-PAM、PAM和酶降解淀粉的FTIR谱图。由图可知,酶降解淀粉(曲线c)在3420 cm-1和2925 cm-1处的吸收峰分别是淀粉分子—OH和亚甲基伸缩振动吸收峰,在1026 cm-1处为淀粉结构单元葡萄糖环的特征吸收峰。聚丙烯酰胺(曲线b)在3438 cm-1、2925 cm-1和1645cm-1处分别为胺基、亚甲基和酰胺基团中羰基的伸缩振动吸收峰。在St-g-PAM(曲线a)中,不仅1157~1074cm-1出现淀粉的特征吸收峰和1026 cm-1处的葡萄糖环特征峰,而且在3431cm-1出现—OH的伸缩振动与—NH2的伸缩振动吸收叠加峰,在 1667 cm-1出现酰胺上C=O的伸缩振动峰,在1621 cm-1处出现C—N伸缩振动和N—H变角振动的偶合吸收峰。以上表明酶降解淀粉分子链上已接枝上PAM。

图1 样品的FTIR光谱图
2.2.2 UV分析
图2为St-g-PAM、PAM和酶降解淀粉的UV谱图。由图可知,酶降解淀粉在200~300 nm波长没有吸收峰,说明淀粉在降解过程中葡萄糖单元上的羟基没有被氧化成羧基。PAM的紫外光谱特征是在远紫外光区 100~200nm波长有一个由 π→π*跃迁产生的吸收带(最大吸收波长为193 nm),而酶降解淀粉通过与丙烯酰胺接枝反应后形成的St-g-PAM最大吸收峰波长为190 nm,发生蓝移效应,吸收峰的波长向短波方向移动,以上也表明了酶降解淀粉分子链上已接枝上PAM。
2.2.3 NMR分析

图2 样品的UV光谱图

图3 酶降解淀粉和St-g-PAM的1H NMR图谱
图3为St-g-PAM和酶降解淀粉的1H NMR核磁共振波谱图,图3(b)中Ha,t、Hb,t、Hc,t代表接枝上的聚丙烯酰胺的—CH、—CH2和NH2上的氢位置。结果表明,酶降解淀粉显现出淀粉葡萄糖单位α-1,4苷键相连H1(1-4)、α-1,6苷键相连H1(1-6)、H2、H3、H4、H5、淀粉糖环的异头碳上的 H-γ、还原性末端为α(β)-异头碳上的H-α和H-β的特征质子共振峰(δ=5.01,4.92,3.39,3.37,3.23,3.64,6.31,4.57和5.60)。St-g-PAM除出现淀粉的特征吸收峰,还显现出聚丙烯酰胺的—CH、—CH2和NH2特征质子共振峰(δ=1.75、1.42和7.55)。
图4为St-g-PAM和酶降解淀粉的13C NMR核磁共振波谱图,图4(b)中Ca,t、Cb,t、Cc,t代表接枝上的聚丙烯酰胺的—CH、—CH2和C=O上的碳位置。结果表明,酶降解淀粉显现出淀粉葡萄糖单位上C1、C2、C3、C4、C5和C6共振峰(δ= 101.1、73.7、77.7、80.6、71.9和63.2)。St-g-PAM除出现淀粉的特征吸收峰,还显现出聚丙烯酰胺—CH、—CH2和C=O的13C原子的共振峰(δ= 126.1、132.4和166.8)。因此,在本文的反应体系中,确实有St-g-PAM生成。
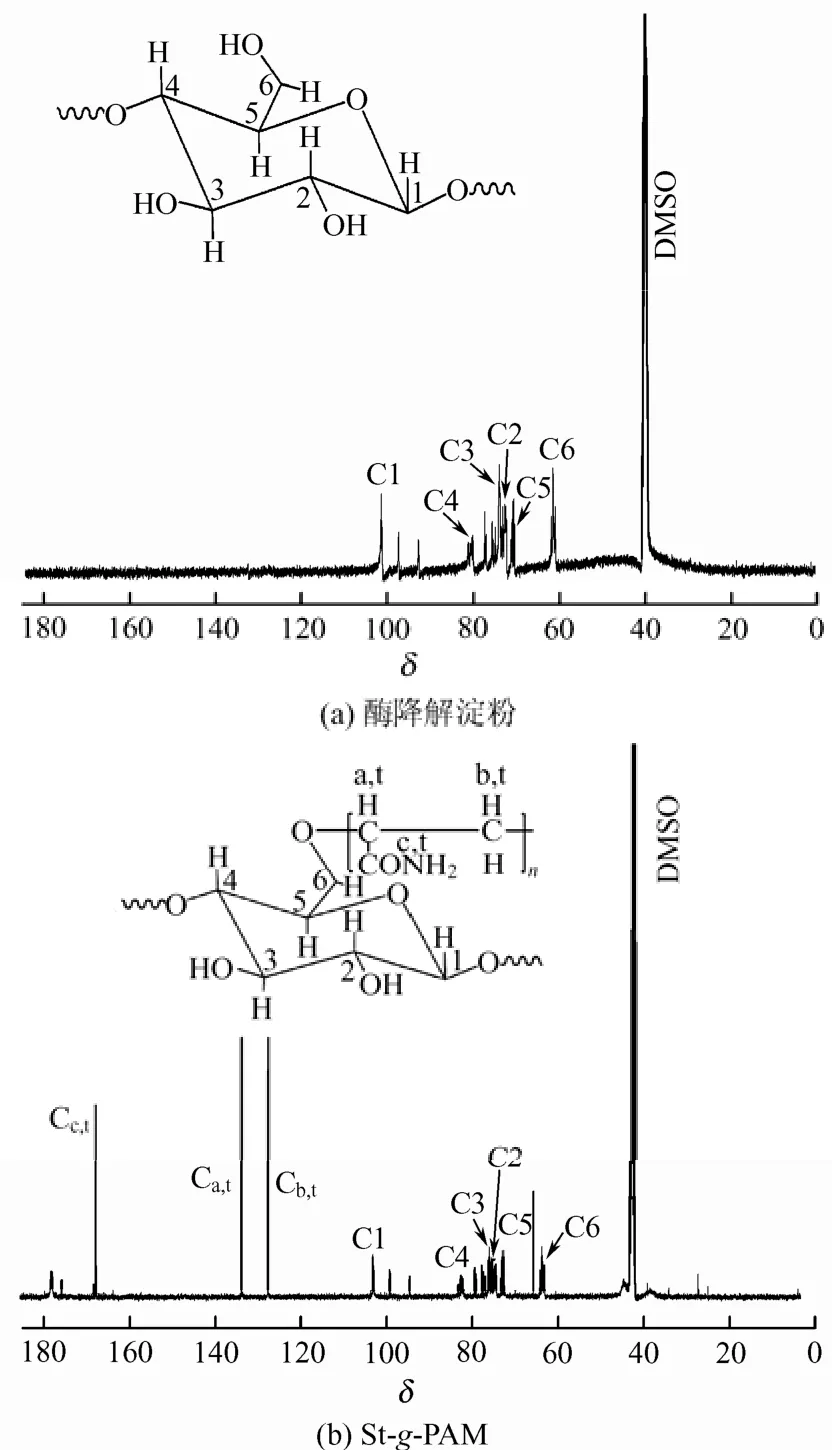
图4 酶降解淀粉和St-g-PAM的13C NMR图谱
2.2.4 SEM分析
图5是玉米淀粉、酶降解淀粉和St-g-PAM的形态扫描电镜照片。比较反应前后图片的变化可以看出,原淀粉颗粒表面光滑,结构紧密,无裂缝,呈球形颗粒结构;当玉米淀粉经过酶催化水解后,淀粉颗粒破裂成碎片;而接枝反应后不仅颗粒表面发生了变化,表现为颗粒表面粗糙且有一些空隙,而且聚丙烯酸的支链分子已渗透到淀粉颗粒的内部,两者相互渗透和结合,颗粒有些扭曲形变。
2.3 接枝反应机理的探讨
在HRP/H2O2/ACAC三元体系催化下,淀粉与AM共聚反应过程如图6所示:首先H2O2分子在HRP分子作用下发生异裂,然后在酶活性位点发生双电子氧化过程,生成一个π-阳离子自由基HRP-I,并有水生成;接着HRP-I和enol(乙酰丙酮的烯醇互变异构)进行单电子氧化还原反应,得到化合物HRP-II和一个π-阳离子自由基,接着π-阳离子自由基脱质子得到一个初级自由基,HRP-II再通过类似的单电子氧化还原反应回复到初始态。初级自由基夺取淀粉葡萄糖单元上 C6羟基上的活泼氢后形成淀粉大自由基,与丙烯酰胺发生接枝聚合反应[20-23]。

图5 玉米淀粉、酶降解淀粉和St-g-AM的电镜扫描图
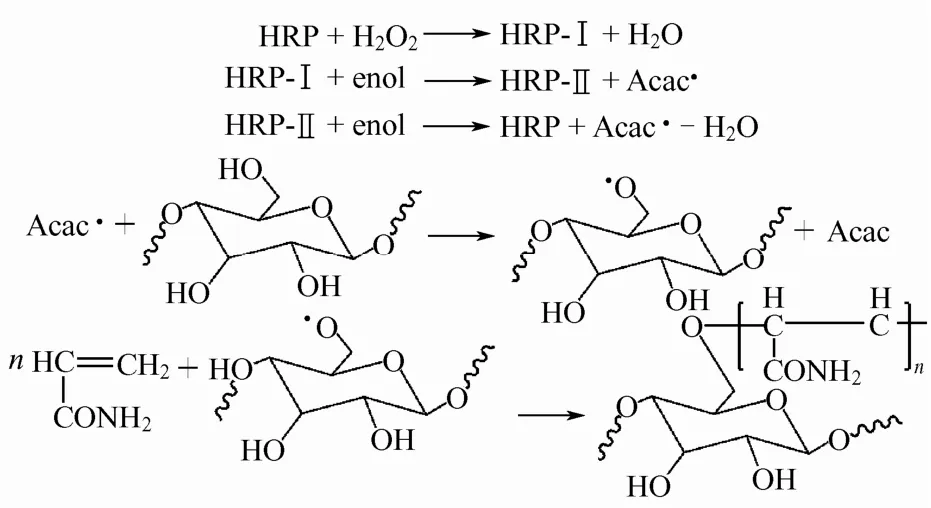
图6 淀粉接枝AM反应示意图
2.4 应用实验结果分析
选取制备的 St-g-PAM(GE和GP分别为86.3%、79.5%)进行2次平行应用试验,结果见表 1。从应用结果可以看出:应用革样收缩温度(Ts)增加,说明St-g-PAM有一定的鞣性,能够与皮胶原发生多点结合形成网络结构,使皮胶原结构改变,从而提高坯革的耐湿热稳定性;应用革样增厚率沿A、B、C方向递增,说明St-g-PAM有较好的填充作用,易与纤维发生交联作用,撑开纤维束,起到增厚作用。从成革感观性能来看,应用革样均匀度好,柔软性好。应用革样的力学性能检测结果如表2所示,可以看出St-g-PAM用于复鞣对皮革有增强作用,与皮革纤维有较好的结合。皮革断面层的SEM如图7所示,观察应用革的电镜照片可以说明皮革纤维的分散状况。可以看出,未复鞣皮革纤维编织紧密,其切面纤维束的结构完整,经过St-g-PAM复鞣后的皮革纤维分散状态比较好,说明St-g-PAM与皮革纤维进行了结合。
3 结 论
壳聚糖固定化HRP/H2O2/ACAC体系可以引发降解淀粉与丙烯酰胺发生接枝共聚物反应。由FTIR、UV和NMR证明生成了St-g-PAM,由SEM表征了淀粉反应前后微观形貌的变化。该共聚物复鞣后的革柔软、纤维分散好、选择填充性强。
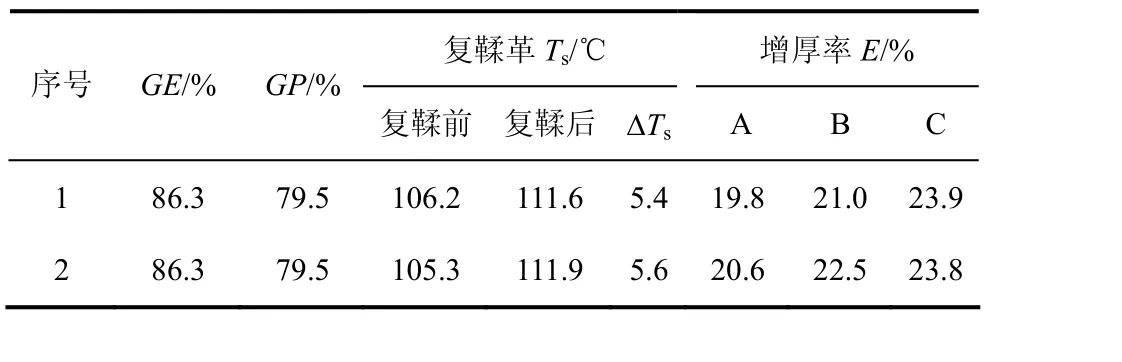
表1 复鞣剂应用结果

表2 成革各项力学性能

图7 皮革断面层的电镜照片
[1]尚小琴,刘汝锋,梁敏华,等.淀粉反相乳液法三元接枝共聚改性研究与表征[J].化工进展,2010,29(8):1517-1520.
[2]张斌,周永元.淀粉接枝共聚反应中引发剂的研究状况与进展[J].高分子材料科学与工程,2007,23(2):36-39.
[3]蔡智奇,孙建中,周其云,等.辣根过氧化物酶酶促体系引发丙烯酰胺聚合的研究[J].功能高分子学报,2004,17(1):81-86.
[4]齐耿耿,孙建中,周其云,等.酶催化聚合研究进展[J].功能高分子学报,2002,15(3):347-352.
[5]吴剑刚,孙建中,周其云.固定化 HRP海藻酸钙/壳聚糖微球催化水溶性导电聚苯胺的合成与表征[J].华东理工大学学报,2006,32(6):695-697.
[6]朱启忠.壳聚糖固定化半纤维素酶的研究[J].生物化学与生物物理进展,2000,27(3):275-276.
[7]孙建华,戴荣继,邓玉林.酶固定化技术研究进展[J].化工进展,2010,29(4):715-721.
[8]左鹏,于少明,杨杰茄,等.辣根过氧化物酶固定化载体材料的研究进展[J].材料导报,2007,21(11):46-49.
[9]陈巍,罗志刚,李忠彦,等.天然多糖在酶固定化载体材料中的应用[J].中国调味品,2006(2):4-8.
[10]姜德生,龙胜亚,肖海燕,等.磁性壳聚糖微球的制备及其用作漆酶固定化载体[J].应用化学,2005,22(10):1122-1126.
[11]宋建彬,任孝修.以壳聚糖为载体固定化青霉素酰化酶的研究[J].化工进展,2004,23(2):181-183.
[12]周桓,张秋禹,金凤.新型固定化酶载体的合成及其功能[J].化工进展,2009,28(3):462-467.
[13]郝晓敏,谷长生,宋文东,等.耐高温α-淀粉酶酶解木薯淀粉研究[J].粮食加工,2008,33(2):40-42.
[14]Shogren R L,Willett J L,Atanu Biswas.HRP-mediated synthesis of starch-polyacrylamide graft copolymers[J].Carbohydrate Polymers,2009,75:189-191.
[15]吴斌杰,孙建中,蔡智奇,等.胶囊固定化辣根过氧化物酶酶促体系引发丙烯酰胺聚合研究[J].功能高分子学报,2004,17(3):385-390.
[16]尚小琴,童张法,廖丹葵,等.反相乳液法淀粉丙烯酰胺接枝共聚反应的研究[J].高校化学工程学报,2006,20(3):460-463.
[17]党亚固,费德君,唐建华.淀粉接枝丙烯酰胺絮凝剂的制备及性能研究[J].四川大学学报,2002,34(5):50-52.
[18]董延茂,路建美.淀粉接枝聚乙烯胺的合成与性能研究[J].高校化学工程学报,2005,19(1):65-68.
[19]Athawale V D,Lele V.Synthesis and characterization of graft copolymers of maize starch[J].Carbohydrate Polymers,2000,41:407-416.
[20]高党鸽,马建中,吕斌,等.丙烯酸树脂/二氧化硅复鞣剂的制备及应用研究[J].中国皮革,2007,36(1):11-14.
[21]汪秀丽,张玉荣,王玉忠. 淀粉基高分子的研究进展[J].高分子学报,2011(1):24-33.
[22]Durand A,Lalot T,Brigodiot M,et al.Enzyme-mediated initiation of acrylamide polymerization:Reaction mechanism[J].Polymer,2000,41:8183-8192.
[23]Alain Durand,Thierry Lalot,Maryvonne Brigodiot,et al. Enzymemediated radical initiation of acrylamide polymerization:Main characteristics of molecular weight control [J].Polymer,2001,42:5515-5521.
Synthesis and characterization of graft copolymer of degraded starch and acrylamide initiated by immobilized HRP/H2O2/ACAC catalyzed system
YAN Xiaoliang,LÜ Shenghua,HOU Mingming,GONG Rui
(College of Resource and Environment,Shaanxi University of Science & Technology,Xi’an 710021,Shannxi,China)
Horseradish peroxidase(HRP)was immobilized on the surface of chitosanviaglutaraldehyde crosslinking. Then a graft copolymer of degraded starch and acrylamide was synthesized by the initiation of enzyme catalysis system composed of chitosan-immobilized HRP/H2O2/acetylacetone(ACAC). The structure of the copolymer was analyzed by FTIR,UV,NMR and SEM. The results indicated that polyacrylamide(PAM)was successfully grafted onto the degraded starch. Then,the copolymer was applied as a retanning agent. The applied results showed that the retanned leather had the merits of softness,good dispersion of fiber and strong selecting filling properties.
immobilized HRP;enzymatic polymerization;graft copolymerization;tanning agent
TQ 316.342
A
1000–6613(2011)12–2708–06
2011-05-16;修改稿日期:2011-06-16。
国家自然科学基金(20876091)、陕西省自然科学基金(SJ08B06)及陕西科技大学研究生创新基金项目。
闫小亮(1985—),男,硕士研究生。联系人:吕生华,教授,博士生导师,从事精细化学品研究。E-mail lsh630603@ yahoo.com.cn。
