神经功能损伤评分在大鼠脑缺血实验中的应用
2011-10-19程发峰宋文婷郭少英钟相根王庆国
程发峰,宋文婷,郭少英,钟相根,鲁 艺,王庆国
(1.北京中医药大学基础医学院,北京 100029;2.中国中医科学院西苑医院,北京 100089)
神经功能损伤评分在大鼠脑缺血实验中的应用
程发峰1,宋文婷2,郭少英1,钟相根1,鲁 艺1,王庆国1
(1.北京中医药大学基础医学院,北京 100029;2.中国中医科学院西苑医院,北京 100089)
脑梗塞发病率逐年增高,它严重影响了患者的生活质量。临床上,神经功能损伤评分是诊断和疗效评价的重要指标。在临床前研究中,神经功能损伤评分也越来越受到重视,是判断药效的最重要指标之一。本文介绍了评价神经功能损伤的几种常见试验和评分标准,并认为在中医药治疗脑梗塞临床前研究中,应更加重视神经功能评分,充分体现中医药的优势。
脑缺血;神经功能评分;神经功能损伤
脑缺血动物模型用于缺血性中风治疗的疗效评价已有20年的历史。已经有众多的新药被证明对脑缺血动物有神经保护作用,但是这些药物仍有待通过临床实验。这说明临床前研究仍存在一些与临床实际情况有差异的问题,药效评价指标是其中一个重要的问题。通过对回顾实验研究并与临床进行对比,大家越来越强调神经功能损伤评价的意义。除测量梗死面积外,功能评分的结果也相当重要。梗死面积缩小不一定伴随功能改善,而功能的改善才是最关键的效果指标。在很多鼠类的脑缺血实验中,都用到了一些神经功能损伤的评价方法来有效地筛选模型[1]。国际中风治疗临床前研究指南(2009)(STAIR)指出[2,3]:在脑缺血药物研究中应选择多重指标,评价应包括组织学和行为学的结果;且无论组织学还是行为学的研究都应包括中风后2到3周或更长时间中获得的数据。这证明了行为学结果的重要性,因为在临床上这与后期存活率密切相关。临床中风病人功能恢复是一个主要的终点指标,虽然神经功能与梗死灶面积有一定相关性,但在治疗过程中则希望药物在脑缺血后改善神经功能的作用更加显著。
在临床神经功能损伤评分中,往往会综合评价神经功能多方面的损伤情况。如美国国立卫生院神经功能缺损评分(NIHSS),要求对整体意识水平、感觉、视觉、运动、共济等方面进行综合评价。目前评定脑缺血动物功能和行为的方法都有了提高,但是依然存在一定的问题。如有些研究往往偏于运动功能,忽视了感觉功能等,不能全面反应神经损伤程度[4]。
1 几种神经功能损伤评分试验
神经功能包括意识状态、运动、感觉、视觉、共济和神经反射等多方面,在临床神经功能检查中以上方面都会得到体现[4]。在中风动物模型研究中,根据动物的生理病理特点,大家从运动、感觉、意识、神经反射等方面设计了很多试验,来检测动物的神经功能损伤和恢复程度。
检查运动功能的试验由于操作简单,易于观察,应用最为广泛。Bederson应用姿势反射实验[5]在悬尾状态下检查上半身姿态;Combs等[6]采用竖屏检查前肢和后肢的肌力;Hernandez等[7,8]用前肢错误放置试验检测前肢运动功能;Klintsova等[9,10]用双杠试验检测后肢运动功能;Rogers等[11,12]使用网格行走试验和旋转(运动协调)实验评价大鼠的运动功能,并证明两种评分与大鼠不同部位脑梗体积以及脑水肿程度具有显著关联性。滑棒试验将一个5 mm直径的木棒倾斜放置,将大鼠放在棒上,它会努力用四肢握紧,避免滑下。记录大鼠滑下的时间;滑梯实验,将一个0.25×0.5 m的木板倾斜 50°角,记录大鼠从滑梯顶部滑到底部的时间[13]。
由于动物实验特殊性,感觉功能检查经常通过一些反射试验来体现,或者与运动功能进行联合检查。急性神经功能损伤检查包括姿势性试验和非姿势性试验。简单的非姿势性的躯体感觉功能测试包括耳廓反射、角膜反射等。耳廓反射是通过触动物的耳道引起动物强烈摇头来记录。角膜反射是用棉签轻触动物的角膜引起眨眼。简单的姿势性躯体感觉功能包括尾巴和后爪的抗弯曲反射、头部支撑实验。尾巴和后爪的抗弯曲反射试验,逐渐将尾巴或后肢弯曲,直至其缩回,记录反映的时间。头部支撑试验,观察大鼠缺血损伤状态下头部持续支撑的时间。
较为复杂的姿势性躯体感觉功能试验如观察大鼠翻正和逃跑的反映时间,翻正试验将大鼠背部着地放在实验台上,观察其翻身时间;逃跑反射即夹痛大鼠尾巴观察其有无逃脱动作[14]。
还有一些学者综合视觉、触觉、本体位觉、运动功能和认知功能等,设计了一些检查试验。DeRyck等[15]采用前肢放置试验,通过控制大鼠的受试姿态,可以分别对视觉、触觉和本体味觉进行检查,对感觉运动综合功能进行评价。
本体感觉对称性试验是在大鼠双侧前肢各黏附一个刺激物后,观察大鼠用牙移除刺激物的顺序。如果缺血模型大鼠个体和全组显示优先移除某一侧超过70%,则继续进行定量试验。逐渐将患侧前肢的刺激物加大,直至大鼠开始优先移除患侧刺激物为止。计算此时患侧刺激物的与健侧刺激物大小的比值,作为本体感觉不对称的定量指标[16]。
平衡木试验是检查大鼠前庭运动功能的实验。将一条1.5 cm宽的平衡木悬空放置,将大鼠放在平衡木上,记录其在平衡木上维持的时间。连续3次实验,取平均值。平衡木逃离实验是检查大鼠高级前庭运动功能和协调能力的实验。造模前两天,先训练大鼠学会通过上述平衡木从一个高亮度、高噪音的箱子,逃离到对面黑暗箱子。为了加大难度,在平衡木上交叉钉入4个钉子。记录大鼠从平衡木逃离的时间。连续3次实验取平均值,两次实验之间让大鼠在黑箱内留 30 s[14]。
Bharucha[14]利用电子监视器记录大鼠自由状态下的活动,先训练大鼠适应昼夜各12 h的节律,利用电子监视器记录大鼠在白天的活动强度,如走动的总距离。
2 几种常用的评分标准
跟临床神经功能评分相似,有些学者综合几种功能实验,建立了一些神经功能评分标准。有些评分标准,既可以综合反映神经功能评分,又有较好的可操作性和稳定性,得到了广泛运用。在中风临床前药物研究中,较为公认的评分标准,简单介绍如下。
Bederson评分[5]是国内外引用频率最高的神经功能评分标准。分为四个功能等级,无神经损伤症状为0分;悬尾实验不能完全伸展对侧前爪为1分;前肢抵抗对侧推力能力下降为2分;向对侧转圈为3分。有些学者在应用Bederson评分同时,对其进行了改进,如 Menzies[17]评分总分为 4 分:A,无神经功能损伤,双前肢对称向地面伸展 (0分)B,对侧前肢持续内收 (1分)C,对侧前肢握力下降 (2分)D,轻微刺激大鼠尾巴,向对侧转圈 (3分)或者自主持续转圈 (4分)。
Belayev等[18]综合姿势反射实验和前肢放置实验,建立了评分标准。姿势反射实验中,悬尾实验前肢不对称得1分,合并前肢抵抗对侧推力下降得2分;前肢放置实验中,立即准确放置得0分,延迟或不完全放置得1分,不能准确放置得2分(表1)。
Garcia JH等[19]详细评价了受试大鼠的运动功能和感觉功能,建立了评分标准。功能正常时得分最高,18分;功能损伤最严重者得分最低,3分(表2)。
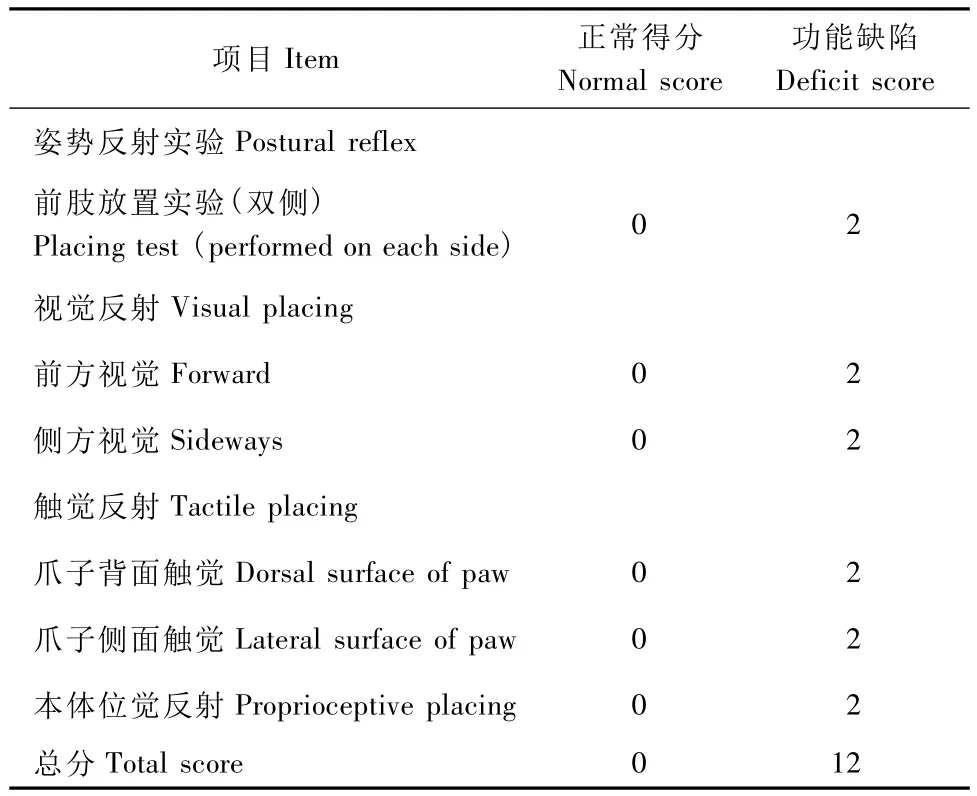
表1 大鼠局灶性脑缺血模型神经功能评分标准Tab.1 Neurological evaluation of rats with MCAO

表2 Wistar大鼠局灶性脑缺血模型神经功能评分标准Tab.2 Neurological evaluation after middle cerebral artery occlusion in Wistar rats
临床上,习惯将中风患者的神经功能损伤大致划分为一般功能损伤和局灶性功能损伤。前者反映的是患者整体神经功能和生命状态,后者则反映局部损伤造成的定位性功能缺陷。Clark[20]分别从这两个角度进行了分类更为详细的评分设计。魏尔清等[21]在大脑中动脉阻塞(MCAO)诱导局灶性脑缺血后24 h,采用悬挂实验分别测定转动的平均角和优势角以及转动次数,并用爬板实验测定小鼠攀爬角度,并与经典的行为学评价方法比较。
另外还有一些学者[13,22~26]根据动物模型特点和受试药物作用设计了一些评分标准,都从不同角度反映了大鼠神经功能的变化。
3 神经功能损伤评分与造模方法的相关性
一些学者探讨了不同方法造成的MCAO模型神经功能损伤的差异性。Petullo等[27]对 SD大鼠MCAO、MCAO+单侧颈总动脉结扎(1CCAO)和MCAO+单侧颈总动脉结(2CCAO)三种脑缺血模型分别进行了神经肌肉功能评分。结果显示MCAO+2CCAO组神经功能评分要比MCAO组严重48%,比MCAO+1CCAO组严重17%;体重减轻方面,MCAO+2CCAO组也要显著多于另外两组。在梗死体积方面,MCAO+2CCAO组也明显高于其他两组,分别是MCAO+1CCAO组的5倍,MCAO组的10倍。
Garcia等[19]发现缺血30 min再灌和缺血60 min再灌组与永久性缺血组相比,神经坏死数量明显减少,神经功能损伤程度相对较轻,且有恢复趋势。神经功能损伤评分与脑梗体积相关性比较,缺血再灌注更为显著。
席刚明等[28]采用经颈外动脉和颈总动脉阻塞大脑中动脉,以及直接阻塞大脑中动脉三种方法造模。并对3种方法所致大脑中动脉阻塞模型进行神经功能损伤评分和梗死面积测定。发现在3种模型中,第7天神经功能评分和梗死体积均有显著相关性 (r>0.7,P <0.05)。Xing氏等[29]发现 MCAO模型缺血60 min后,间断逐渐恢复血流可减轻神经功能损伤评分和梗死体积。
4 神经功能损伤评分的经时变化及与病理损伤的相关性
伴随阻塞部位病理机制的变化,神经功能评分也会出现变化。Petullo等对 SD大鼠 MCAO+2CCAO模型进行了神经肌肉功能、前庭运动功能、复杂神经功能评价,并持续观察了11 d。前3天3种功能均逐渐恶化,然后开始稍有恢复,大概在第5天左右逐渐趋于稳定。Grabowski等[27]对自发性高血压大鼠进行 MCAO造模,并观察了前肢功能实验、安非他命致旋转实验、感觉运动综合实验,其评价持续3个月。与安非他命致旋转实验、感觉运动综合实验相比,前肢功能实验评分更为稳定,反应了MCAO所致神经功能缺失。并且前肢功能实验与梗死体积相关性良好,3个月 r值分别为0.79,0.76,0.77,(P <0.001)。说明前肢功能实验是一种适合长时间观察脑缺血动物神经功能的方法[24]。
神经功能评分从功能角度反映了脑缺血的病理损伤,而梗死体积和神经元密度等指标评价了脑缺血造成的组织损伤。有些学者对功能和组织两方面指标间相关性进行了评价。Wahl等[26]利用大脑中动脉电凝法制备大脑中动脉缺血模型,并评价模型的梗死体积和神经功能。他发现缺血造成皮质和尾状核的大面积缺血。神经功能方面,感觉运动缺失和偏瘫表现明显(P<0.001),被动回避实验显示其记忆存储功能也有显著差异(P<0.05)。但是open-field实验和Y迷宫实验未显示有显著差异,神经功能损伤和组织学检查相关性不明显。
魏尔清等[21]定量评价总得分与脑梗死体积及海马CA1区、皮层及皮层下神经元密度的相关系数,分别为 0.635、-0.538、-0.546、-0.719(P <0.001);定量测定指标中,爬板角度及其计分与脑梗死体积及皮层下神经元密度的相关性较强;两种行为学评价总分与脑梗死体积及神经元密度之间的相关性均较为密切。此外,定量评价总分与Petullo S评分及Bederson S评分之间均密切相关。相关系数分别为0.744(n=88,P<0.001)和0.761(n=50,P <0.001)。
随着目前临床上对脑梗塞诊断水平的提高,越来越多的轻型中风患者得到诊治。所以仅仅以病死率和脑梗体积来评价中风的预后,已经不适合现代要求。神经功能损伤评分作为中风的另外一项终点指标,越来越受到重视。在临床前研究中,应用一系列神经功能损伤评分对动物模型进行评价,如运动功能、本体感觉、视觉功能等,是判断药效的最重要指标之一。评价大脑不同部位的损伤与各种神经功能损伤间的相关性,将成为一个重要的研究方向[30,31]。
5 神经功能评分在中医药临床前研究中的价值
中医药在临床上针对脑梗有显著作用,特别体现在改善中风患者急性期和恢复期神经功能损伤上[32~35]。针灸疗法对于中风后吞咽困难、小便失禁等功能障碍疗效肯定[36,37]。中风病是一种严重影响患者神经功能和生活质量的疾病,临床上相比梗死病灶,我们更加关注病人功能的改善。如临床试验中经常用到的中风病诊断和疗效评定标准中,非常强调神经功能评分的重要性。疗效判定标准完全根据神经功能缺损积分和生活能力状态的改善[38,39]。
与中医药在中风病临床治疗上的显著优势不相符的是,国内中医药治疗中风临床前研究对神经功能评分重视程度不够。国内治疗脑梗塞药物研究中存在神经功能评价实验不够丰富,神经功能评分标准单一,神经功能损伤相关性研究较少等问题。中医药走向世界,一方面应尽量选择国际公认的疾病模型与药效指标;另一方面结局指标应能够体现中医药的治疗特色。所以在中医药治疗脑梗塞临床前研究中,我们应更加重视神经功能评分,充分体现中医药的优势。
[1] Willing AE.Experimental models: help or hindrance.Stroke,2009 Mar;40(3 Suppl):S152-4.
[2] Fisher M,Feuerstein G,Howells DW,Hurn PD,Kent TA,Savitz SI,et al.Update of the Stroke Therapy Academic Industry Roundtable PreclinicalRecommendations[J]. Stroke,2009 Feb 26.
[3] RotherJ.Neuroprotection does not work!Stroke;a journal of cerebral circulation[J].2008 Feb;39(2):523-4.
[4] Recommendations for standards regarding preclinical neuroprotective and restorative drug development[J].Stroke,1999 Dec;30(12):2752-8.
[5] Bederson JB,Pitts LH,Tsuji M,Nishimura MC,Davis RL,Bartkowski H.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986 May-Jun;17(3):472-6.
[6] Combs DJ,D'Alecy LG.Motor performance in rats exposed to severe forebrain ischemia: effect of fasting and 1,3-butanediol[J].Stroke,1987 Mar-Apr;18(2):503-11.
[7] HernandezTD, SchallertT. Seizures and recovery from experimental brain damage[J].Experimental neurology.1988 Dec;102(3):318-24.
[8] Ding Y,Zhou Y,Lai Q,Li J,Gordon V,Diaz FG.Long-term neuroprotective effect of inhibiting poly(ADP-ribose)polymerase in rats with middle cerebral artery occlusion using a behavioral assessment[J].Brain research.2001 Oct 12;915(2):210-7.
[9] Kim MG,Choi JH,Lim JP,Kim DK,Shin TY,Boo Y,et al.Protective effects of a novel herbal decoction on focal cerebral ischemia in a rodent model[J].Neurological research.2007;29 Suppl 1:S16-22.
[10] Klintsova AY,Cowell RM,Swain RA,Napper RM,Goodlett CR,GreenoughWT.Therapeuticeffectsofcomplexmotor training on motor performance deficits induced by neonatal bingelike alcohol exposure in rats.I.Behavioral results[J].Brain research.1998 Jul 27;800(1):48-61.
[11] Rogers DC,Campbell CA,Stretton JL,Mackay KB.Correlation between motor impairment and infarct volume after permanent and transient middle cerebral artery occlusion in the rat[J].Stroke;a journal of cerebral circulation.1997 Oct;28(10):2060-5;discussion 6.
[12] Saleem S,Ahmad M,Ahmad AS,Yousuf S,Ansari MA,Khan MB,et al.Behavioral and histologic neuroprotection of aqueous garlic extract after reversible focal cerebral ischemia[J].Journal of medicinal food.2006 Winter;9(4):537-44.
[13] Bharucha VA,Wakade CG,Mahadik SP,Karpiak SE.GM1 ganglioside treatment reduces functional deficits associated with cortical focal ischemia[J].Experimental neurology.1991 Oct;114(1):136-9.
[14] Dixon CE,Clifton GL,Lighthall JW,Yaghmai AA,Hayes RL.A controlled cortical impact model of traumatic brain injury in the rat[J].Journal of neuroscience methods.1991 Oct;39(3):253-62.
[15] De Ryck M,Van Reempts J,Borgers M,Wauquier A,Janssen PA. Photochemical stroke model: flunarizine prevents sensorimotor deficits after neocortical infarcts in rats[J].Stroke,1989 Oct;20(10):1383-90.
[16] Schallert T,Fleming SM,Leasure JL,Tillerson JL,Bland ST.CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke,cortical ablation,parkinsonism and spinal cord injury[J].Neuropharmacology.2000 Mar 3;39(5):777-87.
[17] Menzies SA,Hoff JT,Betz AL.Middle cerebral artery occlusion in rats: a neurologicaland pathologicalevaluation ofa reproducible model[J].Neurosurgery.1992 Jul;31(1):100-6;discussion 6-7.
[18] Belayev L,Alonso OF,Busto R,Zhao W,Ginsberg MD.Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and pathological evaluation of an improved model[J].Stroke,1996 Sep;27(9):1616-22;discussion 23.
[19] Garcia JH,Wagner S,Liu KF,Hu XJ.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats[J].Statistical validation.Stroke,1995 Apr;26(4):627-34;discussion 35.
[20] Clark WM,Lessov NS,Dixon MP,Eckenstein F.Monofilament intraluminal middle cerebral artery occlusion in the mouse[J].Neurological research.1997 Dec;19(6):641-8.
[21] 魏尔清,朱朝阳,徐秋琴等.一种改进的小鼠局灶性脑缺血神经症状定量评价方法[J]. 生理学报,2003,(6):742-7.
[22] Markgraf CG,Green EJ,Hurwitz BE,Morikawa E,Dietrich WD, McCabe PM, et al. Sensorimotor and cognitive consequences of middle cerebral artery occlusion in rats[J].Brain research.1992 Mar 20;575(2):238-46.
[23] DeGraba TJ, Ostrow P, Hanson S, Grotta JC. Motor performance, histologic damage, and calcium influx in rats treated with NBQX after focal ischemia[J].J Cereb Blood Flow Metab.1994 Mar;14(2):262-8.
[24] GrabowskiM, Brundin P, Johansson BB. Paw-reaching,sensorimotor,and rotational behavior after brain infarction in rats[J].Stroke;a journal of cerebral circulation.1993 Jun;24(6):889-95.
[25] PerssonL,Hardemark HG,Bolander HG,Hillered L,Olsson Y.Neurologic and neuropathologic outcome after middle cerebral artery occlusion in rats[J].Stroke,1989 May;20(5):641-5.
[26] Wahl F,Allix M,Plotkine M,Boulu RG.Neurological and behavioral outcomes of focal cerebral ischemia in rats[J].Stroke,1992 Feb;23(2):267-72.
[27] Petullo D,Masonic K,Lincoln C,Wibberley L,Teliska M,Yao DL.Model development and behavioral assessment of focal cerebral ischemia in rats[J].Life sciences.1999;64(13):1099-108.
[28] Xi GM,Wang HQ,He GH,Huang CF,Wei GY.Evaluation of murine models of permanent focal cerebral ischemia[J].Chinese medical journal.2004 Mar;117(3):389-94.
[29] Xing B,Chen H,Zhang M,Zhao D,Jiang R,Liu X,et al.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke,2008 Aug;39(8):2362-9.
[30] Kuroiwa T, Okeda R. Checkpoints and pitfalls in the experimental neuropathology ofcirculatory disturbance[J].Neuropathology.2003 Mar;23(1):79-89.
[31] Hackam DG,Redelmeier DA.Translation of research evidencefrom animals to humans[J].Jama.2006 Oct 11;296(14):1731-2.
[32] Wu B,Liu M,Zhang S.Dan Shen agents for acute ischaemic stroke.The Cochrand Collaboration.Oxford:Update Software:2007,Issue 2.
[33] Wu HM,Tang JL,Lin XP,Lau J,Leung PC,Woo J,et al.Acupuncture for stroke rehabilitation. The Cochrand Collaboration.Oxford:Update Software:2006,Issue 3.
[34] Yuan Y,Zeng X,Luo Y,Li Z,Wu T.Chuanxiong-type preparations for acute ischemic stroke. The Cochrand Collaboration.Oxford:Update Software:2008,Issue 4.
[35] Zhuo Q,Yang X,Wu T,Liu G,Zhou L.Tongxinluo capsule for acute stroke.The Cochrand Collaboration.Oxford:Update Software:2008,Issue 4.
[36] Thomas LH,Cross S,Barrett J,French B,Leathley M,Sutton CJ,et al.Treatment of urinary incontinence after stroke in adults.The Cochrand Collaboration.Oxford:Update Software:2008,Issue 1.
[37] Xie Y,Wang L,He J,Wu T.Acupuncture for dysphagia in acute stroke.The Cochrand Collaboration.Oxford:Update Software:2008,Issue 3.
[38] 国家中医药管理局脑病急症协作组 中风病诊断与疗效评定标准(试行)[J].北京中医药大学学报.1996,01(01):55-56.
[39] 全国第四届脑血管病学术会议 脑卒中患者临床神经功能缺损程度评分标准(1995)[J].中华神经科杂志.1996,12(06):381-383.
The Application of Neurological Deficit Scoring in Cerebral Ischemia Rats
CHENG Fa-feng1,SONG Wen-ting2,GUO Shao-ying1,ZHONG Xiang-gen1,LU Yi1,WANG Qing-guo1
(1.School of Preclinical Medicine,Beijing University of Chinese Medicine,Beijing 100029,China;2.Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing 100091,China)
Cerebral ischemia,which have a strong negative impact on patients life quality,is an increasing disease in recent years.During clinical treatment,neurological deficit scoring is an important index of evaluation both on diagnosis and healing effect.While in preclinical research,scoring system has been attached more and more importance since it is one of the major parameter for medicine efficacy evaluation.This article is aimed to introduce several experiments and scoring criteria which are widely used in ischemia research;and conclude that neurological deficit rating system should be highlighted and optimized in experimental study to carry forward advantages of integrated medicine in improving cerebral ischemia.
Cerebral ischemia;Neurological function scoring;Neurological deficit
R332
A
1671-7856(2011)03-0043-06
2010-08-16
10.3969/j.issn.1671.7856.2011.03.011
“重大新药创制”科技重大专项(No.2009ZX09102-136);国家自然科学基金项目(No.90709051)。
程发峰,(1982-),男,博士生,主要从事神经药理学研究。
王庆国,教授,Wangqg8558@sina.com。
